Periostin對自體脂肪移植成活率的影響
李東 黃曉翔 袁捷 俞哲元 徐梁 徐海淞 韋敏
Periostin對自體脂肪移植成活率的影響
李東 黃曉翔 袁捷 俞哲元 徐梁 徐海淞 韋敏
目的 探索Periostin復合自體脂肪顆粒移植后,對移植脂肪血管化及成活率的影響,以明確Periostin在自體脂肪移植中的作用。方法 體外實驗驗證低氧條件下Periostin對脂肪干細胞成血管的影響,RT-PCR檢測CD133及CD144的基因表達情況;將Periostin復合自體脂肪組織移植到裸鼠體內,觀察移植脂肪的成活情況。結果 在低氧條件下,Periostin組細胞成血管能力明顯優于空白對照組;RT-PCR檢測結果顯示,Periostin組的CD133和CD144表達量明顯高于空白對照組;Periostin復合自體脂肪移植后1、3、6個月,移植脂肪成活率分別為79.50%±3.70%、67.71%±4.08%和64.78%±5.78%,明顯高于對照組(51.83%±5.97%、39.45%±10.32%和34.20%±10.61%)。結論 Periostin能夠改善脂肪移植早期組織對缺氧的耐受性,促進自體脂肪顆粒移植后的早期血管化,有利于移植脂肪顆粒的存活,可有效改善脂肪移植的成活率。
脂肪移植 成活率 低氧 骨膜蛋白
各種畸形、創傷、腫瘤切除等造成的機體軟組織缺損,嚴重影響患者的身心健康,對其進行修復和重建是整復外科的重要內容[1-2]。自體脂肪組織作為軟組織填充材料,具有來源充足,獲取簡單,供區創傷較小,不產生免疫排斥等優點。但是,自體脂肪移植術后常出現脂肪的吸收、感染、液化壞死、鈣化以及囊腫等并發癥[3-4],導致移植脂肪成活率低下,嚴重限制了自體脂肪移植的臨床應用。
目前,普遍認為導致移植脂肪組織成活率低的最主要因素是移植微環境的缺血缺氧[1],文獻報道指出,脂肪組織對低氧刺激十分敏感,如果氧分壓持續低于其所能耐受的最低值,脂肪組織細胞很快就會死亡[5],從而導致多種并發癥。
Periostin(骨膜蛋白),是一種分泌型的細胞外基質蛋白,可以為細胞的生存提供微環境。有研究表明,Periostin能抑制低氧、低營養等應激狀態誘導的內皮細胞的凋亡[6]。此外,Periostin還與內皮細胞遷移的趨化性和趨觸性密切相關[7]。本研究探索Periostin復合自體脂肪顆粒移植后對移植脂肪血管化及成活率的影響,明確Periostin在自體脂肪移植中的作用。
1 材料及方法
1.1 實驗試劑及器材
DMEM低糖培養基(Hyclone,美國);胎牛血清,0.25%胰蛋白酶 (GIBCO,美國);恒溫CO2培養箱(Forma Scientific,美國);無菌超凈工作臺(上海博訊實驗器材有限公司)。
1.2 實驗動物
先天性無胸腺小鼠30只,4~6周齡,雄性(我院實驗動物中心提供)。
1.3 脂肪來源
脂肪來源于健康的吸脂患者,女性,年齡22~41歲,均獲患者知情同意。
1.4 實驗方法
1.4.1 脂肪干細胞的分離培養
獲取的脂肪PBS洗滌2~3遍,修剪成1 mm3大小的顆粒,加入等體積的1.5 mg/mL NB4膠原酶,于37℃恒溫搖床上消化60 min,消化后離心、重懸過濾,并接種于培養皿;根據生長情況定期傳代,細胞純化后對其干性進行鑒定。
1.4.2 Periostin在低氧條件下對脂肪干細胞的成血管作用的影響
制備培養基,分別為100 ng/mL Periostin蛋白組、50 ng/mL VEGF因子組(陽性對照組)和空白對照組;將細胞接種到含matrigel的24孔板,37℃低氧培養箱中培養;每3天換液一次,倒置顯微鏡下觀察細胞形態變化并拍照記錄,對各組成血管情況進行統計分析。
1.4.3 Periostin對脂肪干細胞基因表達的影響
低氧細胞培養及勻漿液制備:低氧培養10 d后,去上清,加入Trizol細胞裂解液,每10 cm2面積加1 mL,裂解細胞,制備細胞勻漿;提取RNA并行RTPCR檢測,檢測CD133及CD144的基因表達情況。
1.4.4 Periostin對自體脂肪移植成活率的影響
將抽脂獲取的脂肪顆粒洗凈,剪碎后分別與Periostin(Periostin組)及VEGF(VEGF組,陽性對照組)混合,并設立空白對照組;將實驗鼠麻醉后,用18號針頭將1 mL脂肪顆粒移植到實驗鼠皮下,局部按壓3~5 min,表面涂抹紅霉素眼膏;術后單獨分籠飼養,防止相互撕咬。術后第2天,觀察裸鼠的成活及傷口情況。術后不同時間點取材,排水法檢測存留的脂肪體積,動態觀察各組移植脂肪的成活情況。
1.5 統計學分析
采用SPSS 13.0軟件進行統計學分析,成管的數目、基因表達變化、術后存活率的比較采用t檢驗及方差分析,P<0.05為差異有統計學意義。
2 結果
2.1 脂肪干細胞的形態學觀察
人脂肪干細胞經膠原酶消化后接種培養,2~3 h后可有少量細胞貼壁,傳代培養至第3代后鏡下觀察,脂肪干細胞呈形態均一的長梭形,細胞呈旋渦狀生長,放射狀排列,細胞狀態良好。細胞經干性鑒定為脂肪干細胞(圖1、2)。
圖1 脂肪干細胞的形態學觀察(標尺:50 μm)Fig.1 Morphology of adipose stem cells(Scale:50 μm)
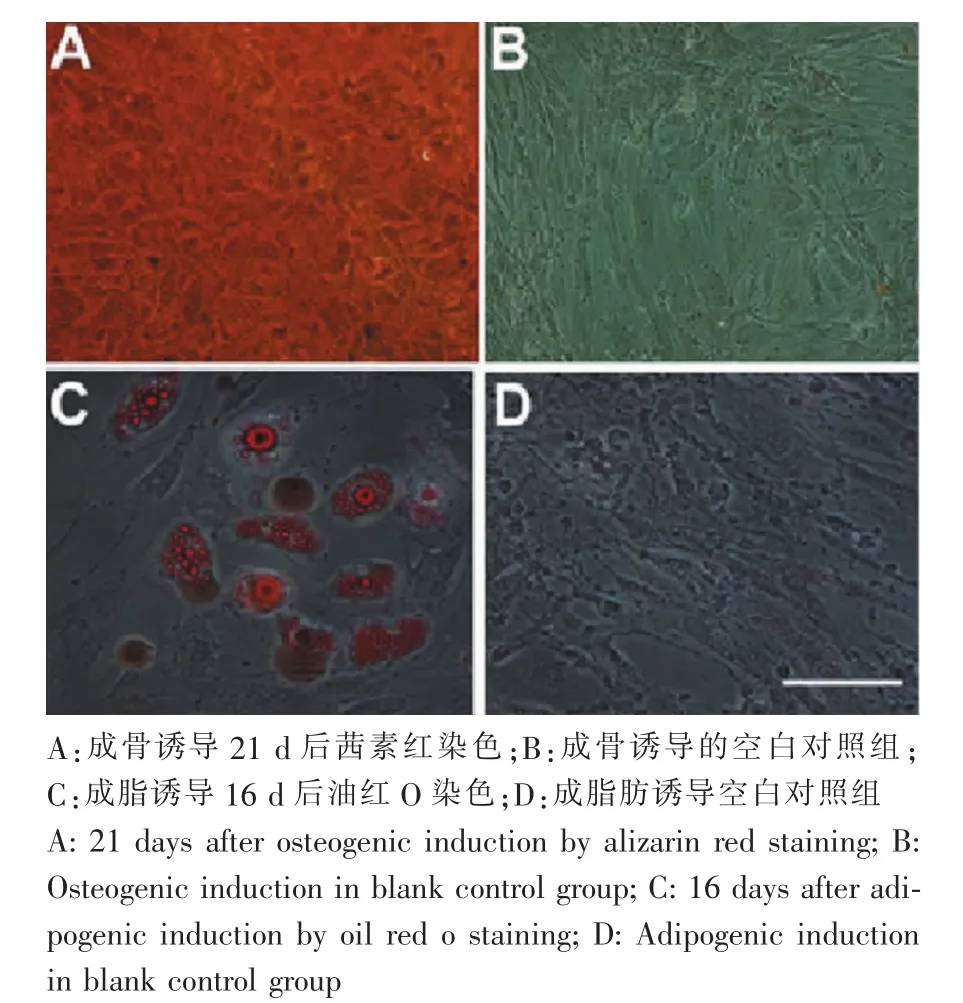
圖2 多向誘導分化潛能(標尺:50 μm)Fig.2 The potential ability of multi-differentiation (Scale:50 μm)
2.2 Periostin對ASC細胞成血管的影響
鏡下可見,隨著誘導時間的延長,各組成血管差異越來越明顯。3 d時部分細胞團塊有“出芽”現象,以Periostin組及VEGF組出芽現象最為明顯,而空白對照組的出芽現象尚不明顯。9 d時,Periostin組相互之間的網絡狀連接較VEGF組更為發達,說明在重組蛋白Periostin的誘導刺激下,脂肪干細胞的成管能力較強(圖3)。
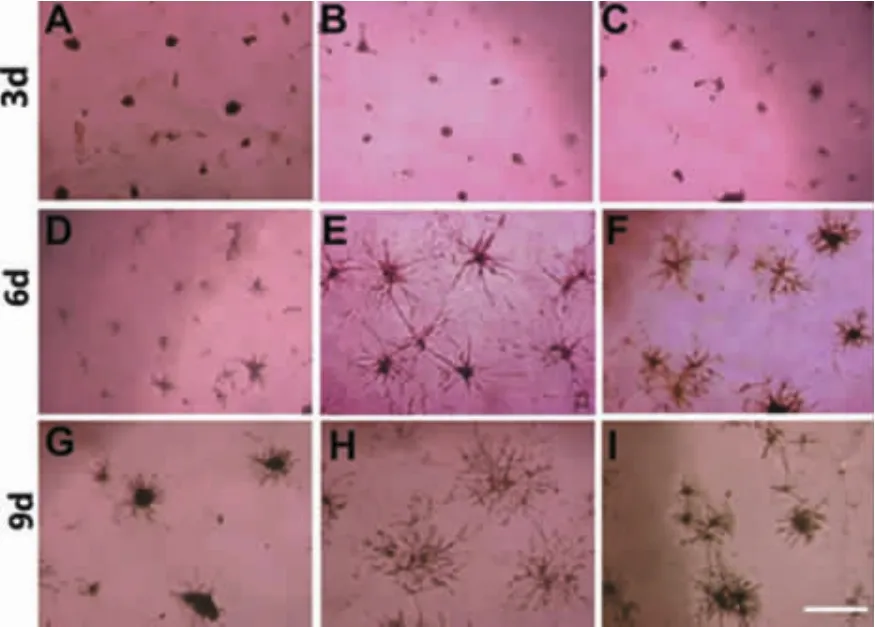
圖3 低氧條件下各組成血管情況(40×)Fig.3 The condition of tabulation in each group under hypoxia(40×)
統計發現,Periostin及VEGF組在低氧條件下誘導ASC成血管的能力較空白對照組更強,其中Periostin在第9天誘導成血管形成的網絡狀結構強于 VEGF陽性對照組 (P<0.05),而 Periostin及VEGF組均明顯強于空白對照組(P<0.05)(圖4)。
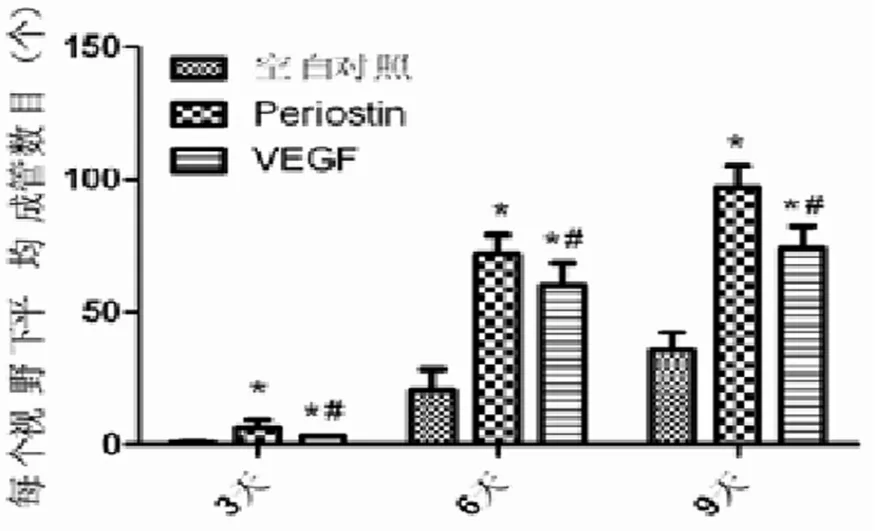
圖4 低氧條件下ASCs成血管統計(*:P<0.05,vs空白對照組;#:P<0.05,vs Periostin組)Fig.4 The statistics of tabulation of ASCs under hypoxia (*:P<0.05,vs blank control group;#:P<0.05,vs Periostin group)
2.3 Periostin對ASCs基因表達的影響
低氧條件誘導7 d后,RT-PCR檢測CD133(內皮祖細胞相關抗原)、CD144(成熟內皮細胞相關抗原)基因表達發現,CD133及CD144在Periostin組的表達量與VEGF陽性對照組相當(P>0.05),在空白對照組的表達量最低(P<0.05)(圖5)。
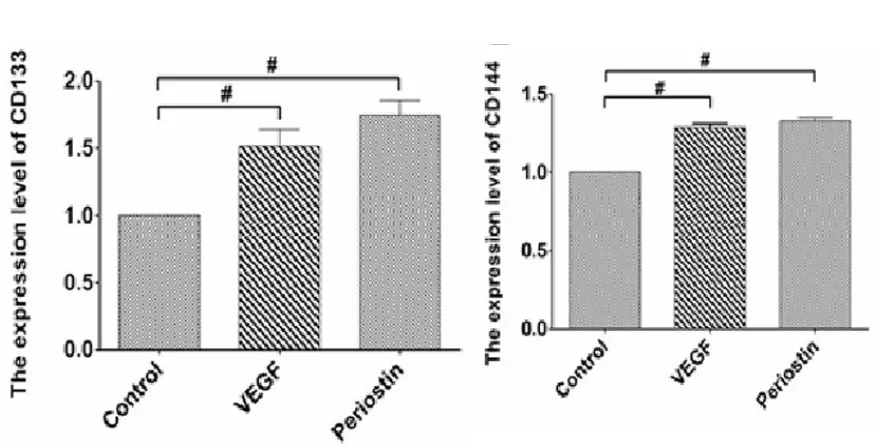
圖5 低氧誘導后各組CD133、CD144基因表達Fig.5 Gene expression of CD133 and CD144 in each group under hypoxia
2.4 移植脂肪的大體形態觀察及存活率分析
術后不同時間點取材觀察移植脂肪的大體形態,各組移植脂肪的體積變化呈一定的規律性。一般在移植術后早期,移植脂肪區域表現為體積略有增大,為炎性腫脹,隨著炎性腫脹的消退,移植脂肪的體積逐漸變小,此為脂肪組織被吸收的表現。
移植術后2周,不同組別移植脂肪的體積差異較大。單純脂肪顆粒組(空白對照)吸收較明顯,而Periostin+脂肪顆粒移植組,VEGF+脂肪顆粒組吸收相對緩慢,但均有不同程度的液化壞死;移植術后4周,單純脂肪顆粒組殘留脂肪體積最小,伴有較明顯的液化壞死,其他兩組吸收程度輕并未見明顯的液化壞死(圖6)。
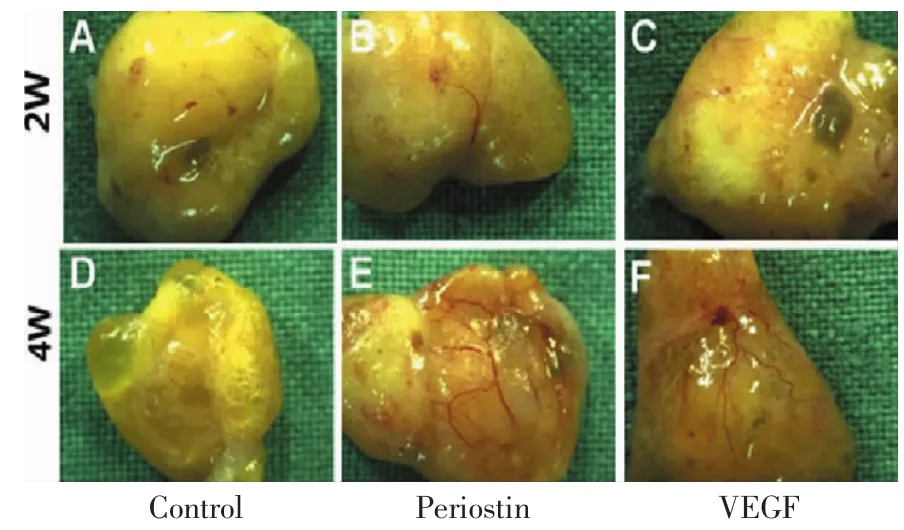
圖6 移植脂肪組織的大體形態Fig.6 General observation of transplanted adipose tissue
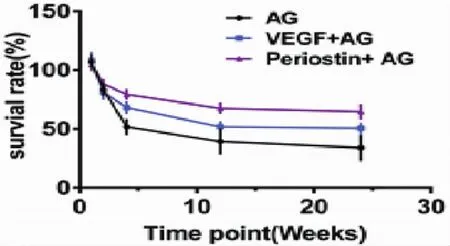
圖7 移植脂肪的成活率Fig.7 The survival rate of transplanted fat
脂肪移植術后不同時間點取材,立即用排水法測量術后存留的脂肪體積。移植術后1、3、6個月,單純脂肪顆粒組脂肪存活率分別為51.83%±5.97%、39.45%±10.32%和34.20%±10.61%;Periostin復合脂肪顆粒移植組成活率分別為 79.50%±3.70%、67.71%±4.08%和64.78%±5.78%;VEGF復合脂肪顆粒移植組的成活率分別為68.33%±4.50%、52.86%± 6.37%和49.71%±7.76%。上述結果采用單因素方差分析比較,結果顯示,術后1、3、6個月,三組之間比較,兩兩之間均有顯著差異(P<0.05)(圖7)。
3 討論
目前有關自體脂肪移植的報道均認為脂肪移植后易出現不同程度的液化壞死[8-13],大多數移植脂肪組織液化壞死都是由于移植后缺血缺氧導致的[5]。因此,我們試圖改善脂肪移植后缺血、缺氧的情況,并提高移植組織對低氧的耐受性,以促進移植脂肪的成活。
為明確Periostin在低氧條件下誘導脂肪干細胞的成血管作用,本實驗首先分離培養脂肪干細胞并行干性鑒定,然后將脂肪干細胞接種在已鋪matrigel的24孔板中,并于低氧條件下培養,定期觀察。結果發現,培養第3天空白對照組、Periostin組及VEGF組三者無明顯差異。我們認為這是因為細胞在低氧環境下適應需要一個過程,因此各個組別的差異并不顯著。在隨后的觀察中發現,隨著時間的延長,Periostin組、VEGF組的細胞相互連接形成了更多的不同大小管腔的網絡狀結構,其中Periostin組成血管的數目更多。說明Periostin與VEGF一樣,具有在低氧條件下促進人脂肪干細胞形成血管的功能。隨著低氧誘導時間的延長,Periostin組的細胞耐受缺氧的能力逐漸表現出來,說明在體外條件下,Periostin的確能夠提高細胞對缺氧的耐受性,同時具有促進脂肪干細胞形成血管的能力。
RT-PCR檢測血管內皮細胞相關抗原CD133、CD144基因表達。結果發現,Periostin組、VEGF組的CD133、CD144表達量均高于空白對照組。這說明Periostin及VEGF能夠有效促進血管內皮細胞相關抗原的表達,其對促進脂肪干細胞向血管內皮細胞轉化具有積極作用。
以上體外實驗的結果提示,在低氧條件下,Periostin有助于提高脂肪干細胞對缺氧的耐受性,可以促進脂肪干細胞向血管內皮細胞轉化并成血管,達到甚至超過了VEGF陽性對照組的效果。
通過進一步的體內實驗,我們發現Periostin能夠有效提高移植脂肪的成活率,其作用可能是通過提高移植早期組織細胞對低氧的耐受性和促進移植脂肪的血管化來實現的。本實驗研究結果對于提高移植脂肪的成活率具有重要意義,亦可推廣應用于低氧或缺血引起的各種病理狀態。但是其具體機制有待于進一步深入研究。
4 總結
本實驗證實Periostin能夠促進移植脂肪的成活,可能是通過促進移植脂肪的血管化和提高了組織細胞對移植后低氧的耐受性兩方面實現的。Periostin作為促進移植脂肪成活的新的因子,對其進行深入研究具有重要的臨床應用價值。
[1] Patrick CJ.Tissue engineering strategies for adipose tissue repair [J].Anat Rec,2001,263(4):361-366.
[2] Patrick CJ.Adipose tissue engineering:the future of breast and soft tissue reconstruction following tumor resection[J].Semin Surg Oncol,2000,19(3):302-311.
[3] Rao A,Saadeh PB.Defining fat necrosis in plastic surgery[J]. Plast Reconstr Surg,2014,134(6):1202-1212.
[4] Carvajal J,Patino JH.Mammographic findings after breast augmentation with autologous fat injection[J].Aesthet Surg J, 2008,28(2):153-162.
[5] 趙建輝.移植脂肪的成活及干細胞對其促進作用的研究[D].西安:第四軍醫大學,2012.
[6] Bao S,Ouyang G,Bai X,et al.Periostin potently promotes metastatic growth of colon cancer by augmenting cellsurvival via the Akt/PKB pathway[J].Cancer Cell,2004,5(4):329-339.
[7] Lamalice L,Le Boeuf F,Huot J.Endothelial cell migration during angiogenesis[J].Circ Res,2007,100(6):782-794.
[8] Alencar JC,Andrade SH,Pessoa SG,et al.Autologous fat transplantation for the treatment of progressive hemifacial atrophy (Parry-Romberg syndrome:case report and review of medical literatute)[J].An Bras Dermatol,2011,86(4 Suppl 1):S85-S88.
[9] Hu J,Yin L,Tang X,et al.Combined skeletal and soft tissue reconstruction for severe Parry-Romberg syndrome[J].J Craniofac Surg,2011,22(3):937-941.
[10] Yoshimura K,Sato K,Aoi N,et al.Cell-assisted lipotransfer for cosmetic breast augmentation:supportive use of adipose-derived stem/stromal cells[J].Aesthetic Plast Surg,2008,32(1):48-55.
[11] Rosing JH,Wong G,Wong MS,et al.Autologous fat grafting for primary breast augmentation:a systematic review[J].Aesthetic Plast Surg,2011,35(5):882-890.
[12] Marcus BC.The use of autologous fat for facial rejuvenation[J]. Obstet Gynecol Clin North Am,2010,37(4):521-531.
[13] Buckingham ED,Glasgold R,Kontis T,et al.Volume rejuvenation of the facial upper third[J].Facial Plast Surg,2015,31(1):43-54.
Effect of Periostin on the Survival Rate of Autologous Fat Transplantation
LI Dong,HUANG Xiaoxiang,YUAN Jie,YU Zheyuan,XU Liang,XU Haisong,WEI Min.Department of Plastic and Reconstructive Surgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding author:WEI Min (E-mail:drweimin@163.com).
Objective To explore the effect of Periostin on the vascularization and survival rate of autologous fat transplantation,and to find out the role of Periostin in autologous fat transplantation.Methods The special effect of Periostin in inducing vascularization of adipose stem cells under hypoxia was observed in vitro.The expression of CD133 and CD144 of ASCs under hypoxia were tested by RT-PCR.Then,the adipose tissue compounded with Periostin was transplanted into nude mice,and the survival rate of the transplanted fat tissue was detected at different time points after transplantation. Results Periostin group showed a higher vascularization degree under hypoxia,compared with blank control group.The expression of CD133 and CD144 of ASCs under hypoxia in Periostin group were higher than in blank control group.Periostin composite with autologous fat transplantation improved the survival rate of fat transplantation at each time point(79.50%± 3.70%,67.71%±4.08%,64.78%±5.78%),which were better than simple autologous fat transplantation (51.83%±5.97%, 39.45%±10.32%,34.20%±10.61%).Conclusion Periostin is able to improve fat survivability under hypoxia during the early stage,and promote the early stage vascularization of autologous fat granules after transplantation,which is beneficial to the survival of the transplanted fat tissue.
Fat transplantation;Survival rate;Hypoxia;Periostin
R622+.9
A
1673-0364(2015)06-0358-04
10.3969/j.issn.1673-0364.2015.06.003
2015年8月9日;
2015年9月27日)
國家自然科學基金(81471886);上海市科委重點項目(134119a2000)。
200011 上海市 上海交通大學醫學院附屬第九人民醫院整復外科。
韋敏(E-mail:drweimin@163.com)。

