鉛鎘重金屬與生殖內質網應激研究進展
劉康生,顧平清,鐘天鷹綜述,陳文軍審校
近年來發現內質網應激(ndoplasmic reticulum stress,ERS)是區別于線粒體途徑且能獨立導致細胞凋亡的一條新的通路。缺氧、缺血再灌注損傷、病毒感染等均可引發ERS。內質網有很強的保持內環境穩態的能力,ERS一旦發生就會立即激活自我調整的信號反應機制,以期恢復穩態。ERS被普遍認為是細胞早期適應性反應。當ERS時間過久時,細胞代償機制由凋亡機制取代,細胞進入凋亡[1]。重金屬(鉛)能導致多器官、系統、組織及細胞產生病理變化,鉛損傷除了對神經行為[2]和免疫系統發生影響之外[3],生殖系統也是鉛作用的靶器官之一,近幾年伴隨不孕不育人數的激增,與環境中重金屬影響如鉛暴露不無關系[4]。
目前研究發現,ERS與一些疾病的發生和發展密切相關,心血管疾病、腫瘤等疾病的發生,均與ERS誘導的凋亡有關[5-6]。因此,關于ERS與凋亡的關系研究備受關注,但與人類和動物生殖系統的研究還相對較少,本文就近幾年來的進展綜述如下。
1 內質網相關未折疊蛋白反應信號通路組成和調控機理
目前研究認為,未折疊蛋白反應(UPR)通過上調分子伴侶蛋白、激活細胞內質網相關降解通路和抑制蛋白翻譯來緩解ERS。若ERS過于劇烈,UPR將直接引發程序性死亡。UPR信號通路主要由一個分子伴侶蛋白葡萄糖調節蛋白GRP78/Bip和三個感受蛋白肌醇酶I(IRE1)、蛋白激酶樣內質網激酶(protein kinase R-like ER kinase,PERK)、轉錄激活因子6(ATF6)介導的信號通路組成(圖1)[7]。
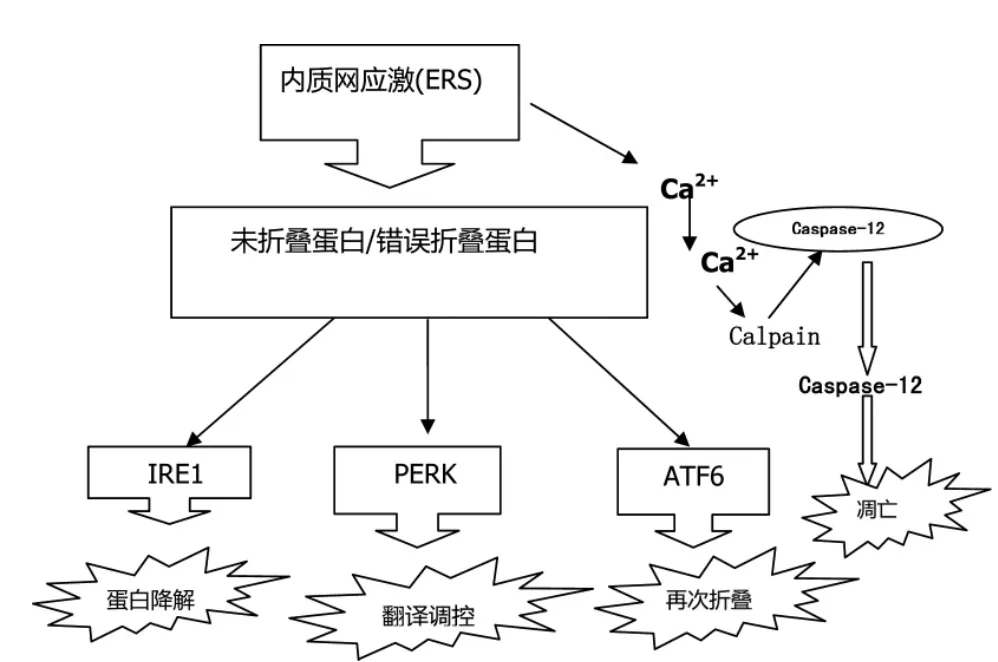
圖1 內質網UPR信號通路流程圖
其中IRE1普遍存在于酵母和哺乳動物細胞中,具有絲/蘇氨酸蛋白激酶活性,而PERK和ATF6則只存在于哺乳動物細胞。在哺乳動物細胞中,IRE1a信號通路在UPR引起細胞保護性機制與細胞凋亡之間的轉換中發揮重要的作用,其介導的X-盒結合蛋白1(XBP-1)剪接誘導的UPR能夠促進細胞的生存,但激活的IRE1a、胞漿的酶結構域招募接頭分子,與凋亡信號調節激酶1(ASK1)共同形成IRE1-TRAF2-ASK1復合物,從而激活氨基末端激酶(C-jun N-terminal kinase,JNK)[8-9]。近來研究表明,JNK可以阻止或促進細胞死亡,這取決于強度激活的時間。持續活化PERK通路可誘導C/EBP同源蛋白(CHOP)的積聚,促使細胞死亡。在一些細胞中,CHOP直接誘導Bcl蛋白家族凋亡成員BIM的轉錄。PERK-CHOP-BIM信號軸可以使連接內質網中蛋白質的錯誤折疊的凋亡機制激活。在UPR中,ATF6不同于IRE1和PERK的調控途徑,ATF6是ATF/CREB(cAMP response-element-binding)轉錄因子家族成員,是通過外殼蛋白復合物Ⅱ(COPⅡ)從內質網轉運到高爾基體內。ATF6與內質網腔內蛋白(BIP)結合停留在內質網內。在ERS狀態下,ATF6會減少,但具體進展還需進一步研究。ATF6信號通路調控涉及一個被稱為調節膜內蛋白水解(RIP)的機制(蛋白質到高爾基體內的水解過程)。在經歷轉運后,其活化的N端轉運到細胞核內并誘導內質網分子伴侶、X盒結合蛋白1(XBP1CHOP)等的轉錄表達[10]。
Caspase-12是半胱天冬酶家族中唯一僅在ERS通路中活化定位于內質網的分子,普遍認為Caspase-12是 ERS的特異性凋亡分子[11]。在沒發生ERS時,Caspase-12以無活性酶原狀態分布于內質網膜上。當發生ERS時,IRE1α激活腫瘤壞死因子受體相關因子TRAF2并將Caspase-12剪切活化,進而激活Caspase家族的其他信號蛋白,引起經典Caspase途徑介導的細胞凋亡[12]。由于人體細胞缺乏Caspase-12基因(基因突變),其介導細胞凋亡作用被為同源物的Caspase-4替代,并對ERS反應是特異性的[13-14]。通常情況下,GRP78與 Caspase-12以復合體存在于內質網膜上,一定程度上抑制了細胞凋亡,但當ERS發生時,GRP78的解離使Caspase-12活化進而引發細胞凋亡的激活,形成相應的特異性蛋白。Wu等[15]在食管癌細胞 EC109中首次證實,腺甘可通過CHOP和Caspase-4通路誘導癌細胞凋亡。
2 ERS與生殖相關通路研究
Xu等[16]在小鼠孕第8天腹腔注射200個RH速殖子,感染小鼠在孕14天后開始出現感染癥狀,但是多數在孕16 d仍然存活。通過熒光定量PCR和蛋白免疫印跡分析,發現了感染組中,ERS標記物,如 GRP78,CHOP 和 Caspase-12,JNK/ASK1 信號上調或激活,而以NAC預處理可抑制上述基因的表達或信號通路的激活。2011年烏蘭等[17]探討了胎盤組織中 ERS相關蛋白——鈣聯蛋白(calnexin,CNX)mRNA及蛋白表達與子癇前期發病的關系,發現輕重度子癇前期患者組CNX mRNA表達水平高于正常足月妊娠組[分別為(1.32±0.06)、(3.42±0.11)與(0.54±0.04)],并且 CNX蛋白表達水平也高于正常足月妊娠組[分別為(1.57±0.23)、(2.11±0.53)與(0.57±0.11)],提示了 ERS可能是子癇前期發病機制之一。有文獻[18]探討了ERS介導的細胞凋亡在子宮內膜異位癥(EM)發病中的作用,結果發現EM患者異位和在位子宮內膜細胞凋亡率均顯著低于正常子宮內膜,且異位子宮內膜細胞凋亡率顯著低于在位子宮內膜;EM患者異位和在位子宮內膜 GRP78和 GRP94,Caspase-3,12 mRNA及蛋白表達水平均顯著低于正常子宮內膜,異位子宮內膜 GRP78和GRP94,Caspase-12,3 mRNA及蛋白表達水平亦顯著低于在位子宮內膜,認為EM患者子宮內膜細胞凋亡減少,ERS介導的細胞凋亡途徑下調可能是EM發病的機制之一。
子癇前期中,miRNA-101可通過調控內質網蛋白ERp44的表達來調控胎盤滋養細胞的凋亡過程[19]。在HTR-8/SVneo(滋養細胞)中過表達miRNA-101后,ERp44的表達顯著下調,封閉 miRNA-101后,細胞凋亡數量增加。各種生理和病理學條件導致內質網腔中未折疊或錯誤折疊蛋白質的積累,會引發ERS。通過RNA深度測序,發現ERS脅迫下,HeLa細胞中hsa-miR-423-5p的表達上調,而hsa-miR-452-5p的表達下調,以Western blotting實驗證實CDKN1A是hsa-miR-423-5p的靶基因,推測microRNA通過調控它們的靶基因,在ERS的適應性反應中協同作用[20]。
3 鉛與生殖ERS的相關研究
3.1 睪丸間質細胞 睪酮激素的主要來源于睪丸間質細胞,睪酮水平取決于細胞本身的反應。有研究[21]顯示ERS特異誘導劑胡蘿卜素和衣霉素顯著誘導了小鼠睪丸間質細胞的凋亡,且呈濃度和時間依賴性。GRP78 mRNA的表達水平在培養24 h顯著上升,48 h呈下降趨勢。CHOP和Caspase-12 mRNA的表達水平隨凋亡率的增加顯著上升。ERS通過CHOP Caspase-12信號通路參與小鼠睪丸間質細胞的凋亡過程[22]。鉛鎘也可以在不同細胞類型中誘發ERS,可以上調小鼠睪丸細胞GRP78等ERS相關蛋白,并上調CHOP的表達并激活Caspase-12,從而導致系膜細胞凋亡。
3.2 胚胎細胞。細胞凋亡是鉛致胎盤損傷的重要機制之一。Smad4及S100B蛋白在孕期不同階段于鉛暴露下大鼠胎盤中的表達與孕末期血鉛水平密切相關,在鉛致胎盤細胞凋亡的發生發展中具有重要作用[23]。王云英等[24]認為血鉛水平與胎盤組織中NF-KB表達和細胞凋亡指數顯著相關(相關系數分別為0.663和0.641),鉛暴露引起NF-KB表達異常可能是胎盤細胞失衡和胚胎發育異常的重要機理之一。斑馬魚由于具有成熟周期短,繁殖率高、傳代周期短、產卵時間長、胚胎透明以及魚種發育遺傳背景清晰等優點,非常適用于鉛的生殖毒性等遠期效應的觀察,2014年殷健[25]研究重金屬鉛對斑馬魚成魚和胚胎的影響,發現鉛會引起斑馬魚胚胎心率減慢,體長減小,鉛對斑馬魚成魚和胚胎氧化應激、細胞凋亡的發生、毒性作用機制均與絲裂原活化蛋白激酶(MAPKs)信號轉導通路相關。
3.3 卵巢 鉛蓄積于卵巢可使皮質區變薄,成熟卵泡、生長卵泡減少,卵泡內上皮細胞核固縮、線粒體腫脹、崩解等。鉛可抑制卵母細胞第一極體的釋放,影響卵母細胞的存活率并可降低體外受精率和卵母細胞數量;亦破壞卵母細胞減數分裂進行,降低卵母細胞的受精能力,影響小鼠的正常生殖功能[26]。尹嬌嬌[27]研究表明,ERS參與了山羊顆粒細胞凋亡進程,表皮生長因子(EGF)通過下調 ATF4、ATF6、CHOP mRNA水平的表達,對ERS誘導的山羊顆粒細胞凋亡具有顯著的抑制作用。
3.4 衣霉素(TM)誘導卵巢和胚胎ERS實驗 衣霉素可通過影響蛋白質的糖基化,使內質網中未成熟蛋白堆積而誘發ERS。丁曉等[28]以TM誘導卵巢ERS,以卵巢玻璃化凍存流程中前培養1 h作為參考,對ERS伴侶蛋白GRP78表達水平進行檢測,顯示各濃度 TM誘導的卵巢GRP78表達均高于對照組,以TM達5 μg/mL時響影最為顯著,隨后隨著濃度增加表達逐漸穩定并略有下降;而對作用3 h后CHOP表達檢測顯示,隨著 TM濃度的增加,CHOP緩慢上升并與10、20和30 μg/mL組持續高濃度表達,說明在保護因子無法緩解ERS時,CHOP上升介導細胞走向凋亡。李昕昕等[29]利用TM處理胚胎激發ERS,應用顯微注射mRNA方法實現基因過表達,通過注射特異的反義寡核苷酸實現基因封閉,發現XBP1剪切隨IRE1a過表達及封閉而增加或減少,以TM處理導致胚胎發育畸形,XBP1剪切增加,而封閉XBP1可部分挽救發育畸形;封閉IRE1a亦可明顯挽救發育畸形,XBP1剪切恢復,但具體作用機制需進一步研究。
3.5 其他 有研究[30]表明,鉛暴露組ERS使凋亡Caspase-12 mRNA蛋白表達增加,凋亡指數(AI)在實驗組明顯上升。鉛暴露組中胎盤滋養層細胞發生纖維蛋白沉積,線粒體腫脹,數量減少,內質網腫脹,空泡形成,同時使胎盤細胞發生凋亡,增加Caspase-12 mRNA表達,促進了ERS。
4 鎘與生殖ERS的相關研究
4.1 睪丸間質細胞、胚胎細胞 Lian等[31]的文獻研究表明,胎盤發育損傷和胎兒生長發育遲緩與胎盤ERS有關。有研究[25]闡述重金屬鎘對斑馬魚成魚和胚胎的96 h半數致死濃度(96 h-LC50)分別為24.341 mg/L和46.67 mg/L,而胚胎孵育抑制作用的96 h半數致畸濃度(96 h-EC50)為42.499 mg/L。重金屬鎘引起斑馬魚胚胎心率減慢,體長減小;鎘對斑馬魚成魚和胚胎均具有明顯的毒性作用,能夠誘導氧化應激、細胞凋亡及免疫毒性的發生,其毒性作用機制與 MAPKs信號轉導通路相關[32]。Wang等[33]發現,孕期母體鎘暴露明顯升高窩胎鼠指(趾)部和尾部畸形率,顯著降低胎鼠身長、活胎重和胎盤重,胎盤迷路層的平均血竇區域明顯減少。以鎘處理的小鼠胎盤迷路層增殖細胞核抗原(PCNA)陽性增殖細胞數較對照組明顯減少,TUNEL(TdT介導dUTP缺口末端標記)陽性細胞數亦較對照組顯著増多,孕期母體以鎘處理 8 h后,小鼠胎盤組織GRP78和ATF4 mRNA水平明顯升高,且胎盤組織GRP78、peIF2α和CHOP蛋白表達顯著上調,提示孕期鎘暴露會顯著誘導小鼠胎盤ERS。
4.2 卵巢 有文獻[34]探討了鎘對卵巢細胞凋亡的誘導作用,病理檢測可見隨鎘劑量的增加,卵泡閉鎖率逐漸升高,與對照組相比差異明顯;96 h對照組凋亡率上升為10.20%,而高、中、低各組分別為21.41% 、15.88%、12.47%,表明各組均有不同程度凋亡。鎘對小鼠卵巢顆粒細胞的凋亡具有促進作用并有劑量的效應關系,鎘對卵巢卵泡的發育有促進閉鎖的作用,增加了閉鎖卵泡構成比;同時鎘能使小鼠卵巢顆粒細胞中的丙二醛(MDA)增加和超氧化物歧化酶(SOD)活性的降低,鎘增強卵巢顆粒細胞p53蛋白的表達,p53基因參與了小鼠卵巢顆粒細胞凋亡的調控。
5 討論和展望
本文對ERS與生殖疾病及鉛鎘重金屬與生殖ERS的相關進行描述。一方面,鉛鎘誘導ERS有其共同特點,在劑量與效應關系或者時間與效應關系都呈先上升后下降的方向;另一方面,ERS引起的程序性死亡機制是通過CHOP和Caspase-12等介導的。目前對于ERS受鉛鎘影響機制研究以體外動物研究為主,選擇鉛鎘的靶器官或靶細胞進行相關的體內研究很少,值得進一步深入探討。
[1] Glembotski CC.Endoplasmic reticulm stress in the heart[J].Circ Res,2007,101(10):975-984.
[2] 匡曉寧,雷 潔,古桂雄.鉛對新生大鼠生長發育的影響[J].東南國防醫藥,2007,9(4):283-285.
[3] 劉康生,黃 蓉,薛滿紅,等.學齡前兒童血鉛水平與免疫指標的相關性[J].東南國防醫藥,2013,15(6):626-627.
[4] Meeker JD,Rossano MG,Protas B,et al.Cadmium,lead,and other metals in relation to semen quality:human evidence for molybdenum as a male reproductive toxicant[J].Environ Health Perspect,2008,116(11):1473-1479.
[5] Kassan M,Galan M,Partyka M,et al.Endoplasmic reticulum stress isinvolved in cardiac damage and vascular endothelial dysfunction in hypertensive mice[J].Arteroscler Thromb Vasc Biol,2012,32(7):1652-1661.
[6] Liu D,Zhang M,Yin H.Signaling path ways involved in endoplasmic reticulum stress induced neuronal apoptosis[J].Int J Neurosci,2013,123(3):155-162.
[7] Ron D,Walter P.Signal integration in the endoplasmic reticulum unfolded protein response[J].Nat Rev Mol Cell Biol,2007,8(7):519-529.
[8] Malhotra JD,Kaufman RJ.The endoplasmic reticulum and the unfolded protein response[J].Semin Cell Dev Bio,2007,18(6):716-731.
[9] Luo D,He Y,Zhang H,et al.AIP1 is critical in transducing IRE1-mediated endoplasmic reticulum stress response[J].J Biol Chem,2008,283(18):11905-11912.
[10] Ye J,Rawson RB,Komuro R,et al.ER stress induces cleavage of membrane-bound ATF6 by the same proteases that process SREBPs[J].Mol Cell,2000,6(6):1355-1364.
[11] Chen YH,Wu XD,Yao ST,et al.Calcineurin is involved in car-dioprotection induced by ischemic postconditioning through attenuatingendoplasmic reticulum stress[J].Chin Med J(Engl),2011,124(20):3334-3340.
[12] Kim EM,Shin EJ,Choi JH,et al.Matrix metalloproteinase-3 is increased and participates in neuronal apoptotic signalingdownstream of caspase-12 during endoplasmic reticulum stress[J].J Biol Chem,2010,285(22):16444-16452.
[13] Liu D,Zhang M,Yin H.Signaling path ways involved in endoplasmic reticulum stress induced neuronal apoptosis[J].Int J Neurosci,2013,123(3):155-162.
[14] Rao RV,Peel A,Logvinova A,et al.Coupling endoplasmic reticulum stress to the cell death program:roleof the ER chaperone GRP78[J].FEBS Lett,2002,5(14):122-128.
[15] Wu L,Wei B,Guo Y,et al.Apoptosis induced by adenosine involves endoplasmic reticulum stress in EC109 cells[J].Int J Mol Med,2012,10(38):921-928.
[16] Xu X,Liu T,Zhang A.Reactive oxygen species-triggered trophoblast apoptosis is initiated by ER stress via activation of caspase-12,CHOP and the JNK pathway in toxoplasma gondii infection in mice[J].Infect Immun,2012,80(6):2121-2132.
[17]烏 蘭,石中華,王小青.胎盤內質網應激相關蛋白Calnexin與子癇前期發病的關系[J].江蘇醫藥,2011,37(16):1895-1896.
[18]歐陽煜宏,李晨陽,姚 瑾,等.內質網應激介導的細胞凋亡在子宮內膜異位癥發病中的作用研究[J].中國實用婦科與產科雜志,2012,28(3):218-221.
[19]常玉華,李 坤.子癇前期患者胎盤中miRNA-101和內質網蛋白ERp44的表達和意義[J].中國生化藥物雜志,2014,34(6):38-43.
[20] Dai LM,Huang C,Chen L.Altered expression of microRNAs in the response to ER stress[J].Sci Bull,2015,60(2):202-209.
[21]張 卓.內質網應激誘導小鼠睪丸間質細胞凋亡的作用研究[D].楊陵:西北農林科技大學,2014.
[22] Ji YL,Wang H,Meng C,et al.Melatonin alleviates cadmium-induced cellular stress and germ cell apoptosis in testes[J].J Pineal Res,2011,52(1):71-79.
[23]曲寶明.細胞凋亡、Smad4及S100B蛋白在孕期鉛暴露大鼠胎盤中的表達及意義[J].中國預防醫學雜志,2012,13(5):347-349.
[24]王云英,胡海燕,徐風森.孕期鉛水平對胎盤組織NF-KB表達和細胞凋亡的影響[J].中國優生與遺傳雜志,2013,21(2):32-33.
[25]殷 健.重金屬對斑馬魚的毒性效應及作用機制研究[D].北京:北京協和醫科大學,2014.
[26]曹 卉.鉛對小鼠卵泡顆粒細胞凋亡的影響[J].上海畜牧獸醫通訊,2010(6):23-24.
[27]尹嬌嬌.EGF通過內質網應激通路調控山羊卵泡顆粒細胞凋亡的作用研究[D].西安:西北農林科技大學,2014.
[28]丁 曉,顏 貝,陳 杰,等.小鼠卵巢內質網應激模型的建立及誘導凋亡的研究[J].寧夏醫科大學學報,2013,35(7):743-746.
[29]李昕昕,馮嬌嬌.影響非洲爪蟾胚胎發育[J].南京醫科大學學報:自然科學版,2011,31(10):1399-1402.
[30] Wang YY,Hu HY,Li H,et al.Effect of Lead exposure on placental cellular apoptosis and endoplasmic reticulum stress in rats[J].Chin Med J(Engl),2014,127(9):1744-1747.
[31] Lian IA,Loset M,Mundal SB,et al.Increased endoplasmic reticulum stress in decidual tissue from pregnancies complicated by fetal growth restriction with and without pre-eclampsia[J].Placenta,2011,32(11):823-829.
[32] Wang L,Gallagher EP.Role of Nrf2 antioxidant defense in mitigating cadmium-induced oxidative stress in the olfactory system of zebrafish[J].Toxicol Appl pharmacol,2013,266(2):177-186.
[33] Wang Z,Wang H,Xu ZM.Cadmium-induced teratogenicity:association with ROS-mediated endoplasmic reticulum stress in placenta[J].Toxicol Appl Pharmacol,2012,259(2):236-247.
[34]周新華.鎘對小鼠卵巢顆粒細胞凋亡作用及相關影響因素的研究[D].長沙:湖南農業大學,2006.

