川芎嗪對甘油注射小鼠骨髓細胞轉化修復腎小管損傷的影響
房振宇,劉永梅,王全勝
(安徽醫科大學附屬巢湖醫院腎內科,安徽巢湖 238000)
急性腎小管壞死(acute tubuLar necrosis,ATN)是一種臨床常見的疾病,是急性腎功能衰竭的重要原因,ATN發生的主要原因是腎臟局部的缺血損傷。骨髓干細胞是體內重要的一類組織干細胞,研究表明骨髓干細胞能分化成腎小球細胞[1-2]。重癥不可逆ATN不能恢復的主要原因是由于損傷區域殘存小管細胞的自身修復能力差,如果從骨髓來源的細胞轉化增多,成為修復的主力,勢必改善重癥ATN的預后。然而,骨髓干細胞轉化為腎小管細胞的數量有限,轉化效率也不甚理想。
研究發現一些中藥對骨髓干細胞可能有重要的影響[3-4],川芎嗪促進骨髓干細胞的增生,使得進入血循環中的骨髓干細胞增多,理論上發生轉化的骨髓干細胞也增多,而這正有利于ATN腎小管上皮細胞的恢復。基于以上的研究基礎,我們推測川芎作為干細胞分化,增殖的調控手段,對于骨髓干細胞在受體腎臟的分化將會起到積極的作用,可加速病變腎小管的修復。
1 材料與方法
1.1 材料和制劑
1.1.1 實驗動物 4~6周齡(體重18~22 g)綠色熒光蛋白標記的轉基因雄性C57BL/6小鼠35只為骨髓供體(美國匹茲堡大學腫瘤研究中心程濤教授惠贈),6~8周齡(體重18~22 g)清潔級C57BL/6小鼠60只(購自第二軍醫大學實驗動物中心)。
1.1.2 試劑 兔抗GFP多抗(Abcam公司)生物素標記的羊抗兔二抗試劑盒(Labvision公司)20%川芎嗪(上海第二軍醫大學長海醫院自制)GM-CSF(特爾立)廈門特寶生物工程有限公司(批號:20031027)。
1.1.3 分組 60只清潔級雌性C57BL/6小鼠,施行骨髓移植及缺血再灌注手術后隨機分成3組。(1)骨髓移植+甘油注射組:給予60Co照射后進行骨髓移植,于移植后8周進行甘油注射,于注射后持續1周使用0.9%生理鹽水注射,20只。(2)骨髓移植+甘油注射+20%川芎嗪組:給予60Co照射后進行骨髓移植,于移植后8周進行甘油注射,于注射后持續1周使用20%川芎嗪干預,20只。(3)骨髓移植+甘油注射+GM-CSF組:給予60Co照射后進行骨髓移植,于移植后8周進行甘油注射,于注射后持續1周使用GM-CSF干預,20只。
1.2 實驗方法及步驟
1.2.1 骨髓有核細胞的提取 用酒精(75%)將GFP標記使用脫臼方法處死的C57BL/6小鼠浸泡約5~10 min。隨后在無菌條件下分離出小鼠的脛骨和股骨,分別剪去兩端的骨皮質。將小鼠的脛骨和股骨用7號針頭以LG-DMEM(低糖型 DMEM(GIBCOBRL公司產品)約1 mL沖出骨髓后,將沖出的骨髓液依次經過7號和4號針頭吹打,再經過鋼篩過濾成單細胞懸液。此單細胞懸液使用紅細胞裂解液在4°C下裂解10 min,再使用PBS(0.01 mmol·L-1pH7.4磷酸鹽緩沖液)洗滌成骨髓有核細胞。得到的骨髓有核細胞再次使用含10%FBS(胎牛血清)的LG-DMEM重懸成單細胞懸液。最后檢查骨髓有核細胞活力(要求細胞活力在95%以上)。
1.2.2 骨髓移植 在移植前5 d用含紅霉素(250 mg·L-1)的抗生素溶液給受體鼠服用進行腸道準備。移植時使用特制的表面多孔的塑料盒,將小鼠置入其中,讓其全身均勻接受60Co照射(總劑量7.5 Gy),照射后6 h內,將供體小鼠骨髓有核細胞以1 mL注射器25號針頭經尾靜脈按每只每0.2mL含有2×106個細胞注射。此后將受體小鼠移入超凈臺(附帶空氣過濾帽的塑料透明鼠盒),使用60Co照射消毒后的食物,高壓消毒的飲水(測定pH 3~5)喂養,并飲用含紅霉素的抗生素溶液2周。
1.2.3 肌肉注射甘油誘導ATN模型 在接受注射前18 h到注射后8 h內不給予實驗小鼠飲水,增加甘油毒性。將甘油(純度>98%)用雙蒸水稀釋至50%,按預實驗摸索的最佳劑量7.5 mL·kg-1,于小鼠雙側后肢肌肉各予以1/2劑量注射。
川芎嗪及GM-CSF的具體使用方法如下:(1)1組0.9%生理鹽水0.2 mL每天;(2)2組20%川芎嗪2 mg·kg-1每天;(3)3組 GM-CSF 10μg·kg-1每天。
1.3 標本處理及觀察
1.3.1 血常規,肌酐,尿素氮檢測 以2% 戊巴比妥鈉腹腔注射麻醉小鼠,心臟穿刺取血,將20μL小鼠血液置于EDTA抗凝的Ependoff管中,血細胞分析儀檢測血液常規。1 mL血液,靜置30 min,3 000 r·min-1離心30 min后收集血清,Beck自動生化儀檢測血清尿素氮,血清肌酐。
1.3.2 病理切片 脫臼處死小鼠,取腎臟組織,在10% 中性福爾馬林浸泡固定,常規脫水、浸蠟并包埋。常規制備石蠟腎組織切片。HE染色。光鏡下觀察病變,同時采用Vyacheslav等的半定量方法評估腎小管損傷程度。腎小管損傷定義為:腎小管壞死或刷狀緣脫落、管型形成、管腔擴張,每張切片至少計數10個視野(200倍)。按受損小管比例評分:0.無病變;1.≤10%;2.11% ~25%;3.26% ~45%;4.46% ~75%;5.>76%。
1.3.3 冰凍切片 以2%戊巴比妥鈉腹腔注射麻醉,開胸,心臟穿刺取血,先用100 mL 0.01 mmol·L-1磷酸鹽緩沖液(PB,pH7.3)經心臟沖洗血液,再用500 mL含4%多聚甲醛0.1 mmol·L-1磷酸鹽緩沖液(PB,pH7.3)灌注固定。灌畢立即取雙側腎臟標本并置于上述相同的固定液中后固定4 h(4°C),然后移入含25%蔗糖的0.1 mmol·L-1的PB中,4℃過夜。冷凍連續切片,片厚5μm。切片分2套,分別進行免疫組織化學染色,熒光顯微鏡觀察。
1.3.4 免疫組織化學方法檢測GFP表達 石蠟腎組織切片(4μm)58℃烘干,18 h,常規脫蠟至水,使用3%H2O2抑制內源性過氧化物酶,將切片置于預加熱到 98℃,pH6.0,0.01 mol·L-1檸檬酸緩沖液中,微波Ⅲ檔(98℃),20 min,自然冷卻到室溫進行抗原修復,PBS洗3 min×3,加GFP一抗(鼠)1∶500 4℃過夜,PBS洗 3×3 min。b-SAR IgG 1∶200,37℃,30 min。PBS 洗 3 min ×3,S-HRP 1∶400,37℃,30 min,PBS 洗3 min ×3。0.4%DAB+0.03%H2O2顯色 12 min,水洗,蘇木精襯染,常規樹酯封片。
2 結果
2.1 一般情況 實驗過程中死亡12只,2只因麻醉死亡,4只因取血死亡,6只因注射甘油及骨髓移植死亡。
剩余動物1組15只,2組15只,3組18只。
2.2 血肌酐尿素氮 使用生理鹽水、川芎嗪、GMCSF在注射后7 d血肌酐、尿素氮有一過性升高,28 d血肌酐尿素氮無明顯變化。見表1。

表1 尿素氮、肌酐在3組中的變化
2.3 血常規 1、2組在手術后7、28 d內白細胞、紅細胞均未見明顯變化。3、4組在術后7 d白細胞、紅細胞增加,28 d恢復1、2組水平。見表2。
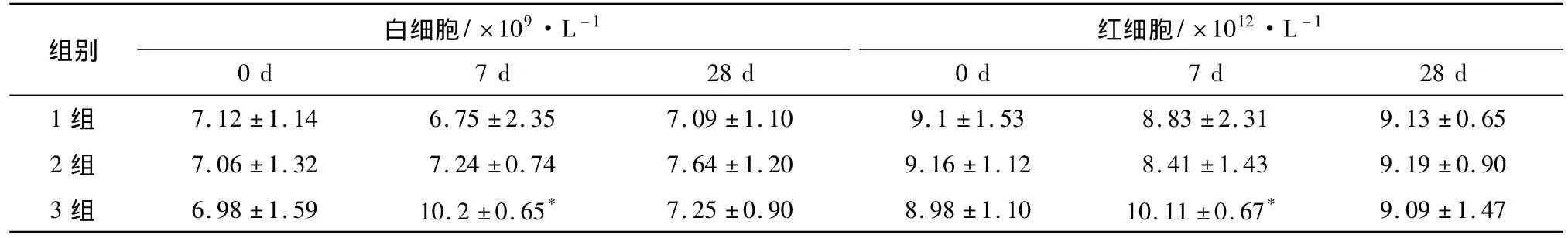
表2 白細胞、紅細胞在3組中的變化
2.4 流式細胞儀法 骨髓移植后5 d甘油注射后14 d,流式細胞儀法測骨髓中 GFP(+)細胞數目,見表3。2、3組其 GFP(+)骨髓細胞數占的比率較1組有升高。

表3 GFP陽性細胞在骨髓細胞中的比率/%
2.5 病理切片 骨髓移植行后甘油注射后予以生理鹽水(A),川芎嗪(B),GM-CSF(C),第 14、28 天的腎臟缺血側(L)的HE染色(圖1)HSK評分:第14天時腎臟A組與B組損傷差異明顯,C組顯示壞死較A組好轉,但炎細胞和間質細胞增多。B組的變化較其余各組更明顯,基本無損傷表現,其它各組損傷也恢復(表4)。

表4 各組的HSK積分
2.6 熒光顯微鏡 骨髓移植后進行甘油注射,之后予以生理鹽水(A),川芎嗪(B),GM-CSF(C)。干涉第14天,GFP熒光在各組的顯示,透視象表現及疊加象表現(圖2)。
2.7 免疫組化 骨髓移植后行甘油注射,之后予以生理鹽水(A),川芎嗪(B),GM-CSF(C)第14天,28天GFP陽性細胞的分布(圖3),計數GFP陽性細胞占腎小管上皮細胞的比率(表5)。
3 討論
近年來隨著對骨髓間充質干細胞的研究的逐漸深入,其參與體內許多器官的修復的特性正在被越來越關注[5]。但這種研究與臨床的需求還有很大的差距,其參與修復的數量及效果也遠遠達不到臨床所需求的標準,因此對于是否能通過促進骨髓增殖的手段達到提高骨髓干細胞參與受損器官修復的數量,正日益受到廣泛的關注[6],兩項國內的研究也曾使用肝細胞生長因子(hepatocyte growth factor)及粒細胞集落刺激因子(G-CSF)動員骨髓干細胞促進修復大鼠的急性腎損傷[7-8]。
我們的研究結果表明,甘油注射引起的急性腎小管壞死后,腎功能的變化是一過性的,川芎嗪或GM-CSF的使用,也并無明顯對腎功能變化的影響。單純使用川芎嗪的促骨髓細胞增殖并轉化為外周血細胞的效果并不是很明顯,GM-CSF對于外周血象的影響是一個短暫的骨髓動員的過程。流式細胞儀的結果可以看出川芎嗪及GM-CSF對于供體骨髓細胞的增殖是由促進作用的,即使用后供體骨髓細胞所占總骨髓細胞的比率較對照組上升。病理切片以及組織學評分:首先,川芎嗪對于腎小管損傷腎臟的修復有一定的促進作用,可以看到壞死范圍縮小,細胞數目增多,修復的程度,速度均較對照組有升高。而使用GM-CSF的組能看到壞死范圍縮小,細胞數目的增多。但同時炎細胞及間質細胞的數目也較對照組有增多,因此我們覺得川芎嗪對于急性腎小管壞死的修復有促進作用,其促進作用的發揮可能也與川芎本身改善腎臟微循環,修復腎損傷的作用有關,而GM-CSF對于急性腎小管壞死的修復造成的影響,目前看來是有利有弊的,具體發生機制還需要進一步分析。熒光顯微鏡為我們提供了一些川芎嗪和GM-CSF在骨髓干細胞轉化為腎小管上皮細胞中所起到的作用的一些初步的證據,根據大體的觀察,我們能夠看到,川芎嗪組和GMCSF組綠色熒光較對照組增多。而使用免疫熒光做進一步計算機圖形計數,通過免疫熒光的照片,能發現川芎嗪和GM-CSF組較對照組的外源性腎小管上皮細胞均有一定的升高。
近年來有研究通過改變骨髓移植的時間點來觀察骨髓干細胞對腎小管損傷修復的影響,認為早期移植效果較好,急性腎損傷發生4~8周時效果最佳[8-9],我們的實驗則通過一些促骨髓增殖的因素,增加循環中骨髓干細胞的數目,最終也觀察骨髓干細胞向腎小管分化的量的增多。首先證實了骨髓干細胞可以轉化為腎小管上皮細胞,進一步支持了以前各類相關研究得出的結論,其次反映了中藥川芎嗪通過對骨髓的增殖作用,促進了骨髓干細胞對腎小管上皮細胞的轉化。但有研究曾得出結論認為大部分分化到修復受損的小管細胞來自于內源性的細胞群,而不是骨髓衍生的細胞。還有研究認為骨髓間充質干細胞主要通過旁分泌的機制修復了腎小管損傷[10]。體外研究也顯示骨髓干細胞可以修復腎小管損傷但不能預防急性腎損傷的發生[11],因此是否我們這里得出的外源性腎小管細胞還存在其他的來源和形式,修復這些受損的腎小管時,川芎嗪和GM-CSF這些促骨髓增殖因素是否有通過其他細胞因子或者旁分泌模式達到總體修復腎小管急性損傷,增加外源性有功能的腎小管上皮細胞可能是我們需要繼續探討的目標。同時此類研究也探討了對使用骨髓干細胞減少慢性腎損傷腎間質纖維化的可能[12],當然川芎嗪及 GMCSF是否也能促進這些作用也需要繼續研究。
總之,通過我們的研究,我們可以證實川芎嗪和CM-CSF均可一定程度的增加骨髓干細胞對于腎小管急性損傷的修復作用。至于其修復機制是否存在其他因素影響以及其他作用大小仍需繼續研究。
[1]Gatti S,Bruno S,Deregibus MC,et al.Microvesicles derived from human aduLt mesenchymalstemcells protect against ischaemiareperfusion-induced acute and chronic kidneyinjury[J].Nep Hrology,Dialysis,2011,26(5):1474-1483.
[2]陳 亮,丁明霞,左毅剛.體外誘導豬骨髓間充質干細胞向尿路上皮細胞分化的實驗研究[J].昆明醫學院學報,2011,32(11):36-39.
[3]方健康,周軼平,李瑪琳.中藥對骨髓間充質干細胞增殖、凋亡及分化的影響研究進展[J].中國中藥雜志,2014,39(15):2834-2837.
[4]武密山,趙素芝,任立中,等.川續斷皂苷Ⅵ誘導大鼠骨髓間充質干細胞向成骨細胞方向分化的研究[J].中國藥理學通報,2012,28(2):222-226.
[5]Monsel A,Zhu YG,Gennai S,et al.Cell-based Therapy for Acute Organ Injury:Preclinical Evidence and Ongoing Clinical Trials U-sing Mesenchymal Stem Cells[J].Anesthesiology,2014,121(5):1099-1121.
[6]Chen Y,Qian H,Zhu W,et al.Hepatocyte growth factor modification promotes the amelioration effects of human umbilical cord mesenchymalstemcells on rat acute kidneyinjury[J].Stemcells and Development,2011,20(1):103-113.
[7]畢凌云,楊達勝,梁 斌,等.動員自體骨髓干細胞對大鼠急性腎小管壞死的治療[J].中國中西醫結合腎病雜志,2012,13(8):678-682.
[8]Liu NM,Tian J,Wang WW,et al.Effects of erythropoietin on mesenchymalstemcells'function of differentiation and secretion cuL-tured under acute kidneyinjury microenvironment[J].Zhonghua Yi Xue Za Zhi,2012,92(6):417-421.
[9]Bian X,Zhang B,Guo W,et al.Effects of mesenchymalstemcells transplanted at different time points in a rat remnant kidney model[J].American Journal of Nephrology,2014,39(1):75-84.
[10]Lindoso RS,Araujo DS,Ad?o-Novaes J,et al.Paracrine interaction between bone marrow-derived stemcells and renal epithelial cells[J].Cellu Larp Hysiology and Biochemistry,2011,28(2):267-278.
[11]Reis LA,Borges FT,Sim?es MJ,et al.Bone marrow-derived mesenchymalstemcells repaired but did not prevent gentamicin-induced acute kidneyinjury through paracrine effects in rats[J].Plos One,2012,7(9):e44092.
[12]Alfarano C,Roubeix C,Chaaya R,et al.Intraparenchymal injection of bone marrow mesenchymalstemcells reduces kidney fibrosis after ischemia-reperfusion in cyclosporine-immunosuppressed rats[J].Cell Transplantation,2012,21(9):2009-2019.

