左西孟旦對犬體外循環術后肺保護的實驗研究
王紀源,葛圣林,馮俊波
(安徽醫科大學第一附屬醫院心臟外科,安徽合肥 230022)
體外循環(cardiopulmonary bypass,CPB)技術的誕生和發展使得許多心臟手術得以開展,但體外循環術中肺組織由于全身炎癥反應及缺血再灌注而受到損傷,導致肺功能下降,甚至導致急性呼吸窘迫癥,嚴重影響了患者的臨床轉歸,且死亡率較高[1]。最新研究發現左西孟旦(LS)作為新一代鈣增敏劑具有臟器保護作用,本實驗通過建立實驗用雜種犬體外循環模型,對左西孟旦對體外循環術后的肺保護作用進行初步研究探討。
1 材料與方法
1.1 材料 實驗動物:健康雜種犬32只,雌雄不拘,體質量(12±1.94)kg,由安徽醫科大學動物實驗中心提供。
主要試劑及儀器:LS(山東齊魯制藥公司,批號:411006f3);丙二醛(MDA)、超氧化物歧化酶(SOD)檢測試劑盒(南京建成生物工程研究所);小動物呼吸機(成都泰盟科技有限公司);-80℃低溫冰箱(日本三洋公司);光學顯微鏡(CX 40型,日產Olympus);Sarns5000型人工心肺機(美國);電子顯微鏡(日產日立公司);BS 110S型電子天平(德國Sartorius公司);JHF1-DHG-9076A型恒溫電熱鼓風干燥箱(北京中西泰安技術服務有限公司);WI313182型血氣分析儀(東西儀北京科技有限公司);CPB配套管,CPB插管,氣管插管等。
1.2 方法
1.2.1 動物模型復制 實驗犬術前禁食8~12 h,靜脈注射戊巴比妥鈉(30 mg·kg-1),待麻醉完全起效后,對犬進行氣管內插管,連接小動物呼吸機,設置呼吸機潮氣量、氧濃度、呼吸頻率分別為12 mL·kg-1、45%、每分鐘25次。輔助呼吸后,股動脈穿刺并置測壓管連接監護儀,觀察犬的生命體征狀況;胸骨正中切口,充分止血后切開心包,暴露心臟,在主動脈根部及右心耳處分別插管,建立CPB。開始CPB后,逐步進行降溫至30℃時阻斷鉗阻斷升主動脈,主動脈根部插入灌注針,通過灌注針灌注心臟停搏液使心臟完全停搏后置冰泥保護心肌,同時停止機械通氣,每半小時灌注一次,主動脈阻斷持續1 h,再行升主動脈開放2 h,主動脈開放后立即恢復機械通氣,CPB輔助,待血流動力學完全恢復穩定后再逐漸停止CPB。
1.2.2 實驗分組 實驗用動物雜種犬32只隨機分為四組:(1)C組:開胸后常規建立體外循環,體外循環過程中不做特殊處理;(2)P組:于主動脈阻斷后經肺動脈灌注低溫氧和血(氧和血引自氧和器,經冰水槽浴,保持氧和血溫度在0~4℃左右),肺動脈灌注流量40~50 mL·kg-1·min-1),灌注壓30 mmHg左右,灌注液量30~45 mL·kg-1,灌注時間控制在8~10 min;(3)LSIV組:于犬麻醉后靜脈注射LS(65 g·kg-1),至主動脈阻斷前注射完畢;(4)LSP組:主動脈阻斷后經肺動脈灌注含LS(65 g·kg-1)的低溫氧和冷血,具體灌注方法同P組。
1.2.3 標本的采集和處理 待實驗完成后,高鉀注射處死實驗犬,取出右肺組織,用4℃鹽水沖洗肺組織并用濾紙吸干表面水分。取中段肺組織約0.3 g放入10%福爾馬林溶液固定24 h后,取出肺組織,石蠟包埋、切片、蘇木精—伊紅(HE)染色,在光鏡下的觀察肺組織的形態并拍攝照片;取下段0.8 mm ×0.8 mm ×0.8 mm 大小的肺組織置于 2.5%戊二醛溶液中固定,完成后對肺組織進行切片通過電鏡觀察肺組組形態并拍攝照片。剩余肺組織于凍存管中放置后在放入-80℃冰箱凍存,留作標本測定。
1.2.4 肺組織MDA含量及SOD活性測定 取凍存的肺組織按試劑盒要求制備組織勻漿液,應用硫代巴比妥酸(TBA)反應法測定肺組織中MDA的含量及應用化學比色法測定肺組織中超氧化物歧化酶(SOD)的活性(測定過程嚴格按照試劑盒說明操作)。
1.3 統計學處理 應用SPSS19.0統計軟件進行統計學分析。計量資料以均數±標準差表示,經方差齊性檢驗后,各組計量資料的比較采用單因素方差分析,組間兩兩比較采用LSD檢驗,P<0.05認為組間顯著性差異有統計學意義。
2 結果
2.1 肺組織中MDA含量及SOD活性 與C組相比,LSP組、P組及LSIV組MDA含量均明顯降低,且SOD活性明顯升高(P<0.01),與LSP組相比,LSIV組及P組MDA含量明顯升高,且SOD活性明顯降低(P<0.01),P組和LSIV組比較無統計學意義(P >0.05),見表1。
表1 各組MDA含量及SOD活性(±s)(n=8)
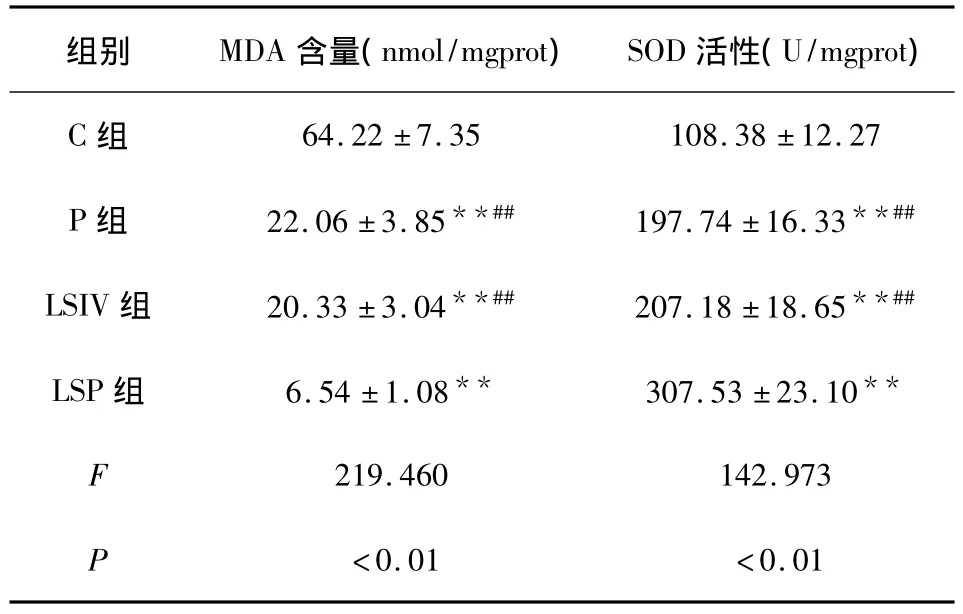
表1 各組MDA含量及SOD活性(±s)(n=8)
注:多重比較:與C組相比,**P<0.01,與LSP組相比,##P<0.01。
組別 MDA含量(nmol/mgprot) SOD活性(U/mgprot)C組64.22 ±7.35 108.38 ±12.27 P 組 22.06 ±3.85**## 197.74 ±16.33**##LSIV 組 20.33 ±3.04**## 207.18 ±18.65**##LSP 組 6.54 ±1.08** 307.53 ±23.10**F 219.460 142.973 P <0.01 <0.01
2.2 肺組織光學顯微鏡形態變化 光鏡下可見C組細胞間質水腫,炎細胞浸潤,有大量的紅細胞,炎性細胞、漿液性滲出液在肺泡腔內。肺泡結構基本被破壞,有一部分塌陷,還有部分完全消失,在消失的肺泡內,可發現代償性肺氣腫。P組和LSIV組肺組織也有肺泡間質水腫,但較C組均明顯減輕,肺泡內炎細胞浸潤及出血、滲出都有所減少,組織損傷程度明顯較輕,LSP組肺泡間隔水腫程度最輕,肺泡內僅有少許滲出物,炎癥細胞浸潤程度較其余幾組也明顯減輕(圖1)。
2.3 肺組織電子顯微鏡形態變化 電鏡下C組Ⅱ型上皮細胞線粒體腫脹明顯,體積增大,線粒體基質電子密度降低,脊紊亂消失,板層小體排空明顯,細胞膜上微絨毛減少,部分細胞核呈多形性。LSIV組和P組Ⅱ型上皮細胞線粒體輕度腫脹,嵴排列稍紊亂,板層小體空泡化稍減輕,胞膜上微絨毛稍減少,細胞核多呈橢圓形。LSP組Ⅱ型上皮細胞線粒體腫脹程度最輕,嵴排列紊亂程度也明顯減輕,較其余幾組,板層小體空泡化明顯減輕且包膜上微絨毛也明顯減少,大多細胞核為橢圓形(圖2)。
3 討論
隨著心臟外科技術的發展,體外循環心內直視技術在很多醫院得到了開展,大量理論研究和臨床實踐已經表明,急性肺損傷已經成為體外循環手術后最常見的并發癥之一,幾乎所有患者體外循環術后均有一定程度的肺損傷,輕者僅表現為一過性的臨床癥狀,重者表現為急性呼吸衰竭,危及生命。研究表明急性肺損傷主要與全身炎癥反應、缺血再灌注損傷及體外循環過程中肺處于高氧耗高代謝狀態有關。全身炎癥反應主要是麻醉、手術創傷、體外循環等因素對機體造成的打擊,尤其是體外循環開始時,血液等需與人工管道等非生理接觸導致補體系統的激活[2],補體激活產物刺激中性粒細胞在肺內聚集并進入肺間質和肺泡,從而導致肺水腫、肺順應性降低,血氧含量下降[3];其次是肺臟的缺血再灌注引起的損傷,體外循環過程中同時停止了機械通氣,肺處于缺血缺氧狀態,產生大量毒性氧代謝產物和氧自由基,導致膜脂質過氧化增強,產生多種醛類物質、如丙二醛等,改變了生物大分子的功能、破壞了核酸及染色體從而引起肺損傷。另外,肺的缺血再灌注導致肺血管內皮細胞損傷,減少了內皮源性舒血管物質一氧化氮(NO)的合成而引起肺損傷。Palatianos等[4]研究表明,小劑量的NO可以預防中性粒細胞在肺內積聚。
LS是一種新型的鈣增敏劑,于2000年在瑞典上市,因其既能夠提高心肌收縮力,又不增加心肌細胞內鈣濃度和細胞耗氧而被被臨床用于治療各種急性心力衰竭病。有研究指出,LS具有減少炎癥因子的產生、抗細胞凋亡、抗缺血再灌注等作用。Gecit等[5]對小鼠腎臟缺血再灌注損傷的研究中發現,經過LS腹腔注射的實驗組與對照組對比,腎組織中保護性酶SOD含量明顯升高,而MDA含量明顯減少。Honich等[6]應用阻斷/開放小鼠前降支的方法制作的小鼠心肌缺血再灌注的損傷模型中,再灌注前應用LS能明顯減少心肌梗死面積。研究表明,左西孟旦明顯減少心肌細胞的凋亡,而且其可以上調心肌細胞中抗凋亡基因bcL-2的表達,減少可溶性凋亡信號因子Fas/Fas配體的產生,從而抗發揮其抗心肌細胞凋亡的作用[7-8]。Dubin 等[9]研究表明,應用LS后,感染性休克腸道血流會增加,黏膜下酸中毒同樣可以被減輕,這可能是因為LS能夠改善腸道灌注。Scheiermann等[10]在感染性休克動物模型中應用了LS,研究發現炎癥的釋放被抑制,酸中毒被減輕,生存時間得到了延長;另外在大鼠的急性肺損傷模型中,與多巴酚丁胺(DOB)組及對照組相比,應用LS后,肺組織炎癥反應明顯可以被減輕,細胞凋亡也可以被抑制,LS的免疫調節以及抗凋亡的特性可能是其保護器官功能的又一重要機制[11],在犬的CPB模型中,會有氧自由基過量增多,與肺組織中的細胞膜產生脂質過氧化反應而導致細胞膜通透性增加導致Ca2+超載、線粒體腫脹,影響細胞膜內的能量代謝,導致細胞損傷;脂質過氧化反應還會導致溶酶體膜損傷引起溶酶體外漏再次加重細胞損傷。OFR還可通過與蛋白質中的殘基發生反應使蛋白質的一級結構被破壞,損傷蛋白質功能、降低或喪失蛋白酶的活性,從而改變肺的結構,引起肺組織損傷;這些都是OFR造成肺損傷的重要因素。氧自由基是肺組織的缺血再灌注所引起的肺損傷起著重要作用,貫穿整個損傷過程。其中膜結構脂質過氧化過程會形成一種毒性較大的過氧化產物MDA[12],而SOD是一種重要的氧自由基清除劑他們接過僅比較穩定,容易測定,是目前公認的能較好反映機體內氧自由基水平及脂質過氧化程度的間接指標[13]。本研究顯示,與C組相比,LSP組、P組及LSIV組MDA含量均明顯降低,且SOD活性明顯升高(P<0.01),與LSP組相比,LSIV組及P組MDA含量明顯升高,且SOD活性明顯降低(P<0.01),P組和LSIV組無統計學意義(P>0.05)。結果示單純肺動脈灌注、LS靜脈注射及肺動脈灌注均具有肺保護作用,但其具體機制待進一步研究。
綜上所述,雖然目前CPB術后肺損傷的機制尚未完全明確,但應是一個多因素的共同作用的結果,可能與CPB術后全身炎癥反應、肺組織的缺血—再灌注損傷有關。本實驗通過建立犬體外循環肺模型,并使用靜脈注射、肺動脈灌注使用LS等不同的實驗方法,得出結論LS肺動脈灌注可明顯減輕術后MDA含量及增加SOD活性,具有急性肺損傷的保護作用。
[1]鄧 奇,鄧云坤,安裕文.體外循環肺損傷的機制及其保護進展[J].醫學綜述,2009,15(7):1069-1073.
[2]崔國慶.右美托咪定對瓣膜置換術患者炎癥反應及呼吸功能的影響[D].張家口:河北北方學院,2013.
[3]Eichler W,Bechtel JF,Schumacher,et al.A rise of MMP-2 and MMP-9 in bronchoalvelar lavage fluid is associated with acute lung injury after cardiopulmonary bypass in a swine model[J].Perfusion,2003,18(2):107-113.
[4]Palatianos GM,Paziouros K,Vassili MI,et al.Effect of exogenous nitric oxide during cardiopulmonary bypass on lung postperfusion histology[J].Asaio J,2005,51(4):398-403.
[5]Gecit I,Kacak S,Demir H,et al.Effect of short-term treatment with levosimendan on oxidative sress in renal tissues of rats[J].Toxicol Ind Health,2012,21(7):771.
[6]H?nisch A,Theuring N,Weinbrenner C,et al.Postconditioning with levosimendan reduces the infarct size involving the PI3K pathway and KATP-channel activation but is independent of PDE-III inhibition[J].Basic Res Cardiol,2010,105(2):155-167.
[7]Ozturk T,Gok S,Nese N.Levosimendan attenuates reperfusion injury in an isolated perfused rat heart model[J].Cardiothorac Vasc Anesth,2010,24(4):624-628.
[8]Paraskevaidis IA,Parissis JT.Anti-inflammatory and anti-apoptotic effects of levosimendan in decompensated heart failure:a novel mechanism of drug-induced improvement incontractile performance of the failing heart[J].Curt Med Chem Cardiovasc Hemaol Agents,2005,3(3):243-247.
[9]Dubin A,Murias G,Sottile JP,et al.Effects of levosimendan and dobutamine in experimental acute endotoxemia:a preliminary controlled study[J].Intensive Care Med,2007,33(3):485-494.
[10]Scheiermann P,Ahluwalia D,Hoegl S,et al.Effects of intravenous and inhaled levosimendan in severe rodent sepsis[J].Intensive Care Med,2009,35(8):1412-1419.
[11]Erbuyun K,Vatansever S,Tok D,et al.Effects of levosimendan and dobutamine on experimental acute lung injury in rats[J].Acta Histochem,2009,111(5):404-414.
[12]Kivikko M,Lehtonen L ,Colucci WS,et al.Sustained hemodynamic effects of intravenous levosimendan[J].Circulatiorn,2003,107(1):81-86.
[13]Ozcan C,Bienengraeber M,Dzeja PP,et al.Potassium channel openers protect cardiac mitochondria by attenuating oxidant stress at reoxygenation[J].Am J Physiol Heart Circ Physiol,2002,282(2):H531-H539.

