皮膚屏障與皮膚病
張 媛 劉 永 顏 敏 孫 莉李 娟
·基層園地·
皮膚屏障與皮膚病
張 媛 劉 永 顏 敏 孫 莉?李 娟
皮膚屏障功能可分為物理屏障、化學/生物化學抗菌屏障及免疫屏障,其在某些皮膚病的發病中起重要的作用,本文主要就皮膚屏障結構功能及與某些皮膚病的關系進行總結介紹。
皮膚屏障; 皮膚病
皮膚位于人體體表最外層,具有屏障、吸收、分泌、排泄、代謝、免疫、體溫調節及感覺等功能。其中皮膚的屏障功能至關重要,一方面具有對外界機械性、物理性、化學性、微生物等刺激的防護作用,保護體內組織器官,另一方面可防止體內營養物質、水分等的丟失。1皮膚屏障功能又可分為物理屏障、化學/生物化學抗菌屏障及免疫屏障。其中物理屏障的基礎為角質細胞層;化學/生物化學抗菌屏障包括固有免疫屏障、脂質、局部酸堿狀態、溶解菌素、抗菌肽等;免疫屏障包括體液免疫及細胞免疫。2表皮通透屏障及角質層含水量是反映表皮屏障功能的重要指標,經皮水分喪失量(TEWL)越高,角質層含水量降低越顯著,表面皮膚屏障功能受損越嚴重。
1 皮膚屏障的主要結構和功能
1.1 皮脂膜 為覆蓋于皮膚表面的一層透明薄膜,又稱水脂膜。主要由皮脂腺分泌的皮脂、角質層細胞崩解產生的脂質與汗腺分泌的汗液乳化形成,呈弱酸性,其主要成分為神經酰胺、角鯊烯、亞油酸、亞麻酸及脂質成分。皮脂膜對角質形成細胞具有營養作用,也是高效的水分屏障,其弱酸性環境可抑制化膿菌及皮膚癬菌的定植,具有一定抗炎作用。3
1.2 抗菌肽及微生態 抗菌肽(AMPs)構成的化學屏障和微生態構成的生物屏障是維持人體健康狀態的重要保障。抗菌肽是具有抗菌活性的小分子陽離子多肽,具有高效的殺菌能力、廣譜的抗菌活性及抗氧化作用,還具有多種免疫調節活性,在宿主抵抗病原侵入中起著非常重要的作用。人類的抗菌肽主要包括抗菌素及防御素兩大家族。迄今為止,人類發現1800多種不同來源的抗菌肽,其中在皮膚中表達有20余種。4抗菌肽具有高度保守性。LL-37是迄今為止在人體內發現的唯一的抗菌素家族抗菌肽。由角質形成細胞表達、釋放和分泌其前體肽-人陽離子抗菌肽-18(human cationic antimicrobial peptide-18,hCAP-18),經蛋白酶酶解后具有生物活性。LL-37具有快速、廣譜和有效地抗菌活性。防御素可分為3類,分別為α、β、θ防御素,其中人類β防御素(human β-defensins,HBD)中的4種由上皮細胞產生,分別為HBD1~4。抗菌肽與許多皮膚病的關系越來越受重視。目前認為抗菌肽的表達可分為結構性表達和誘導性表達,并且其表達的功能受多種因素影響。在正常皮膚角質形成細胞中抗菌肽呈低表達,在感染或皮膚屏障破壞的情況下被大量誘導表達。研究發現,IL-1α和IL-6可誘導角質形成細胞表達LL-37,IL-1β可誘導角質形成細胞表達HBD-2。5
皮膚微生態系皮膚正常微生物群與宿主、環境之間的生態體系。研究表明,皮膚常駐菌具有占位保護作用,層次有序地定植在皮膚上,猶如一層生物屏障,使致病菌及外來菌無法立足于皮表。多達20%的常駐菌可產生抑制病原菌的化合物,如革蘭陽性共生菌,包括乳酸桿菌、鏈球菌、葡萄球菌,可產生殺菌素,表皮葡萄球菌可產生一種抗菌肽酚可溶性調控蛋白,對金黃色葡萄球菌、A組鏈球菌具有選擇性殺滅作用。6同時常駐菌可將皮脂甘油三酯分解為脂肪酸,形成乳化皮脂膜。正常皮膚微生態不僅存在皮膚表面,在真皮和脂肪組織中也能檢測到細菌,這些皮膚的正常共生菌與基底膜下方的宿主細胞之間進行相互接觸、信息交流。有研究表明,7在人生早期階段及時建立正常皮膚微生物群,對于阻止外來感染性微生物的入侵具有重要作用,有助于建立皮膚的穩態和調節炎
癥反應,并可顯著影響皮膚免疫功能的發育。盡管正常皮膚微生物群在不同個體或同一個體的不同部位存在差異,但在局部皮膚處于相對平衡狀態。正常微生物群失衡與多種皮膚病的發生有密切的關系。
1.3 角質層 角質層由5~15層細胞核和細胞器消失的扁平角質細胞和薄層脂質層組成,有學者形象地將角質層比喻為“磚墻結構”,角質形成細胞為磚塊,而灰漿則指角質細胞間隙中的基質。維持和保證角質形成細胞和基質兩個組分及其功能的正常,才能確保皮膚的完整性、正常的水合作用和老化角質形成細胞的脫落。
1.4 角質形成細胞 角質形成細胞在從基底層向上移行到角質層過程中,細胞器和細胞核消失,細胞膜間發生廣泛的交聯,形成不溶性的堅韌外膜--角質細胞角化套膜(CE)。CE由蛋白包膜和脂質包膜兩部分構成,其間還有一些酶。角質細胞的有序排列是表皮抵御外界機械刺激的重要因素。蛋白包膜中與保濕最相關的是中間絲聚合蛋白(FLG),由顆粒層釋放至細胞間隙,其逐漸降解形成的各種氨基酸及其它降解產物是天然保濕因子(natural moisturizing factor,NMF)的重要組成部分。NMF維持皮膚正常彈性和滲透性,調節角質層的水合功能,是參與減少皮膚經皮水分丟失的重要生物分子。皮膚干燥時其物理性狀會發生改變,這種變化被神經末梢感受器感受產生瘙癢癥狀。8在角質形成細胞中最重要的酶是轉谷氨酰胺酶1(transglutaminase1,TGase1),其活性與水有關。干燥缺水的皮膚使酶的活性減弱或失活,TGase1功能受影響,包膜蛋白前體交聯障礙、CE形成不堅固,影響皮膚抗外界機械性的能力,降解角質細胞橋粒的水解酶受影響,角質形成細胞在皮膚表面堆積形成干性皮膚。9酶的失活進一步影響γ-谷氨酰胺、神經酰胺和脂肪酸的脂化,使得原先柔軟的角質形成細胞脂質膜僵硬、易脆,角質形成細胞間的黏附力下降,皮膚變得粗糙、脫屑。8,10
1.5 脂質 脂質的異常可降低皮膚的儲水保濕功能,也直接影響角質形成細胞的生長與分化調節,影響健康角質層的形成。角質層厚度約為13 nm,由3層組成,呈“三明治”樣,第一層及第三層由晶狀體網格結構組成,中間為液相,由類脂構成,主要包括等量的神經酰胺、不飽和脂肪酸及膽固醇。“三明治”結構在角質層的保濕、保護方面起重要作用。11
1.6 棘層、顆粒層和透明層 表皮層中有核細胞構成的部分對屏障功能同樣重要,用膠帶粘去表皮的角質層后,經皮水分喪失量(TEWL)約為低到中度,只有整個表皮全部喪失,才會導致嚴重的屏障功能障礙。其中研究最多的是角化橋粒、板層小體在皮膚屏障中的作用。12在基因突變、皮膚pH值變化、塵螨分泌的外源性蛋白酶等作用下,角化橋粒降解,導致皮膚脫屑,皮膚屏障功能受損。13另外透明層和顆粒層中酸性磷酸酶、疏水性磷脂和溶酶體等構成一個水屏障,使水分既不易從體外滲入,也阻止了角質層下水分的外滲。
1.7 基底層 僅為一層柱狀或立方狀的基底細胞構成,與基底膜帶垂直排列成柵欄狀。基底層的角質形成細胞表達水通道蛋白(AQP3),它是一個完整的跨膜蛋白通道,分子量為28 kDa。體內循環中的水分和甘油可以通過AQP3到達表皮,促進角質層的水合作用,與皮膚保濕功能有關。14正是由于AQPS的存在,細胞才可以快速調節自身體積和內部滲透壓,轉運水、尿素和甘油等物質進入皮膚,成為維持皮膚水合作用的一個關鍵因素。
2 皮膚屏障與某些皮膚病
皮膚疾病的形成通常被視為炎癥的結果,但屏障功能受損在濕疹、特異性皮炎、痤瘡等多種疾病發病機制中起關鍵作用。
在皮膚屏障的完整性遭到破壞或受到感染、炎癥刺激時,就會誘導AMPS的表達,AMPS通過直接作用或激活免疫系統等反應防止感染的發生。另外,AMPS在發揮抗菌作用的同時也啟動或擴大炎癥反應而加重疾病。皮膚微生態在維持皮膚微生物平衡、自凈,構成微生物屏障及參與皮膚諸多生理功能等方面起重要作用。當生態失衡時,它們又成為條件致病菌,導致炎癥性病理過程的發展。皮膚抗菌肽與微生態之間是相互調節的動態平衡關系。
正常微生物群失衡與多種皮膚病的發生有密切關系。如研究發現痤瘡患者和健康人鼻部痤瘡桿菌的相對豐度差異無統計學意義,但其核糖體型菌株類型上存在差異,在痤瘡患者中4型核糖體(RT4)和5型核糖體(RT5)痤瘡丙酸桿菌菌株占優勢,而6型核糖體(RT6)痤瘡丙酸桿菌則主要見于正常人群中。這種現象在菌株水平證實了共生菌痤瘡丙酸桿菌的不同菌株在痤瘡發病中的作用,提示痤瘡的治療有必要強調針對微生態的調整,而非采用抗生素以殺滅所有痤瘡丙酸桿菌。15
表皮炎癥反應和免疫應答在皮膚疾病的發生機制中也有很大影響。如銀屑病皮損處角質形成細胞能分泌一系列趨化中性粒細胞和Th1的細胞因子,而IL-1α,IL-6和IFN-γ等可以調節白細胞和淋巴細胞中LL-37的轉錄與分泌,16所以銀屑病患者表皮淺層LL-37與HDB-2表達明顯升高,且LL-37的抗金黃色葡萄球菌活性與HBD-2有協同作用。這能一定程度上解釋銀屑病患者存在著表皮損傷而較少發生皮膚感染的原因。同時抗菌肽是一把雙刃劍,它們在防御感染的同時擴大了炎癥反應,導致疾病加重。在銀
屑病患者中,LL-37可進入樹突狀細胞,引發TLR9介導的IFN-α表達,激活自身反應細胞Th1和Th17,導致銀屑病進一步加重。17
表皮的中間絲相關蛋白經蛋白水解酶作用發生降解,釋放游離氨基酸吡咯烷羧酸和尿甘酸,前者可以維持角質層,后者在吸收UVB中發揮作用。表皮屏障功能的變化會直接影響對紫外線的吸收,導致皮膚病變。另有研究表明,紫外線可導致AQP3表達下調,從而損傷皮膚的屏障功能,誘發皮膚病變。18
濕疹是一種炎癥性皮膚疾病,臨床上表現為多形性皮疹,劇烈瘙癢,易復發,是由多種內外因素共同引起的一種遲發型超敏反應,而皮膚屏障功能的缺陷在濕疹發病中起重要的作用。1
首先,外源性刺激物可直接破壞皮脂膜,嚴重時損傷角質層細胞,導致角質層細胞間水腫,使得細胞間隙增大,皮膚“磚墻”結構不穩定,破壞了原有皮膚屏障,經皮失水增多;刺激物還可引起局部炎癥反應,炎性細胞浸潤,影響皮膚正常代謝,使得脂質、天然保濕因子及抗炎因子減少,皮膚變得干燥、脫屑,更易敏感。但這與刺激物的強度、接觸時間及接觸量有關。隨后這些刺激物滲透入表皮層,損壞角質細胞質膜,板層(Odland)小體形成受阻礙,皮膚屏障功能減退。這些改變均為各種微生物及抗原進入體內提供了入口途徑。一些化學性洗滌劑、金屬銀、汞等也可以去除角質細胞層的脂質,干擾脂質的結構。所以通常刺激性皮炎的發生要先于變應性接觸性皮炎。Elias等提出的濕疹發病機制新理論“由外而內,再由內而外”,即基于這種規律。19由于皮膚屏障受損,皮膚抵抗外界刺激能力下降,還容易繼發感染。研究發現,濕疹患者與其工作環境及所接觸物有明確的關系。另外,由于遺傳或年齡等因素,濕疹患者皮膚FLG蛋白表達減少,天然保濕因子含量降低,屏障功能減退。同時皮膚干燥會增加局部皮膚對炎癥的反應,因此洗浴刺激也是濕疹發病的風險因素之一。20頻繁洗浴可減少皮膚表面的脂質,而適當的外用皮膚保濕劑可顯著降低濕疹患者的瘙癢癥狀。
濕疹患者皮膚表面的抗菌肽及微生態也有顯著變化。在過敏原刺激引起的濕疹中,免疫反應主要為Th2型細胞因子模式,表現為高IgE水平和嗜酸粒細胞增多,IL-4、IL-10和IL-13的過度表達,高IL-4和IL-13對HBD-2和HBD-3有抑制作用,此外,IL-4和IL-13通過激活信號傳導蛋白和轉錄激活物-6直接作用于角質形成細胞,降低HBD和LL-37的表達。21,22而抗菌肽在促進皮膚損傷愈合、預防皮膚感染等起重要作用。不過,AMPS在濕疹發病中的機制仍有待進一步研究。
微生物可通過變態反應或非變態反應引起濕疹。如金黃色葡萄球菌產生的a毒素,可直接引發或加重濕疹。而其本身的蛋白、多糖、毒素或代謝產物可作為變應原致敏機體,也可通過毒素或酶造成表皮損傷或激活表皮細胞而引發炎癥反應。特異性皮炎患者發作時金黃色葡萄球菌比基線時或治療后明顯增多,并與疾病嚴重密切相關。治療后,鏈球菌屬、丙酸菌屬、棒狀菌屬均增加。23提示特應性皮炎的發病可能與皮膚正常微生物群結構改變和失衡有關。而濕疹的臨床表現與特異性皮炎極為相似。局部感染可以因為濕疹樣皮炎,這些均提示微生態在濕疹發病中的作用,但其作用機制還待進一步研究。
此外濕疹治療時多選用糖皮質激素類外用藥物治療,糖皮質激素不但可以破壞正常皮膚微生態,過量外用糖皮質激素可抑制表皮脂類的合成,抑制板層體的形成和分泌,導致復層板層結構形成障礙,延緩皮膚屏障功能的恢復,使皮膚經表皮水分流失增加。因此糖皮質激素對皮膚屏障功能的影響是負面的。
由此可見,濕疹患者的皮膚屏障與正常人皮膚屏障功能有很大差異,在治療時也可造成皮膚屏障的損傷,導致濕疹的加重或反復。所以在濕疹治療中,保護和重建皮膚屏障顯得格外重要。
1趙辨.中國臨床皮膚病學.南京:江蘇科學技術出版社,2009. 725-731.
2 Proksch E,Folster-Holst R,Jensen JM,et al.Skin barrier function,epidermal proliferation and differentiation in eczema.J Dermatol Sci,2006,43(3):159-169.
3何黎.重建皮膚屏障在濕疹治療中的重要性.皮膚病與性病,2009,31(3):12-13
4 Lai Y,Gallo RL.AMPed up immunity:how antimicrobial peptides havemultiple roles in immune defense.JTrends Immunol,2009,30(3):131-141.
5 Erdag G,Morgan JR.Interleukin-1alpha and interleukin-6 enhance the antibacterial properties of cultured composite keratinocyte grafts.Ann Surg,2002,235(1):113-124.
6 Cogen AL,Yamasaki K,Sanchez KM,et al.Selective antimicrobial action is provided by phenol-soluble modulins derived from Staphylococcus epidermidis,a normal resident of the skin. J Invest Dermatol,2010,130(1):192-200.
7Capone KA,Dowd SE,Stamatas GN,etal.Diversity of the human skinmicrobiome early in life.J Invest Dermatol,2011,131 (10):2026-2032.
8 Elias PM.Stratum corneum defensive functions:an integrated view.J Invest Dermatol,2005,125(2):183-200.
9 Yang JM,Ahn KS,Cho MO,et al.Novel mutations of the transglutam inase 1 gene in lamellar ichthyosis.J Invest Dermatol,2001,117(2):214-218.
10何黎.皮膚屏障與保濕.實用醫院臨床雜志,2009,3(6):25-27.
11 Bouwstra J,Pilgram G,Gooris G,et al.New aspects of the skin barrier organization.Skin Pharmacol Appl Skin Physiol,2001,14(Suppl 1):52-62.
12林宗賢,項蕾紅.皮膚屏障功能研究進展.國際皮膚性病學雜志,2008,34(6):371-373.
13 Ishida-Yamamoto A,Kishibe M.Involvement of corneodesmosome degradation and lamellar granule transportation in the desquamation process.Med MolMorphol,2011,44(1):1-6.
14 Hara-Chikuma M,Verkman AS.Physiological roles of glycerol-transporting aquaporins:the aquaglyceroporins.Cell Mol Life Sci,2006,63(12):1386-1392.
15 Fitz-Gibbon S,Tomida S,Chiu BH,et al.Propionibacterium acnes strain populations in the human skinm icrobiome associated with acne.J Invest Dermatol,2013,133(9):2152-2160.
16 Heilborn JD,Nilsson MF,Kratz G,et al.The cathelicidin anti-microbial peptide LL-37 is involved in re-epithelialization of human skin wounds and is lacking in chronic ulcer epithelium. J Invest Dermatol,2003,120(3):379-389.
17 Ma HL,Liang S,Li J,et al.IL-22 is required for Th17 cellmediated pathology in amousemodel of psoriasis-like skin inflammation.JClin Invest,2008,118(2):597-607.
18Cao C,Wan S,Jiang Q,et al.All-trans retinoic acid attenuates ultraviolet radiation-induced down-regulation of aquaporin-3 and water permeability in human keratinocytes.JCell Physiol,2008,215(2):506-516.
19 Elias PM,Hatano Y,Williams ML.Basis for the barrier abnormality in atopic dermatitis:outside-inside-outside pathogenic mechanisms.J Allergy Clin Immunol,2008,121(6):1337-1343.
20蘭宇貞,李鄰峰.洗浴刺激在泛發性濕疹發病中的作用.中國麻風皮膚病雜志,2008,24(5):346-348.
(收稿:2014-04-01 修回:2014-05-03)
·病例報告·
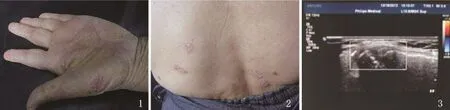
圖1 左手掌紅斑伴有干涸性膿皰、脫屑 圖2 腰部散在紅斑、鱗屑 圖3 超聲:(右側胸鎖關節)可見關節囊擴張,囊內可見不勻質低回聲,關節骨皮質回聲毛糙,可見侵蝕跡象。CDFI顯示血流信號豐富
討論 SAPHO綜合征即滑膜炎(synovitis)、痤瘡 (acne)、膿皰病(pustulosis)、骨肥厚(hyperostosis)、骨髓炎綜合征(osteomyelitis)。1診斷標準2:①多病性骨髓炎,伴或不伴有皮膚表現;②急慢性無菌性關節炎,伴有膿皰型銀屑病、掌跖膿皰病或痤瘡;③無菌性骨炎伴有一種特征性的皮膚損害。符合以上三個條件之一即可診斷為SAPHO綜合征。本病的特征性臨床表現為皮膚損傷伴骨關節病變。皮膚表現:①膿皰病:掌跖膿皰病、膿皰型銀屑病;②痤瘡:聚合性痤瘡、暴發性痤瘡、毛囊閉鎖三聯征。骨損害:病變可為單發或多發,其主要特點為慢性骨膜反應和皮質增生引起的骨肥厚,3長期病程可導致鎖骨和肋骨肥厚,甚至融合,還可壓迫鄰近神經、血管結構引起上肢疼痛和水腫,稱“胸出口綜合征”。成人病例最常累及前上胸壁(約占65%~90%),其次是脊柱、骨盆、長骨。兒童病例最易累及下肢長骨干骺端,4其次是前上胸壁、脊柱。由于皮膚損害與骨損害可不同時出現,是造成漏診的主要原因。本病目前尚無特效療法,臨床多采用非甾體類抗炎藥作為一線藥物,如無效,可加用氨甲喋呤、柳氮磺胺吡啶、環孢素等治療。生物制劑如英夫利昔單抗對部分治療抵抗患者有效。5
參考文獻
1趙辨.中國臨床皮膚病學.南京:江蘇科學技術出版社,2009. 1726.
2 Kahn MF,Khan MA.The SAPHO syndrome.Baillieres Clin Rheumatol,1994,8(2):333-362.
3 Earwaker JWS,Cotten A.SAPHO:syndrome or concept Imaging findings.Skeletal Radiol,2003,32:311-327.
4孫洋,孟悛非.SAPHO綜合征的影像學表現.國外醫學:臨床放射學分冊,2005,28(2):93-95.
5Skinner AR.A review of the use of infllximab tomanage tomanage cutaneous dermatoses.JCutan Med Surg,2004,8(2):77-89.
(收稿:2013-04-25)
Skin barrier and diseases
ZHANG Yuan,LIU Yong,YAN Min,et al.Department of Dermatology,Shengli Oilfield Central Hospital,Shandong Dongying,257000
Skin barrier includes physical barrier,chemical barrier and immunological barrier,which play important roles in some dermatosis.In this paper the skin barrier structure and function are introduced.
skin barrier;dermatosis
勝利油田中心醫院,山東東營,257000?通信作者

