白念珠菌線粒體功能缺陷對胞壁結構及毒力的影響
佘曉東高 盈張莉莉沈永年Li Dongmei,2?劉維達?
·論著·
白念珠菌線粒體功能缺陷對胞壁結構及毒力的影響
佘曉東1高 盈1張莉莉1沈永年1Li Dongmei1,2?劉維達1?
目的: 明確白念珠菌線粒體功能缺陷對菌株細胞壁結構及致病力的影響。方法: 通過透射電鏡觀察野生株與缺陷株胞壁結構的差異;利用qPCR檢測野生株與缺陷株細胞壁成分MNN4、PHR3,常見黏附因子ALS1、ALS3及毒力因子SAP9、SAP10的表達;利用小鼠系統感染模型明確缺陷株與野生株在小鼠致死率及臟器菌載量等方面的差異。結果: 與野生株相比,透射電鏡顯示缺陷株細胞壁整體結構較為疏松,胞壁較薄,胞壁內外膜境界模糊;qPCR顯示缺陷株細胞壁成分、黏附因子、毒力因子表達顯著降低;動物模型顯示缺陷株無法導致小鼠系統性感染死亡,肝、脾、腎臟器菌載量在接種后第3日明顯降低。結論: 白念珠菌線粒體功能缺陷會導致其胞壁完整性,并下調主要胞壁成分及毒力因子的表達,從而導致菌株致病力顯著減弱。
白念珠菌; 線粒體; 細胞壁; 毒力
白念珠菌(Candida albicans)屬于重要的條件致病性真菌,1除宿主機體免疫力降低等致病因素之外,獨特的胞壁結構及毒力因子是其致病的重要因素。白念珠菌線粒體作為菌體能量代謝的重要細胞器,2其功能缺陷勢必會引起菌株自身代謝改變并影響菌株活性,本實驗擬通過研究白念珠菌線粒體功能缺陷時其胞壁形態、成分及毒力的改變,初步明確線粒體功能變化對白念珠菌致病性的影響,以期進一步了解菌株自身代謝與其致病能力的相關性。
1 材料與方法
1.1 念珠菌培養 標準菌株(SC5314,由中國微生物菌種保藏中心提供),線粒體功能缺陷株(GOA31,由美國Georgetown University微生物免疫中心惠贈)。菌株于沙堡弱氏固體培養基上進行傳代培養,實驗前挑單個培養菌落接種于3 mL YPD(0.5%酵母浸膏、2%蛋白胨、2%葡萄糖)液體培養基中37℃恒溫搖床孵育48 h備于實驗。
1.2 白念珠菌透射電子顯微鏡掃描 將YPD液體中
念珠菌離心(3000 r/min,5 min)后用PBS緩沖液清洗3遍,放置于2.5%戊二醛中4℃過夜保存,標本經脫水、包埋、超薄切片、重金屬染色后于透射電子顯微鏡(HITACHI-H7650)下觀察胞壁結構及形態變化。
1.3 白念珠菌總RNA提取 念珠菌RNA采用液氮研磨后參照Trizol產品說明書(Life Technologies)用酚、氯仿、異戊醇進行提取經 DNase消化殘存的DNA。提取的RNA經Nano drop測定濃度后檢測樣品濃度以及A260/A280(1.8~2.1),然后于2%瓊脂糖凝膠80V電泳檢測提取質量,將質量合格的RNA-80℃保存。
1.4 熒光定量PCR 選取內參C.albicans 18S RNA和胞壁成分因子MNN4、PHR3以及黏附和毒力因子ALS1、ALS3、SAP9、SAP10進行熒光定量PCR檢測。選用IDT DNA在線軟件設計引物(見表1)。反應體系:2×SYBR Green PCR buffer 12.5 μL、ROX 0.5 μL、primer(5 pmol)1 μL、Template+ddH2O 11 μL,總體積25 μL;95℃,2 min,接著進行40個循環,95℃,15 s;59℃,1 min。依據2-△△CT法判讀結果。

表1 qPCR擴增引物序列
1.5 動物實驗 實驗用雌性Balb/C純系小鼠,6~7周齡,揚州大學實驗動物中心提供。用無菌生理鹽水洗滌白念珠菌,重復3次,用血細胞計數板計數,根據細胞計數結果將白念珠菌細胞調節到1×106個/mL,通過尾靜脈注射白念珠菌懸浮液。實驗小鼠分為野生株(SC5314)感染模型,缺陷株(GOA31)感染模型。每組13只小鼠,觀察21 d,記錄每天小鼠存活數量。分別于菌株接種1、2、3 d后每組取1只小鼠處死取肝、脾、腎組織研磨稀釋后于YPD培養基中37℃恒溫搖床孵育48 h進行菌落(Colony Forming Units,CFU)計數(每個臟器組織做3次涂板計數,取均數)。并取接種2 d后腎臟組織進行病理取材和染色制片,觀察真菌侵入程度。
2 結果
2.1 白念珠菌透射電鏡掃描 鏡下結構顯示野生株(圖1A)細胞壁整體結構較為完整,胞壁較厚且均勻致密,胞壁內外膜境界清晰。缺陷株(圖1B)則表現為胞壁較薄、疏松,胞壁內外膜境界較模糊,尤以內側膜破壞較重,甚至部分缺失。
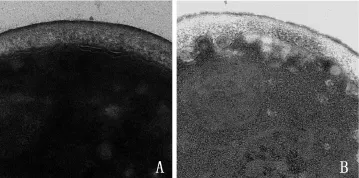
圖1 白念珠菌野生株(A)與缺陷株(B)透射電鏡掃描圖(×25k)
2.2 qPCR測定白念珠菌細胞壁成分及毒力因子變化 熒光定量PCR結果顯示,缺陷株各檢測因子的Ct(Cycle threshold)值較野生株顯著改變,從柱狀圖可以看出,缺陷株較野生株的胞壁成分基因及毒力基因表達整體下調(圖2),下調倍數為2.4~5.8,其中以PHR3和ALS3表達差異最大。
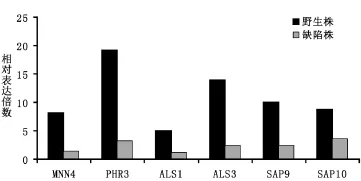
圖2 野生株與缺陷株細胞壁成分因子和菌株毒力因子分布
2.3 小鼠系統性感染模型驗證菌株毒力變化 野生株接種組小鼠全部于接種后5天內死亡,其中接種后第2天死亡4只,其余均在3~5天內死亡(1~2只/天);缺陷株接種組未見小鼠死亡(圖3)。兩組小鼠各臟器菌載量結果顯示,腎臟組織菌載量最多,肝臟次之、脾臟最少,野生株接種組菌載量顯著高于缺陷株接種組。缺陷株接種組各臟器菌載量在第2天最高,第3天顯著降低,野生株接種組未見明顯降低(表2)。野生株接種后2天腎臟組織病理示組織內大量菌絲形成,部分菌絲成團并嵌入組織內部(圖4A),缺陷株感染組未見菌絲形成(圖4B)。
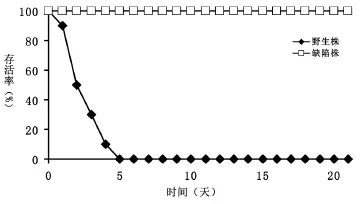
圖3 野生株與缺陷株白念珠菌接種小鼠21天存活率
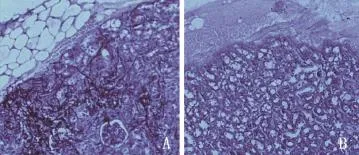
圖4 小鼠尾靜脈接種野生株(A)及缺陷株(B)后第2天腎臟組織病理切片圖(PAS,×100)
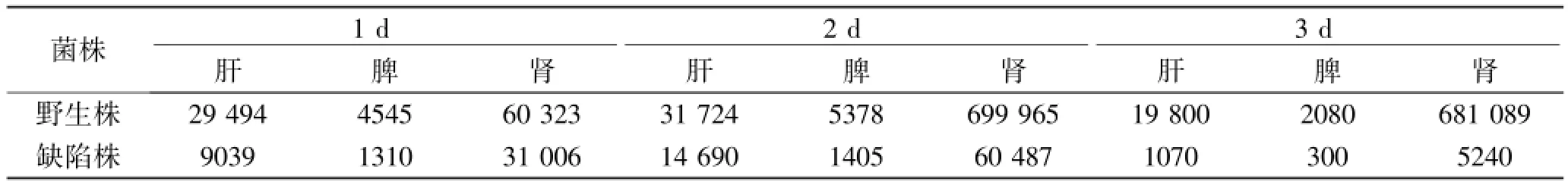
表2 小鼠尾靜脈接種白念珠菌后不同臟器CFU計數
3 討論
線粒體是一種存在于真核細胞中的由兩層膜包被的細胞器,是細胞中制造能量的結構,是細胞進行有氧呼吸的主要場所。因此,線粒體功能變化會從源頭上影響整個細胞的能量代謝、營養物質合成。本實驗利用線粒體功能缺陷白念珠菌GOA31,對線粒體功能缺陷條件下菌株細胞壁成分合成及毒力因子等關鍵致病因素的變化進行了驗證。
白念珠菌細胞形態的變化是其自身狀態的直接體現,其中細胞壁作為白念珠菌和宿主的分界面,參與白念珠菌的黏附,分泌致病性的毒力因子,在引起侵襲性感染的同時還可以通過相應的受體和配體的結合來誘導和調節機體的固有免疫和獲得性免疫應答。白念珠菌細胞壁主要包括甘露聚糖、β-葡聚糖及幾丁質。其中β-葡聚糖和幾丁質是細胞壁的結構成分,甘露聚糖是白念珠菌細胞壁可溶性的具有免疫顯性作用物質。3本實驗電鏡結果顯示缺陷株較野生株在細胞壁完整性方面有明顯區別,估計與線粒體功能的缺陷影響自身營養物質合成繼而影響胞壁結構有關。實驗中為進一步明確此推測,我們選取白念珠菌細胞壁中兩種最關鍵的成分甘露聚糖及葡聚糖的代表基因進行熒光定量PCR的檢測,結果顯示上述兩種成分均出現明顯表達下降,與電鏡結果相互應證,更加肯定了線粒體功能變化對白念珠菌細胞壁結構的影響。
白念珠菌致病時首先黏附宿主細胞,然后通過各種細胞外酶增強毒力侵入宿主形成感染灶。凝集素樣序列(Agglutinin-Like Sequence,ALS)和分泌型天冬氨酸蛋白酶(Secreted Aspartyl Proteinase,SAP)作為目前已知重要的白念珠菌黏附及毒力因子,在其致病過程中起到關鍵作用。其中ALS1在血行播散性鼠感染模型中是重要的毒力因子。4ALS3除了其黏附作用,還作為重要的抗原識別位點誘導上皮細胞對白念珠菌的吞噬,是引起上皮細胞損傷和后續細胞毒作用的關鍵一步。5在SAP家族中,SAP9和SAP10對維持白念珠菌表面完整性至關重要,在白念珠菌感染患者和攜帶者中均高表達。6SAP9參與白念珠菌芽管形成,不僅是白念珠菌入侵宿主的毒力因子,也是宿主識別白念珠菌,活化抗感染免疫的誘導因子。7為進一步研究線粒體功能缺陷對菌株毒力的影響,我們通過熒光定量PCR檢測了上述4個重要黏附及毒力因子在線粒體缺陷株的表達變化,實驗結果顯示上述因子在缺陷株表達均明顯降低。說明缺陷株在黏附力及侵襲性方面均明顯減弱,可能對其侵襲宿主及免疫逃逸造成影響。
動物模型可以模擬、反映真實的機體致病狀態,有助于更方便,更有效地認識疾病的發生發展規律。8本實驗選用系統性感染小鼠模型為研究對象,直觀研究缺陷株對小鼠致病力的改變。結果顯示,缺陷株較野生株毒力明顯減輕,可能與上述黏附因子及毒力因子表達下降有關。為進一步觀察致病菌在小鼠體內的感染情況,我們對各感染小鼠的肝、脾、腎進行菌載量測定及腎臟組織病理學檢測。結果在感染的各臟器中,腎臟組織菌載量最高、肝臟次之、脾臟最少,這與其他實驗結果類似。9分析原因,估計與各臟器的形態結構、血流狀況及免疫反應對念珠菌感染造成的影響不同有關。缺陷株接種小鼠各臟器菌載量在感染后第2天達到高峰,之后明顯減少,而野生株組則未見明顯變化。腎臟組織病理學檢測顯示,相對于野生株在腎臟組織內大量菌絲形成并嵌入組織,缺陷株未見明顯菌絲形成。說明缺陷株在進入小鼠體內后并沒有形成致病性的菌絲相,經過短暫自身繁殖增長后,由于黏附力及毒力的降低逐漸被機體免疫系統清除,因而無法形成系統性感染。但本次實驗我們只進行了初步研究,觀察時間較短,只檢測了通常認為感染最嚴重時期即接種后3天之內的臟器真菌載量,未能完全研究出致病菌株特別是缺陷株在小鼠體內的感染及清除過程;且動物數量較少,不能完全排除小鼠個體差異對實驗的影響,需在后續實驗中加大實驗動物數量、延長菌載量觀察時間,進一步明確整個感染過程。
本實驗利用分子生物學及動物模型方法從細胞形態、菌株毒力及致病力方面驗證了線粒體功能缺陷對白念珠菌致病性的影響,初步明確了菌株線粒體功能缺陷會導致自身致病力降低,對今后念珠菌感染性疾病控制及抗真菌新藥的研發具有一定意義。
1 Leventakos K,Lewis RE,Kontoyiannis DP.Fungal infections in leukemia patients:how do we prevent and treat them?Clin Infect Dis,2010,50(3):405-415.
2 Qu Y,Jelicic B,Pettolino F,et al.Mitochondrial sorting and assembly machinery subunit Sam37 in Candida albicans:insight into roles of mitochondria in fitness,cell wall integrity,and virulence.Eukaryot Cell,2012,11(4):532-544.
3 Gelis M,de Groot PW,Castillo L,et al.Pga13 in Candida albicans is localized in the cell wall and influences cell surface properties,morphogenesis and virulence.Fungal Genet Biol,2009,49 (4):322-331.
4 Hoyer LL,Green CB,Oh SH,et al.Discovering the secrets of the Candida albicans agglutininlike sequence(ALS)gene family-a sticky pursuit.Med Mycol,2008,46(1):1-15.
5 Murciano C,Moyes DL,Runglall M,et al.Evaluation of the role of Candida albicans agglutinin-like sequence(Als)proteins in human oral epithelial cell interactions.PLoS One,2012,7 (3):e33362.
6 Nailis H,Kucharíková S,Ricicová M,et al.Real-time PCR expression profiling of genes encoding potential virulence factors in Candida albicans biofilms:identification of model-dependent and-independent gene expression.BMC Microbiol,2010,10: 114.
7 Albrecht A,Felk A,Pichova I,et al.Glycosylphosphatidylinositol-anchored proteases of Candida albicans target proteins necessary for both cellular processes and host-pathogen interactions.J Biol Chem,2006,281(2):688-694.
8 Saville SP,Lazzell AL,Chaturvedi AK,et al.Use of a genetically engineered strain to evaluate the pathogenic potential of yeast cell and filamentous forms during Candida albicans systemic infection in immunodeficient mice.Infect Immun,2008,76 (1):97-102.
9 Lionakis MS,Lim JK,Lee CC,et al.Organ-specific innate immune responses in a mouse model of invasive candidiasis.J Innate Immun,2011,3(2):180-199.
(收稿:2015-01-26)
Effects of Candida albicans mitochondrial dysfunction on cell wall structure and virulence
SHE Xiao-dong,GAO Ying,ZHANG Li-li,et al.Institute of Dermatology,Chinese Academy of Medical Sciences(CAMS),Jiangsu Key Laboratory of Molecular Biology for Skin Diseases and STIs,Nanjing,210042
Objective:To determine the effects of Candida albicans mitochondrial dysfunction on cell wall structure,virulence and pathogenicity.Methods:The differences of cell wall structure between the wild-type strain and the deficient strain were observed under transmission electron microscopy.The expression of cell wall components MNN4,PHR3,adhesion factors ALS1,ALS3 and virulence factors SAP9,SAP10 in the wild-type and deficient strain were detected using qPCR.The differences of the fatality rate and organ CFU load between the wild-type and deficient strain were detected in mice system infection model.Results:Compared with the wild-type strain,the deficient strain showed that the cell wall was thinner,the structure was looser and the realm of inner and outer membrane of cell wall was fuzzier under transmission scanning electron microscope.The expression of cell wall components,adhesion factors and virulence factors reduced significantly and there was no mice death in the deficient strain group.The CFU in liver,spleen and kidney of the mice treated with the deficient strain after 3 days reduced significantly.Conclusion:Mitochondrial dysfunction in candida albicans damage the cell wall integrity,reduce the expression of the major cell wall components and virulence factors,resulting in reduction of the pathogenicity of strain.
Candida albicans;mitochondrial;cell wall;virulence
國家自然科學青年基金項目(編號:81401652)江蘇省自然科學青年基金項目(編號:BK20130063)
1中國醫學科學院、北京協和醫學院皮膚病研究所,江蘇省皮膚病與性病重點分子生物學實驗室,南京,210042 2 Department of Microbiology&Immunology,Georgetown University Medical Center,Washington DC 20057,USA
?通信作者

