3.0 T DCE-MRI定量分析在前列腺癌與增生鑒別診斷中的應用價值
徐嬿,冷曉明,鄭蕓,趙曼,曾道輝,韓曉蕊,馮欣,王曉春
廣州中醫(yī)藥大學第一附屬醫(yī)院影像科,廣州 510405
前列腺疾病嚴重威脅著男性的健康,其中最具危害的還是前列腺癌。MRI檢查是前列腺疾病最佳的影像學檢查方法,典型的前列腺癌常表現(xiàn)為外周帶的T2WI低信號結節(jié)影,但前列腺炎、纖維化、出血、鈣化、內分泌治療后也可表現(xiàn)為外周帶低信號影,因此敏感性、特異性不高[1]。此外,常規(guī)MRI對發(fā)生在中央帶的癌結節(jié)的檢測率較低,有時中央帶癌結節(jié)的MRI表現(xiàn)與增生結節(jié)類似,較難鑒別[2-3],這些都對前列腺癌的診斷增加了困難。近年來有研究表明DCE-MRI的敏感性及特異性較常規(guī)T2WI圖像高,大大提高了前列腺疾病的診斷[4-5]。本研究主要研究動態(tài)增強的定量參數(shù)對前列腺癌與其增生的鑒別診斷價值以及定量指標Ktrans、Kep、Ve與腫瘤組織Gleason評分的相關性,提示腫瘤的惡性程度,為臨床提供診斷及治療依據(jù)。
1 材料和方法
1.1 病例資料
搜集2013年7月至2014年12月在我院行常規(guī)MRI和DCE-MRI檢查的前列腺患者43例,年齡47~84歲,平均68歲,前列腺特異性抗原(prostate specifi c antigen,PSA)水平4.9~100 ng/ml,所有被試人員均簽署知情同意書。患者入選標準:①行前列腺MRI檢查前未經(jīng)過內分泌、放療等非手術治療;②MR檢查前一個月未進行過前列腺穿刺;③行前列腺MRI檢查后行直腸超聲引導下標準12針法穿刺活檢或前列腺根治術并經(jīng)病理證實。
1.2 檢查方法
MRI檢查采用GE HDxt 3.0 T 磁共振掃描儀,體相控陣線圈,掃描中心位于恥骨聯(lián)合上方約2 cm處,掃描前囑受檢者適量飲水,膀胱中度充盈,防止過度充盈引起波動偽影及檢查時間過長患者無法耐受檢查。掃描序列包括常規(guī)冠狀位、軸位、矢狀位T2WI、軸位T1WI及DCE-MRI序列。其中DCE-MRI掃描采用LAVA-FLEX掃描序列,動態(tài)增強掃描前先行多翻轉角掃描序列,共7個多翻轉角序列,每個序列均掃描一個時相,翻轉角(Flip Angle)分別為:3、6、9、12、5、10、15。掃描參數(shù):TR/TE為4.272/2.06,層厚/層間隔為4 mm/2 mm,矩陣288×224,重建矩陣512×512,視野350×350,時間分辨率16 s。多翻轉角序列掃完后行動態(tài)增強掃描,掃描參數(shù):翻轉角為15,TR/TE為4.272/2.06,層厚/層間隔為4 mm/2 mm,矩陣288×224,重建矩陣512×512,視野350×350,時間分辨率16 s,共掃描35個時相。掃描開始同時注射對比劑釓雙胺注射液(歐乃影,GE醫(yī)療)。對比劑經(jīng)肘前靜脈留置針高壓注射器快速注射,注射速率 2 ml/s,注射劑量15 ml,然后注射生理鹽水20 ml,注射速率2 ml/s。
1.3 圖像及數(shù)據(jù)分析
DCE-MRI定量分析采用血流動力學定量分析軟件Omni Kinetics(GE醫(yī)療,中國)進行后處理。首先導入7個多翻轉角序列進行T1 mapping計算用于時間亮度圖像到時間對比劑濃度圖像轉換。然后將動態(tài)增強序列導入,選擇動脈血管層面勾畫圓形的感興趣區(qū)(region of interest,ROI)得到該區(qū)域內正常供血血管的時間濃度曲線作為動脈輸入函數(shù)(arterial input function,AIF)曲線。將AIF曲線作為參照,選擇Extended Tofts Linear雙室模型對病灶層面進行血管滲透性定量分析,獲得血管滲透性參數(shù)容積轉運常數(shù)(Ktrans)、速率常數(shù)(Kep)、血管外細胞外容積分數(shù)(Ve),并生成病灶增面各參數(shù)紅藍偽彩圖相關參數(shù)圖像。勾畫病灶ROI時通過根治術后大體標本切片和直腸超聲引導下穿刺活檢病理結果明確癌組織和增生組織,穿刺采用標準12針法穿刺法。主要觀察腫瘤的位置、形態(tài)、大小和邊界,在動態(tài)增強原始圖像上勾畫病灶ROI,各個參數(shù)偽彩圖ROI相同。畫定ROI后通過軟件對前列腺癌組織和增生組織的Ktrans、Kep、Ve進行自動分析。ROI的放置原則為:①選擇各區(qū)中心層面放置ROI;②放置于各分區(qū)強化最明顯的區(qū)域;③ROI為圓形,面積約為20 mm2;④盡量避開外周帶與中央腺體交界處、精囊根部、血管、出血或鈣化灶等,在中央?yún)^(qū)放置ROI時應注意避開尿道。每個病灶重復3次ROI勾畫,取3次測量的平均值。
1.4 統(tǒng)計學分析
采用SPSS 13.0統(tǒng)計軟件進行統(tǒng)計學分析,采用兩獨立樣本t檢驗比較前列腺癌組與增生組Ktrans、Kep、Ve的差異,采用直線相關性檢驗評價Ktrans、Kep、Ve與病理Gleason評分的相關性。P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1 穿刺病理結果
本研究共收集71份可用組織樣本,包括38份前列腺癌和33份前列腺增生組織樣本。前列腺癌患者術后Gleason評分:評分≤7分者16例,8分者11例,9分者8例,10分者3例。前列腺癌結節(jié)在T2WI上表現(xiàn)為外周帶低信號結節(jié),DWI上以高信號為主,動態(tài)增強掃描多表現(xiàn)為快進快出,呈高灌注表現(xiàn)(圖1);前列腺增生結節(jié)在T2WI以高信號為主,DWI上呈等或稍高信號,動態(tài)增強掃描多表現(xiàn)為漸進性強化,強化程度無明顯下降(圖2)。
2.2 DCE-MRI定量分析結果
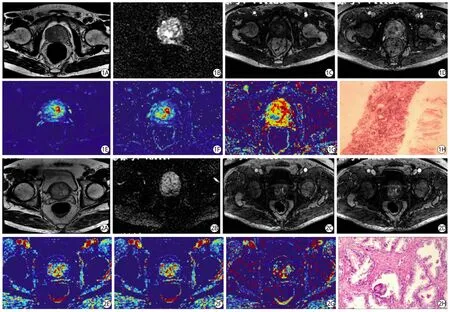
圖1 77歲,前列腺癌患者,PSA值為69.5 ug/L(ng/ml),Gleason評分為7分。A:軸位T2WI,示前列腺右側外周區(qū)及中央?yún)^(qū)低信號結節(jié)影,邊界不清;B:DWI b=1000,結節(jié)呈不均勻高信號;C、D:分別為軸位DCE第11期及30期動態(tài)圖像,示該結節(jié)早期強化明顯,后期強化程度明顯下降;E~G:分別為DCE Ktrans圖、Kep圖、Ve圖,結節(jié)表現(xiàn)為高灌注,該結節(jié)定量分析指標Ktrans=0.316 min-1,Kep=0.752 min-1,Ve=0.328;H:病理圖HE×100,示輕至中度異型細胞排列呈小腺管樣浸潤,胞漿透亮,可見核仁 圖2 65歲,前列腺增生者,PSA值為6.5 ug/L(ng/ml)。A:軸位T2WI,示前列腺中央?yún)^(qū)左側高信號結節(jié)影,邊界清;B:DWI b=1000,結節(jié)呈等信號;C~D:分別為軸位DCE第16期及35期動態(tài)圖像,示該結節(jié)第16期開始強化,以邊緣強化為主,后期強化程度變化不明顯;E~G:分別為DCE Ktrans圖、Kep圖、Ve圖,該結節(jié)定量分析指標Ktrans=0.218 min-1n,Kep=0.504 min-1,Ve=0.307;H:病理圖HE×100,示前列腺腺體、平滑肌及纖維組織增生,局部較多淋巴結細胞浸潤Fig.1 Seventy-seven years old prostate cancer patient,PSA =69.5 ug/L(ng/ml),Gleason score was 7.A:The axial T2 weighted imaging,showed the low signal nodules in the right peripheral zone and central area of the prostate,with unclear boundary; B:DWI b=1000,the nodules showed non-homogeneous high signal; C—D:Axial images in the 11th phase and 30th phase of dynamic contrast-enhanced MRI,the nodule with early enhancement signifi cantly,lately the degree of enhancement decreased signifi cantly; E—G:The Ktrans,Kep and Ve chart,the nodule showed high perfusion,the nodule quantitative analysis index showed Ktrans=0.316 min-1,Kep=0.752 min-1,Ve=0.328; H:Pathology picture of HE×100,showed mild to moderate abnormal cells infi ltrated like small tube,with translucent cytoplasm,nucleolus showed mild to moderate atypia arranged in small tube like infi ltration,cytoplasm translucent,the nucleolus were visible.Fig.2 Sixty-fi ve years old prostate hyperplasia patient,PSA =6.5 ug/L(ng/ml).A:The axial T2 weighted imaging,showed the high signal nodules in the left central area of the prostate,with clear boundary; B:DWI b=1000,the nodules showed homogeneous signal; C—D:Axial images in the 16th phase and 35th phase of dynamic contrast-enhanced MRI,the edge of the nodule was enhanced in the 16th phase,and there was no obvious change in the degree of late enhancement; E—G:The Ktrans,Kep and Ve chart,the nodule quantitative analysis index showed Ktrans=0.218 min-1,Kep=0.504 min-1,Ve=0.307; H:Pathology picture of HE×100,showed prostate gland,smooth muscle and fi brous tissue hyperplasia,local lymph node cell infi ltration.
前列腺癌與前列腺增生的Ktrans、Kep、Ve值見表1。統(tǒng)計學分析顯示前列腺癌組織的Ktrans、Kep、Ve明顯高于前列腺增生,差異有統(tǒng)計學差異(P<0.001)。
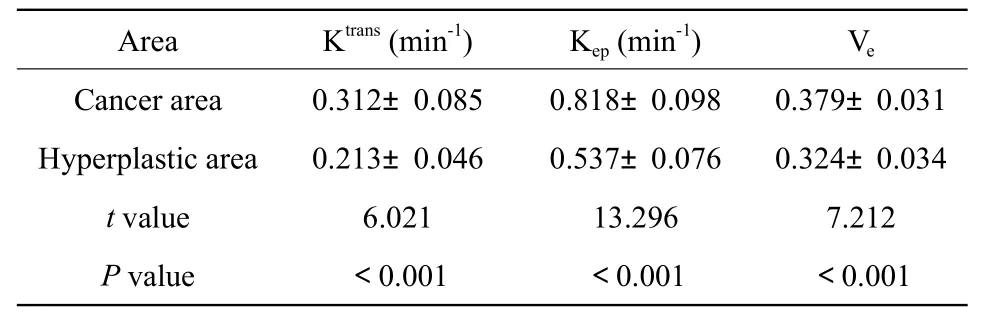
表1 前列腺癌與前列腺增生Ktrans、Kep、Ve值比較結果Tab.1 Comparison results of Ktrans,Kep and Ve values between prostate cancer and benign prostatic hyperplasia
2.3 前列腺癌區(qū)Ktrans、Kep、Ve與病理Gleason評分的相關性分析
前列腺癌區(qū)Ktrans、Kep、Ve與病理Gleason評分的相關性分析見表2。結果顯示前列腺癌區(qū)的Ktrans、Kep、Ve值與Gleason評分無明顯相關性。
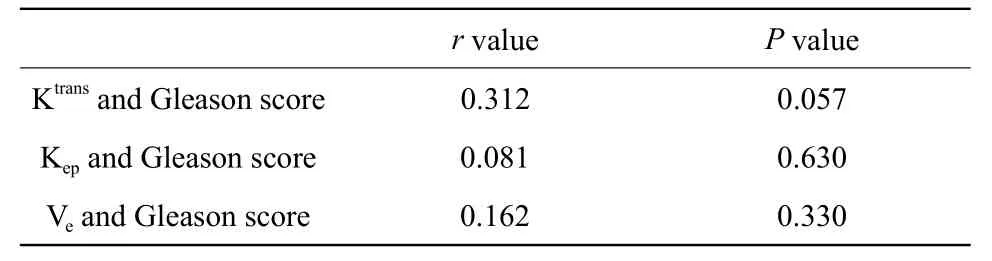
表2 前列腺癌區(qū)Ktrans、Kep、Ve值與Gleason評分直線相關分析結果Tab.2 Results of linear correlation between Ktrans,Kep,Ve and Gleason score in prostate cancer region
3 討論
DCE-MRI通過檢測人體前列腺組織的血流動力學變化,可將局部血流變化量化并進行分析,從而有效評估前列腺腫瘤微血管特性。腫瘤組織的血管生長速度與微血管的通透性密切相關[6],前列腺癌的血管生長與腫瘤的潛在生長、轉移及預后都有密切關系。因此,通過DCE-MRI技術獲得微血管通透性的定量指標并進行相關分析,可以實現(xiàn)對前列腺癌的無創(chuàng)診斷并評估預后。
與以往DEC-MRI側重于通過時間-信號曲線,獲取起始強化時間、強化曲線的平均和初始上升梯度、最大信號強度等數(shù)據(jù)并只能進行半定量分析相比,目前DCE-MRI定量分析則以血流動力學模型為基礎,通過分析對比劑滲漏和回流以及在血管內外所占的比例,精確、可重復的測量腫瘤微血管生理解剖及功能。排除了以往方法中諸如信號強度不穩(wěn)、受心輸出量及對比劑注射速度影響等干擾因素。準確地反映組織內對比劑濃度變化和組織生理學信息,實現(xiàn)對腫瘤生理的準確評估。
本研究中的主要測量參數(shù)為:轉運常數(shù)Ktrans、速率常數(shù)Kep、細胞外間隙分數(shù)Ve,均與腫瘤組織血管通透性、血液灌注和血管容積等基本生理特征相關,并且可以應用藥代動力學模型從DCE-MRI數(shù)據(jù)中得出。其中,Ktrans是指對比劑分子從血管內向血管外細胞間隙的通過率,反映對比劑分子通過血管壁的能力大小;Kep指滲漏到血管外細胞間隙的對比劑分子流回血管內的速率,反映對比劑在細胞外間隙的平均駐留時間;Ve則是血管外細胞外間隙內對比劑的容積分數(shù)[7]。本研究通過DCE-MRI定量分析發(fā)現(xiàn)前列腺癌組織的各指標Ktrans、Kep、Ve均明顯高于前列腺增生。前列腺癌組織中的微血管生成速度較前列腺增生更快,并且由于癌組織代謝旺盛,單位體積癌組織的血管密度較正常組織更高,而由于新生血管的內皮細胞間隙較正常血管內皮細胞間隙大,因此新生血管具有更大的滲透性[8]。Ktrans、Kep是反映組織微血管密度和滲漏的指標[9],因而前列腺癌組織的Ktrans、Kep較前列腺增生高,此結果與多數(shù)文獻報道一致[10-11]。以往研究分歧較大的是關于Ve值的結果,有研究認為癌區(qū)與增生區(qū)的Ve值無明顯統(tǒng)計學差異[1],也有研究認為癌灶的Ktrans、Kep、Ve參數(shù)高于增生組織[12]。本研究發(fā)現(xiàn)前列腺癌組織的Ve值較前列腺增生組織高,原因考慮為由于腫瘤組織代謝旺盛,新生毛細血管壁不完整,腫瘤血管具有較大的通透性,同時由于腫瘤組織較正常組織有較大的細胞外間隙,血管內外以及血漿與細胞外間隙間的對比劑濃度的差別促使對比劑通過血管壁進行轉移,導致血管外細胞外間隙內對比劑增多,因此Ve值升高。該結論與Cornud等人[12]研究結果相似。
目前關于DCE-MRI與Gleason評分相關性的研究還未得出一致的結論[13]。Gleason評分是評估前列腺癌侵襲性的病理學標準,是預后評估最有意義的指標 。Gleason評分總共分為5級,1級表示腫瘤組織結構分化最好,預后最好;5級表示腫瘤組織結構分化最差,預后最差;級別隨著組織結構分化程度及預后變差而升高。Gleason評分=主要結構類型(分級)+次要結構類型(分級),主要結構類型為癌區(qū)最常見的類型,次要結構類型為癌區(qū)第二常見的類型并且要求占標本的5% 以上。如果癌區(qū)只有一種結構類型,則認為其主要結構類型分級與次要結構類型一致,Gleason評分為兩種結構類型相加,范圍為2~10分[8]。
前列腺癌的分期和預后與腫瘤微血管密度密切相關。腫瘤組織分化程度越差,組織細胞的異型性越大,細胞增殖就越快,新生微血管越多,組織灌注及毛細血管通透性則升高。相關性研究表現(xiàn)前列腺癌的Gleason評分越高,其Ktrans值越大[14]。本組研究結果顯示前列腺癌區(qū)的Ktrans、Kep、Ve與Gleason評分無明顯相關性。分析原因可能有以下幾點:(1)本研究樣本量較少,Gleason評分分布較集中,高Gleason評分的病例相對較少,可能會使結果產生偏倚;(2)由于前列腺癌組織的多樣性,缺乏對組織主要、次要結構級別的細致分類,只是主要、次要結構級別的簡單相加,忽略了主要、次要結構各自對腫瘤侵襲性的影響;(3)缺乏根治術后大切片的病理標本,本研究中多數(shù)病例是由穿刺活檢取得的結果,而穿刺活檢的結果與根治術大切片病理結果的Gleason評分往往不一致;此外穿刺活檢可能會遺漏前列腺尖部的病變及早期體積較微小的病灶[15],從而會導致病理結果的假陰性。
綜上所述,DCE-MRI定量分析指標對前列腺癌與前列腺增生的鑒別診斷具有重要價值,為預測腫瘤的惡性程度和預后提供有意義的信息。而定量分析指標與前列腺癌Gleason評分的關系還需擴大樣本進一步研究。
[References]
[1]Jing GD,Wang J,Chen LG,et al.3.0 T dynamic contrast-enhanced MRI in clinical diagnosis of prostate cancer.Radiol Practice,2014,29(5):482-486.景國東,汪劍,陳錄廣,等.3.0 T動態(tài)增強MRI在前列腺癌診斷中的價值.放射學實踐,2014,29(5):482-486.
[2]Shimizu T,Nishie A,Ro T,et al.Prostate cancer detection:the value of performing an MRI before a biopsy.Acta Radiol,2009,50(9):1080-1088.
[3]Zhang XQ,Wang XY,Lu J,et al.MR imaging of incidentally detected prostate carcinoma in the central gland of prostate:preliminary study.Chin J Magn Reson Imaging,2010,1(4):264-267.張學琴,王霄英,陸健,等.前列腺中央腺體偶發(fā)癌的MRI初步研究.磁共振成像,2010,1(4):264-267.
[4]Zhang N,Chen M,Liu X.Functional magnetic resonance imaging in early noninvasive diagnosis of prostate cancer.Chin J Magn Reson Imaging,2010,1(4):313-316.張娜,陳敏,劉新.功能磁共振成像無創(chuàng)性診斷前列腺癌的研究進展.磁共振成像,2010,1(4):313-316.
[5]Jackson AS,Reinsberg SA,Sohaib SA.Dynamic contrastenhanced MRI for prostate cancer localization.Br J Radiol,2009,82(974):148-156.
[6]Kim JK,Hong SS,Choi YJ,et al.Wash-in rate on the basis of dynamic contrast-enhanced MRI:usefulness for prostate cancer detection and localization.J Magn Reson Imaging,2005,22(5):639-646.
[7]Bonekamp D,Macura KJ,Russell H.Dynamic contrast-enhanced magnetic resonance imaging in the evaluation of the prostate.Topic in Magnetic Resonance Imaging,2008,19(6):273-284.
[8]Kozlowski P,Chang SD,Meng R,et al.Combined prostate diffusion tensor imaging and dynamic contrast enhanced MRI at 3T-quantitative correlation with biopsy.J Magn Reson Imaging,2010,28(5):621-628.
[9]van Niekerk CG,van der Laak JA,Hambrock T,et al.Correlation between dynamic contrast-enhanced MRI and quantitative histopathologic microvascular parametersin organ-confined prostate cancer.Eur Radiol,2014,24(10):2597-2605.
[10]Langer DL,van der Kwast TH,Evans AJ,et al.Prostate cancer detection with multi-parametric MRI:logistic regression analysis of quantitative T2,diffusion-weighted imaging,and dynamic contrastenhanced MRI.J Magn Reson Imaging,2009,30(2):327-334.
[11]Jackson AS,Reinsberg SA,Sohaib SA,et al.Dynamic contrasterdamaced MRI for prostate cancer locatation.Br J Radiol,2009,82(974):148-156.
[12]Cornud F,Beuvon F,Thevenin F,et al.Quantitative dynamic MRI and localization of non-palpable prostate cancer.Prof Urol,2009,19:401-413.
[13]Engelbrecht MR,Huisman HJ,Laheij RJ,et al.Discrimination of protate cancer from normal peripheral zone and central glandtissue by using dynamic contrast-enhanced MR imaging.Radiology,2003,229(1):248-254.
[14]Wang L,Mazaheri Y,Zhang J,et al.Assessment of biologic aggressiveness of prostate cancer:correlation of MR signal intensity with Gleason grade after radical prostatectomy.Radiology,2008,246(1):168-176.
[15]Bigler SA,Deering RE,Brawer MR.Comparison of microscoric vascularity in benign and malignant prostate tissue.Hum pathol,1993,24(2):220-226.

