亞臨界水對卵清蛋白起泡性及乳化性的影響
涂宗財(cái),鈕培佩,王 輝,石 燕,黃小琴,李瑞平,常海霞,包中宇
(1.南昌大學(xué) 食品科學(xué)與技術(shù)國家重點(diǎn)實(shí)驗(yàn)室,生物質(zhì)轉(zhuǎn)化教育部工程研究中心,江西 南昌 330047;2.江西師范大學(xué)生命科學(xué)學(xué)院,江西 南昌 3 30022)
亞臨界水對卵清蛋白起泡性及乳化性的影響
涂宗財(cái)1,2,鈕培佩1,王 輝1,石 燕1,黃小琴2,李瑞平1,常海霞1,包中宇1
(1.南昌大學(xué) 食品科學(xué)與技術(shù)國家重點(diǎn)實(shí)驗(yàn)室,生物質(zhì)轉(zhuǎn)化教育部工程研究中心,江西 南昌 330047;2.江西師范大學(xué)生命科學(xué)學(xué)院,江西 南昌 3 30022)
采用亞臨界水處理卵清蛋白(ovalbumin,OVA),研究其對蛋白粒徑、自由巰基、表面疏水性、運(yùn)動黏度、起泡性能、乳化性能的影響。結(jié)果表明:亞臨界水能顯著降低卵清蛋白的粒徑、自由巰基含量、運(yùn)動黏度,增強(qiáng)其表面疏水 性;經(jīng)過亞臨界水處理后,卵清蛋白的起泡性顯著提高,其中剛升至140 ℃(處理0 min)時樣品的起泡性最高,比未處理的提高了2.7 倍,但隨著處理時間的延長,起泡性明顯下降;處理后的卵清蛋白乳化性顯著提高,并隨著處理時間的延長先增高后趨于不變,其中160 ℃處理15 min的乳化性最高,比未處理的提高了1.5 倍。
亞臨界水;卵清蛋白;起泡性;乳化性
雞蛋因其營養(yǎng)價值高、味道鮮美等優(yōu)點(diǎn)成為日常生活的主要食物之一,由于蛋黃中富含卵磷脂、ω-3脂肪酸、膽堿等生物活性物質(zhì),實(shí)現(xiàn)了其高效利用;但人們對蛋清重視不夠,甚至廢棄不用,因此,拓寬蛋清的應(yīng)用范圍意義重大。國內(nèi)外學(xué)者采用高壓[1]、輻照[2]、超聲[3]、糖基化[4]等對其進(jìn)行改性以期對其綜合利用,而卵清蛋白作為蛋清中的主要蛋白組分,其結(jié)構(gòu)與功能性質(zhì)會顯著影響蛋清蛋白的功能性質(zhì)[5]。
亞臨界水(subcritical water)是指低于臨界壓力(Pc= 22.1 MPa)和臨界溫度(Tc= 374 ℃)而溫度高于100 ℃的液態(tài)水;具有低黏度、低密度、較低的介電常數(shù)和較高的電離常數(shù)等理化特性,同時還具有高效、無毒、循環(huán)利用和低污染等優(yōu)點(diǎn)[6]。它通過解聚作用,分裂、脫水、脫羧和脫氨作用和重組反應(yīng)片段3 個步驟作用于生物質(zhì)[7-8]。目前,用亞臨界水技術(shù)處理蛋白質(zhì)的研究逐年增加[9-12],但是這些研究主要集中于蛋白質(zhì)水解產(chǎn)物和廢棄物的綜合利用,而關(guān)于亞臨界水改性蛋白質(zhì)的研究較少。因此,本實(shí)驗(yàn)以卵清蛋白(ovalbumin,OVA)為研究對象,研究亞臨界水對卵清蛋白顆粒大小、自由巰基、表面疏水性、運(yùn)動黏度、起泡性能、乳化性能的影響,為亞臨界水對蛋白質(zhì)的改性提供一定的理論依據(jù)。
1 材料與方法
1.1 材料與試劑
鮮雞蛋為老南溝糧食蛋;大豆油 益海嘉里食品營銷有限公司。
5,5’-二硫代雙(2-硝基苯甲酸)(5,5’-dithio bis-(2-nitrobenzoic acid),DTNB)、十二烷基硫酸鈉(sodium dodecyl sulfonate,SDS)、硫酸銨、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、三羥甲基氨基甲烷(Tris)、甘氨酸(Gly) 天津市大茂化學(xué)試劑廠;8-苯胺基-1-萘磺酸銨(8-anilino-1-naphthalenesulfonic acid,ANS) 美國Sigma公司。
1.2 儀器與設(shè)備
GSHA實(shí)驗(yàn)室磁力攪拌高壓反應(yīng)釜 威海嘉毅化工機(jī)械有限公司;T6新世紀(jì)紫外-可見分光光度計(jì)北京普析通用儀器責(zé)任有限公司;F-7000熒光分光光度計(jì) 日本日立高新科技公司;毛細(xì)管黏度計(jì) 上海中誼玻璃制品有限公司;HH-4數(shù)顯恒溫水浴鍋 國華電器有限公司;LGJ-1冷凍干燥機(jī) 北京亞泰科隆儀器技術(shù)有限公司;NICOMPTM 380激光納米粒度測定儀美國Nicomp公司。
1.3 方法
1.3.1 卵清蛋白的提取[13]
以鮮雞蛋為原料,采用鹽析法分離提純卵清蛋白,冷凍干燥后備用。
卵清蛋白制備工藝:蛋清→過濾→蒸餾水稀釋并調(diào)pH 5.5→4 000 r/min離心→上清液添加硫酸銨至飽和度50%→4 000 r/min離心→上清液調(diào)pH 4.5→沉淀用10—4mol/L EDTA溶解→添加硫酸按至飽和度38%→4 000 r/min離心→重復(fù)上述步驟直至6 次重結(jié)晶→透析24 h→凍干。
1.3.2 卵清蛋白的亞臨界水處理
將卵清蛋白配成5 mg/mL的溶液,取400 mL樣品于120、140、160 ℃的高壓反應(yīng)釜中,以溫度升至設(shè)定溫度時開始計(jì)時[14],分別處理0、15、30、60 min,取出用冰浴終止反應(yīng)。樣品經(jīng)冷凍干燥后備用,所有測定以未經(jīng)亞臨界水處理的卵清蛋白作對照。
1.3.3 粒徑大小的測定
采用激光納米粒度測定 儀測定亞臨界水處理前后樣品溶液蛋白的粒徑,使用CW388軟件計(jì)算蛋白的粒徑大小。
1.3.4 自由巰基含量的測定
采用Ellman法[15]測定蛋白質(zhì)中自由巰基的含量。
Ellman試劑:4 mg DTNB溶于l.0 mL Tris-Gly緩沖液(0.086 mol/L Tris,0.09 mol/L Gly和0.004 mol/L EDTA,pH 8.0)。
4 mL 1 mg/mL樣品溶液(溶劑為含8 mol/L尿素的Tris-Gly緩沖液)與200 μL Ellman試劑混合,室溫下放置30 min后在離心機(jī)中以8 000 r/min離心20 min,于412 nm波長處測定吸光度,以Tris-Gly緩沖液作對照。
自由巰基含量的計(jì)算公式如下。
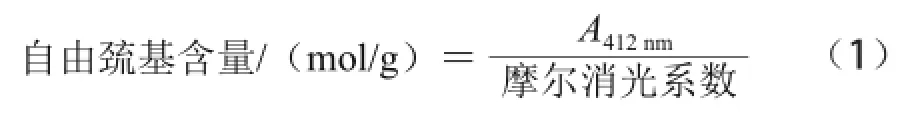
式中:摩爾消光系數(shù)=13 600 mol/(L·cm)。
1.3.5 表面疏水性的測定[16]
將亞臨界水處理前后的樣品用蒸餾水配制成5 mg/mL,取4 mL樣品,與 20 μL 8 mmol/L ANS溶液(溶劑為0.01 mol/L,pH 7.0的磷酸鹽緩沖溶液)混合,在激發(fā)波長390 nm,發(fā)射波長400~650 nm范圍內(nèi)進(jìn)行熒光掃描,掃描速率10 nm/s。以熒光強(qiáng)度的大小表示表面疏水性。
1.3.6 運(yùn)動黏度的測定[17-18]
將毛細(xì)管黏度計(jì)垂直放入25 ℃恒溫水浴槽中,取15 mL 10 mg/mL的亞臨界水處理前后的樣品溶液注入毛細(xì)管黏度計(jì)中,恒溫12 min后,將樣品溶液吸起使其沒過上刻度線,取下洗耳球,使溶液自由流下,待溶液流至毛細(xì)管黏度計(jì)的上刻度線時開始計(jì)時,流至下刻度線時停止計(jì)時,記錄時間,同上操作重復(fù)測定3 次,取平均值。運(yùn)動黏度的計(jì)算公式如下。

式中:ν為試樣的運(yùn)動黏度/(mm2/s);t為樣品溶液流經(jīng)上部刻度線 至下部刻度線的時間/s;C為黏度計(jì)常數(shù)/(mm2/s2)。
1.3.7 起泡性能的測定[19]
取10 mg/mL亞臨界水處理前后樣品溶液15 mL,室溫下用高速分散均質(zhì)機(jī)均質(zhì)2 min,轉(zhuǎn)速為9 500 r/min,然后快速移至50 mL量筒中,記錄泡沫體積(V0),靜置30 min后,記錄泡沫體積(V30)。
起泡性和泡沫穩(wěn)定性分別采用以下公式進(jìn)行計(jì)算。
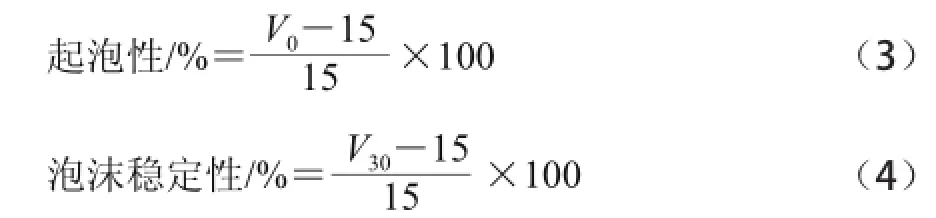
1.3.8 乳化性能的測定[20]
取大豆色拉油3 mL,加入9 mL 1 mg/mL的蛋白溶液,在室溫下用高速分散均質(zhì)機(jī)均質(zhì)2 min,轉(zhuǎn)速為9 500 r/min,迅速從底部吸取100 μL乳狀液,加入到4.9 mL 1 mg/mL的SDS溶液中(溶劑為100 mmol/L pH 7.4的磷酸鹽緩沖液),混合均勻,500 nm波長處測定吸光度(A0),10 min后,以同樣方式再次測其吸光度(A10)。
乳化性(emulsibility,EAI)和乳化穩(wěn)定性(emulsion stability,ESI)分別采用以下公式進(jìn)行計(jì)算。
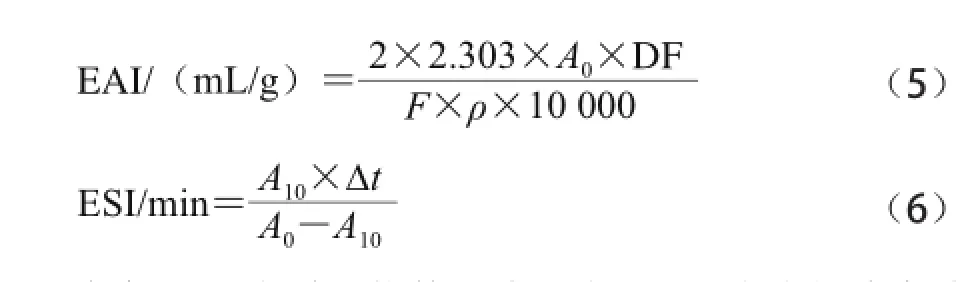
式中:DF為稀釋倍數(shù),此處為50;F為乳狀液中油體積分?jǐn)?shù),此處為25%;Δ t=10 min;ρ為乳化液形成前蛋白質(zhì)水溶液中蛋白質(zhì)量濃度/(g/mL)。
1.4 統(tǒng)計(jì)分析
本實(shí)驗(yàn)均進(jìn)行3 次平行實(shí)驗(yàn),2 次重復(fù)實(shí)驗(yàn)。采用Origin 7.5軟件作圖,SPSS 13.0軟件進(jìn)行統(tǒng)計(jì)分析;P<0.05表示有顯著性差異,P<0.01表示有極顯著性差異。
2 結(jié)果與分析
2.1 亞臨界水處理對卵清蛋白粒徑的影響

圖1 亞臨界水條件下卵清蛋白粒徑隨時間及溫度的變化Fig.1 Effect of subcritical water on the particle size of OVA at different time points and temperatures
卵清蛋白溶液粒徑的變化可以反映出亞臨界水處理對卵清蛋白宏觀結(jié)構(gòu)的變化。由圖1可知,經(jīng)過亞臨界水處理后,溶液中卵清蛋白的粒徑顯著降低(P<0.05),且隨著處理時間和溫度增加逐漸減小。卵清蛋白在160 ℃處理60 min時粒徑達(dá)最小,為258.3 nm,較未處理樣品的4 103.8 nm顯著下降,說明亞臨界水處理可降低卵清蛋白顆粒粒徑,這可能是因?yàn)閬喤R界水的高溫高壓作用對蛋白質(zhì)有很好的分散破碎效果[6],使蛋白粒徑發(fā)生改變。
2.2 亞臨界水處理對卵清蛋白自由巰基含量的影響

圖2 亞臨界水條件下卵清蛋白自由巰基含量隨時間及溫度的變化Fig.2 Effect of subcritical water on the free sulphydryl content of OVA at different time points and temperatures
巰基是維持蛋白質(zhì)二級結(jié)構(gòu)的重要因素,巰基含量改變會引起蛋白質(zhì)二級結(jié)構(gòu)的變化。卵清蛋白中的巰基基團(tuán)多藏于天然蛋白分子的疏水核心,加工過程如加熱、高壓等會引起巰基含量以及蛋白質(zhì)二級結(jié)構(gòu)的變化[1]。由圖2可知,經(jīng)亞臨界水處理后,卵清蛋白自由巰基的含量急劇下降(P<0.05),這說明亞臨界水處理 使卵清蛋白的高級結(jié)構(gòu)發(fā)生了很大程度的變化。其原因可能是亞臨界水處理過程中的高溫高壓,使自由巰基互相靠近,進(jìn)而進(jìn)一步相互結(jié)合形成了二硫鍵,導(dǎo)致巰基含量下降[16]。
2.3 亞臨界水處 理對卵清蛋白表面疏水性的影響
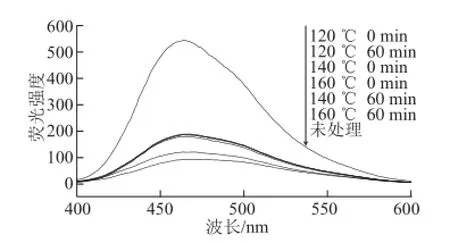
圖3 亞臨界水條件下卵清蛋白熒光強(qiáng)度隨時間及溫度的變化Fig.3 Effect of subcritical water on the surface hydrophobicity of OVA at different time points and temperatures
疏水基團(tuán)的相互作用是維持蛋白質(zhì)三級結(jié)構(gòu)的主要作用力,其對卵清蛋白結(jié)構(gòu)的穩(wěn)定和功能性質(zhì)具有重要作用[21]。由圖3可知,亞臨界水處理后的卵清蛋白的熒光強(qiáng)度均高于未經(jīng)亞臨界水處理的卵清蛋白的熒光強(qiáng)度。其中120 ℃ 0 min條件下的卵清蛋白的熒光強(qiáng)度最大。這可能是亞臨界水處理過程中的高溫高壓改變了卵清蛋白的空間結(jié)構(gòu),使卵清蛋白分子變性并伸展,弱化了蛋白質(zhì)分子內(nèi)部的疏水相互作用,并產(chǎn)生和暴露了更多的疏水性區(qū)域,導(dǎo)致蛋白質(zhì)的表面疏水性增強(qiáng)。但是隨著溫度的升高和時間的延長,熒光強(qiáng)度降低。這可能是因?yàn)槌掷m(xù)的高溫高壓使分子間的分子作用增強(qiáng),極性側(cè)鏈基團(tuán)的水合作用增強(qiáng),親水性提高,導(dǎo)致表面疏水性下降[1]。
2.4 亞臨界水處理對卵清蛋白運(yùn)動黏度的影響
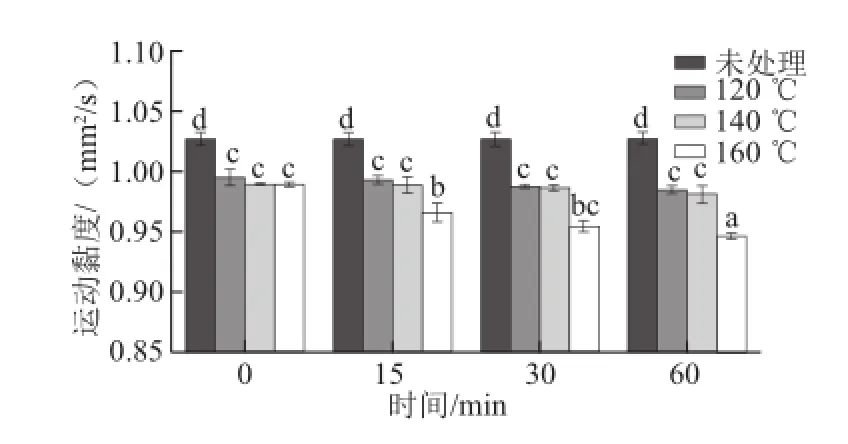
圖4 亞臨界水條件下卵清蛋白運(yùn)動黏度隨時間及溫度的變化Fig.4 Effect of subcritical water on the kinematic viscosity of OVA at different time points and temperatures
由圖4可知,經(jīng)亞臨界水處理后,卵清蛋白的運(yùn)動黏度降低,且隨著處理溫度的升高和處理時間的增加而降低,其中以160 ℃亞臨界水處理60 min后蛋白的運(yùn)動黏度最低(P<0.05)。黃小波等[22]研究表明,在蛋白質(zhì)流體黏度特性中,溶液中蛋白質(zhì)分子或顆粒的表觀直徑起主要作用,表觀直徑越大,黏度越大。這說明,亞臨界水處理降低卵清蛋白運(yùn)動黏度的根本原因 是亞臨界水處理降低了卵清蛋白的粒徑。
2.5 亞臨界水處理對卵清蛋白起泡性能的影響
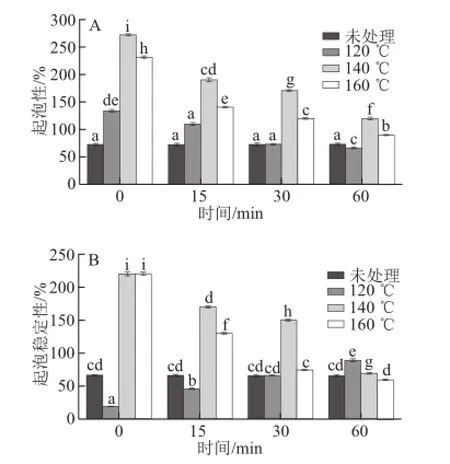
圖5 亞臨界水條件下卵清蛋白起泡性能隨時間及溫度的變化Fig.5 Effect of subcritical water on the foaming capacity and foam stability of OVA at different time points and temperatures
蛋白質(zhì)的起泡性能由眾多因素共同決定,其中蛋白質(zhì)分子的柔順性、疏水性、自由巰基-二硫鍵是影響泡沫性能的關(guān)鍵因素[23]。由圖5A可知,經(jīng)亞臨界水處理后,卵清蛋白的起泡性明顯提高(P<0.05),其中140 ℃處理0 min的起泡性最高,比未處理的提高了2.7 倍,但相同溫度下,隨著處理時間的增加,起泡性降低;由圖5B可知,在較高溫度下起泡穩(wěn)定性有明顯的提高,其中160 ℃處理0 min及140 ℃處理0 min的起泡穩(wěn)定性最高,比未處理的提高了2.3 倍,但隨著處理時間的延長,起泡穩(wěn)定性顯著下降(P<0.05)。可能原因是:亞臨界水的高溫高壓作用使得蛋白質(zhì)表面結(jié)構(gòu)一定程度地展開,疏水基團(tuán)暴露,使空氣/水界面的表面張力有所下降,使得蛋白質(zhì)能更好地?cái)U(kuò)散到空氣/水界面,蛋白質(zhì)的起泡能力及起泡穩(wěn)定性提高;另外,更小的蛋白顆粒使其在空氣/水界面擴(kuò)散和吸附更容易,界面張力降低,蛋白分子柔性提高,促進(jìn)了泡沫的形成,蛋白質(zhì)的起泡能力及起泡穩(wěn)定性提高[24]。但是,隨著處理時間的延長,蛋白質(zhì)分子進(jìn)一步展開,內(nèi)部的疏水基團(tuán)和巰基暴露加劇,從而極化的蛋白分子間通過非共價鍵重新聚集,即疏水性降低,形成不穩(wěn)定的二維網(wǎng)絡(luò)結(jié)構(gòu)和界面膜,因此起泡能力與起泡穩(wěn)定性逐漸下降。以上研究表明亞臨界水的短時間處理,能夠顯著改善卵清蛋白的起泡性能。
2.6 亞臨界水處理對卵清蛋白乳化性及乳化穩(wěn)定性的影響
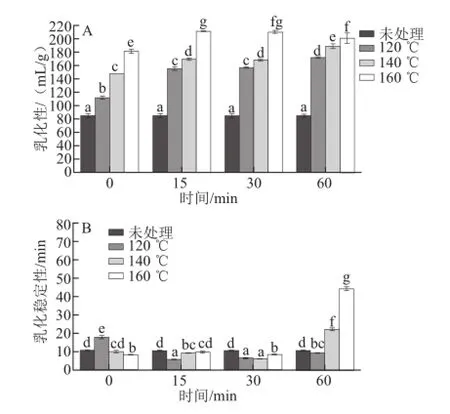
圖6 亞臨界水條件下卵清蛋白乳化性能隨時間及溫度的變化Fig.6 Effect of subcritical water on the emulsifying activity and emulsion stability of OVA at different time points and temperatures
蛋白質(zhì)的乳化性能是指將油水混合在一起的能力。影響乳化性能的因素有蛋白濃度、pH值、溫度、鹽類、糖類或其他介質(zhì)等[25]。由圖6A可知,經(jīng)亞臨界水處理后,卵清蛋白的乳化性顯著提高(P<0.05),且隨著處理時間與處理溫度的增加而趨于不變,其中160 ℃處理15 min的乳化性最高,比未處理的提高了1.5 倍;由圖6B可知,低溫(<140 ℃)短時間亞臨界水處理對卵清蛋白的乳化穩(wěn)定性影響不大,高溫(≥140 ℃)長時間處理能提高卵清蛋白的乳化穩(wěn)定性,經(jīng)160 ℃亞臨界水處理60 min后,乳化穩(wěn)定性變?yōu)樵亚宓鞍椎?.2 倍(P<0.05)。可能原因是:高溫高壓作用使蛋白質(zhì)結(jié)構(gòu)松散,極性基團(tuán)的水合作用增強(qiáng),親水性提高;同時,包含在分子內(nèi)部的疏水基團(tuán)暴露,親油性亦增強(qiáng),兩者達(dá)到較好的平衡時,表現(xiàn)為乳化性的明顯提高。隨著處理時間的增加,持續(xù)的高溫高壓使得卵清蛋白分子進(jìn)一步展開,極化的卵清蛋白分子之間相互吸引,通過非共價鍵相互作用力重新形成分子聚集體,表面疏水性降低,蛋白質(zhì)的表面積也減小,故乳化性的增加趨于不變。
3 結(jié) 論
亞臨界水能降低卵清蛋白的粒徑、自由巰基含量、運(yùn)動黏度;并顯著提高卵清蛋白的表面疏水性,但隨著反應(yīng)溫度的升高和處理時間的延長,表面疏水性降低;經(jīng)亞臨界水處理后,卵清蛋白的起泡性、起泡穩(wěn)定性顯著提高,其中140 ℃處理0 min的起泡性最高,比未處理的提高了2.7 倍,160 ℃處理0 min及140 ℃處理0 min的起泡穩(wěn)定性最高,比未處理的提高了2.3 倍,隨著處理時間的延長,起泡性、起泡穩(wěn)定性明顯降低;同時,處理后的卵清蛋白乳化性明顯提高,并隨處理時間與溫度的增加而趨于不變,其中160 ℃處理15 min的乳化性最高,比未處理的提高了1.5 倍;低溫(<140 ℃)短時間亞臨界水處理對卵清蛋白的乳化穩(wěn)定性影響不大,高溫(≥140 ℃)長時間處理能提高卵清蛋白的乳化穩(wěn)定性,在160 ℃亞臨界水處理60 min后,乳化穩(wěn)定性變?yōu)樵亚宓鞍椎?.2 倍。為研制高起泡性及乳化性的卵清蛋白或蛋清蛋白提供一種研究思路。
[1] 豆玉新. 動態(tài)超高壓微射流均質(zhì)對卵清蛋白改性機(jī)理的研究[D]. 南昌: 南昌大學(xué), 2009: 41-42.
[2] MANZOCCO L, PANOZZO A, NICOLI M C. Effect of ultraviolet processing on selected properties of egg white[J]. Food Chemistry,2012, 135(2): 522-527.
[3] ARZENI C, PEREZ O E, PILOSOF A M R. Functionality of egg white proteins as affected by high intensity ultrasound[J]. Food Hydrocolloids, 2012, 29(2): 308-316.
[4] 涂宗財(cái), 胡月明, 王輝, 等. 超聲波對蛋清蛋白-果糖美拉德反應(yīng)體系的影響[J]. 食品工業(yè)科技, 2013, 34(3): 61-64.
[5] HATTA H, KITABATAKE N, DOI E. Turbidity and hardness of a heat-induced gel of hen egg ovalbumin (food & nutrition)[J]. Agricultural and Biological Chemistry, 1986, 50(8): 2083-2089.
[6] TOOR S S, ROSENDAHL L, RUDOLF A. Hydrothermal liquefaction of biomass: a review of subcritical water technologies[J]. Energy,2011, 36(5): 2328-2342.
[7] DEMIRBAS A. Mechanisms of liquefaction and pyrolysis reactions of biomass[J]. Energy Conversion and Management, 2000, 41(6): 633-646.
[8] PETERSON A A, VOGEL F, LACHANCE R P, et al. Thermochemical biofuel production in hydrothermal media: a review of sub-and supercritical water technologies[J]. Energy & Environmental Science, 2008, 11: 32-65.
[9] ZHU Xian, ZHU Chao, ZHAO Liang, et al. Amino acids production from fish proteins hydrolysis in subcritical water[J]. Chinese Journal of Chemical Engineering, 2008, 16(3): 456-460.
[10] ZHU Guangyong, ZHU Xian, FAN Qi, et al. Kinetics of amino acid production from bean dregs by hydrolysis in sub-critical water[J]. Amino Acids, 2011, 40(4): 1107-1113.
[11] ZHU Guangyong, ZHU Xian, FAN Qi, et al. Recovery of biomass wastes by hydrolysis in sub-critical water[J]. Resources, Conservation and Recycling, 2011, 55(4): 409-416.
[12] SUNPHORKA S, CHAVASIRI W, OSHIMA Y, et al. Kinetic studies on rice bran protein hydrolysis in subcritical water[J]. The Journal of Supercritical Fluids, 2012, 65: 54-60.
[13] ENOMOTO H, ISHIMARU T, LI C P, et al. Phosphorylation of ovalbumin by dry-heating in the presence of pyrophosphate: effect of carbohydrate chain on the phosphorylation level and heat stability[J]. Food Chemistry, 2010, 122(3): 526-532.
[14] ESPINOZA A D, MORAWICKI R O. Effect of additives on subcritical water hydrolysis of whey protein isolate[J]. Journal of Agricultural and Food Chemistry, 2012, 60(20): 5250-5256.
[15] HE Rong, HE Haiyan, CHAO Dongfang, et al. Effects of high pressure and heat treatments on physicochemical and gelation properties of rapeseed protein isolate[J]. Food and Bioprocess Technology, 2014,7(5): 1344-1353.
[16] 李迎秋. 脈沖電場對大豆蛋白理化性質(zhì)和脂肪氧化酶的影響[D]. 無錫: 江南大學(xué), 2007: 55-57.
[17] 李紅, 原雯, 鄭煥云. 烏氏粘度計(jì)校準(zhǔn)中的不確定度來源及影響因素控制[J]. 工業(yè)計(jì)量, 2012, 22(增刊1): 178-179.
[18] GB/T 5516—2011 糧油檢驗(yàn) 糧食運(yùn)動粘度測定 毛細(xì)管粘度計(jì)法[S].
[19] HUANG Xiaoqin, TU Zongcai, WANG Hui, et al. Increase of ovalbumin glycation by the maillard reaction after disruption of the disulfide bridge evaluated by liquid chromatography and high resolution mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2013, 61(9): 2253-2262.
[20] OGUNWOLU S O, HENSHAW F O, MOCK H P, et al. Functional properties of protein concentrates and isolates produced from cashew (Anacardium occidentale L.) nut[J]. Food Chemistry, 2009, 115(3): 852-858.
[21] IAMETTI S, DONNIZZELLI E, VECCHIO G, et al. Macroscopic and structural consequences of high-pressure treatment of ovalbumin solutions[J]. Journal of Agricultural and Food Chemistry, 1998, 46(9): 3521-3527.
[22] 黃小波, 馬美湖, 李文革. 輻照殺菌對雞蛋蛋白液特性的影響[J]. 農(nóng)業(yè)工程學(xué)報, 2009, 25(5): 244-248.
[23] PLANCKEN I V D, ANN V L, HENDRICKX M E. Foaming properties of egg white proteins affected by heat or high pressure treatment[J]. Journal of Food Engineering, 2007, 78(4): 1410-1426.
[24] 涂宗財(cái), 豆玉新, 劉成梅, 等. 動態(tài)超高壓均質(zhì)對蛋清蛋白溶液的起泡性、成膜性的影響[J]. 食品工業(yè)科技, 2008, 29(6): 77-78.
[25] PEARCE K N, KINSELLA J E. Emulsifying properties of proteins: evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry, 1978, 26(3): 716-723.
Effect of Subcritical Water on Structure, Foamability and Emulsibility of Ovalbumin
TU Zongcai1,2, NIU Peipei1, WANG Hui1, SHI Yan1, HUANG Xiaoqin2, LI Ruiping1, CHANG Haixia1, BAO Zhongyu1
(1. Engineering Research Center for Biomass Conversion, Ministry of Education, State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China; 2. College of Life Science, Jiangxi Normal University, Nanchang 330022, China)
Ovalbumin was treated with subcritical water at temperatures for different durations, and the effect of subcritical water on particle size, free sulfhydryls, surface hydrophobicity, kinematic viscosity, foamablility and emulsibility was investigated. The results showed that subcritical water significantly reduced particle size, free sulfhydryl content and kinematic viscosity of ovalbumin. Moreover, it also enhanced surface hydrophobicity. The foamabilty increased significantly,as the temperature of subcritical water increased to 140 ℃. The highest level foamability was observed immediately when the temperature reached 140 ℃, implying a 3.7-fold increase over that of the untreated one, while with the extension of treatment time, the foamability decreased. After subcritical water treatment, the emulsibility was improved, and the highest emulsibility was attained at 160 ℃ for 15 min, representing a 2.5-fold rise compared with the unprocessed sample.
subcritical water; ovalbumin; foamablility; emulsibility
TQ93
A
1002-6630(2015)09-0039-05
10.7506/spkx1002-6630-201509008
2014-06-30
江西省重大科技創(chuàng)新研究項(xiàng)目(20124ACB00600);江西省現(xiàn)代農(nóng)業(yè)產(chǎn)業(yè)技術(shù)體系建設(shè)專項(xiàng)(JXARS-02)
涂宗財(cái)(1965—),男,教授,博士,研究方向?yàn)槭澄镔Y源開發(fā)與高效利用。E-mail:tuzc_mail@aliyun.com

