葡萄果實花色苷合成調控研究進展
牛生洋,武凌峰,趙瑞香,劉崇懷,王 華
(1.河南科技學院食品學院,河南 新鄉 453003;2.中國農業科學院鄭州果樹研究所,河南 鄭州 450009;3.西北農林科技大學葡萄酒學院,陜西 楊凌 712100)
葡萄果實花色苷合成調控研究進展
牛生洋1,2,3,武凌峰1,趙瑞香1,劉崇懷2,*,王 華3
(1.河南科技學院食品學院,河南 新鄉 453003;2.中國農業科學院鄭州果樹研究所,河南 鄭州 450009;3.西北農林科技大學葡萄酒學院,陜西 楊凌 712100)
果皮顏色是葡萄果實重要的商品品質之一,也是決定葡萄酒質量的關鍵因素,尤其是紅葡萄酒。因此,果皮顏色一直是葡萄品種選育的重要目標性狀。葡萄果皮顏色主要取決于花色苷的組成與含量,花色苷積累與尿苷二磷酸葡萄糖-類黃酮葡萄糖基轉移酶(UDP-glucose 3-O-?avonoid glucosyltransferase,UFGT)基因表達呈顯著正相關,而基因表達主要受MYB(v-myb avian myeloblastosis viral oncogene homolog)轉錄因子的調節。本文從MYB轉錄因子調節花色苷合成的分子機理及研究現狀進行評述,并對該領域研究發展方向做簡要分析。
葡萄;果皮顏色;花色苷;MYB轉錄因子
花色苷是一類廣泛存在于植物中的水溶性天然色素,屬黃酮類化合物,具有極強的抗氧化能力和清除自由基的作用,并能預防心血管疾病,因此,花色苷目前被廣泛用于食品、醫藥、化妝品等各個行業[1]。
葡萄酒由于含有豐富的花色苷而受到了人們越來越多的關注,而葡萄酒中的花色苷主要來自于其釀造原料——葡萄。葡萄漿果中花色苷的組成比例及含量不僅決定著葡萄果實的顏色,同時對葡萄酒的質量也有非常重要的影響[2-3]。
1 葡萄果實花色苷合成的基本途徑
花色苷的合成主要在植物次生代謝途徑之一的苯丙烷類代謝中完成。該途徑起始于苯丙氨酸,經過幾個共同步驟后,分成兩個主要分支,其中一條分支稱為黃酮類代謝途徑,主要與植物色素合成相關[4]。隨著對模式植物花色苷代謝途徑的研究,人們對葡萄花色苷代謝途徑的認識不斷深入,葡萄果實中花色苷的生物合成途徑已經形成了比較清晰的輪廓(圖1)[5-6]。
人們對葡萄花色苷的認識是隨著葡萄果皮顏色形成機理的不斷深入而發展的。最初人們認為,葡萄果皮顏色由兩對基因控制,決定黑色果皮的基因相對于決定白色和紅色果皮的基因是顯性的,決定紅色果皮的基因相對于決定白色果皮的基因是顯性的[7]。而對于白色果實的解釋,則認為是由有色果實葡萄發生基因突變影響花色苷合成而產生的[8]。隨著花色苷在其他植物中合成途徑的逐漸揭示,有學者對葡萄花色苷合成途徑中的相關基因進行了系統研究。在對葡萄漿果發育過程中與花色苷合成相關的基因(圖1)進行表達分析后,發現只有尿苷二磷酸葡萄糖-類黃酮葡萄糖基轉移酶(UDP-glucose 3-O-?avonoid glucosyltransferase,UFGT)基因在葡萄漿果轉色后表達,而且在白葡萄中表達水平比在有色葡萄中低很多[9],由此確定了UFGT是決定葡萄漿果顏色的關鍵基因。然而對這些白色葡萄和有色葡萄中的UFGT基因序列分析后卻沒有發現明顯的區別[10],這就很難解釋為什么白色葡萄有花色苷合成的關鍵基因,卻沒有顏色表現。
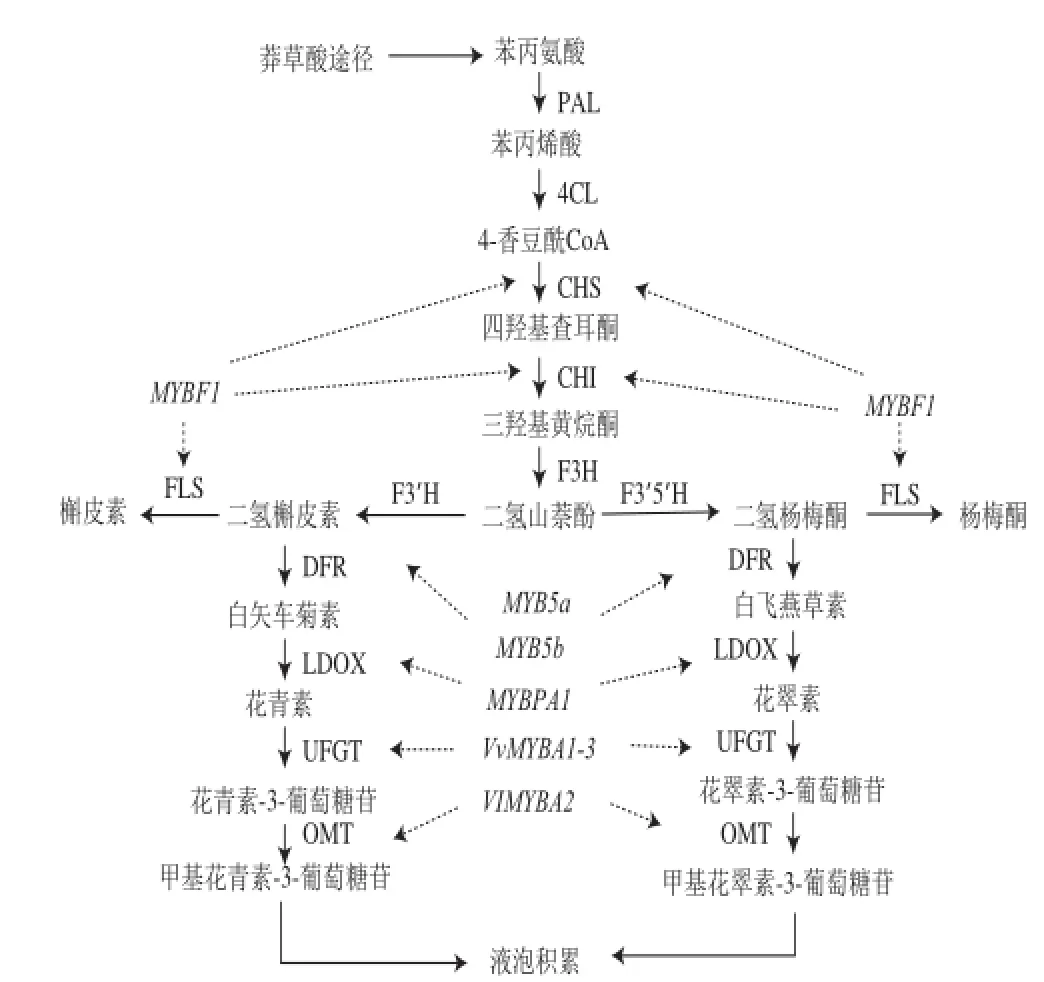
圖1 葡萄中花色苷生物合成途徑及MYB相關轉錄因子基因作用位點Fig.1 Anthocyanin biosynthesis pathway and model of the genetic regulation by MYB TFs
隨著研究的深入,越來越多的參與花色苷生物合成的基因被鑒定,人們發現花色苷的生物合成需要兩類基因的參與,一類是結構基因,編碼直接參與花色苷合成與積累的酶;另一類是調節基因,調控結構基因的時空表達[11-12]。Kobayashi等[10]利用Northern blotting技術對葡萄UFGT基因的轉錄調控做了一系列深入研究,克隆出了8 個MYB(v-myb avian myeloblastosis viral oncogene homolog)相關基因,并證實其中MYBA基因與UFGT的表達密切相關;后續研究表明,在很多歐亞種(Vitis vinifera L.)葡萄中都發現了能夠調節UFGT的表達從而參與歐亞種葡萄花色苷生物合成的VvmybA1基因,而且VvmybA1在白色歐亞種葡萄品種的果皮中不表達,在所有有色葡萄品種的果皮中表達,對其克隆分析后發現,白色葡萄是由于VvmybA1的DNA序列中插入了一個逆轉座子Gret1導致了VvmybA1的失活,使白色歐亞種葡萄品種的花色苷生物合成基因UFGT的轉錄受到抑制,無法合成花色苷,從而呈現白色[13]。這一結果發表在2004年的Science雜志上,是葡萄分子生物學研究領域的重大突破之一。
后來,Lijavetzky[14]及Azuma[15-16]等通過對收集到的百余份歐亞種及歐美雜交種葡萄的MYB基因型進行分析,更加證明了VvmybA1的基因型是決定葡萄果皮顏色的關鍵因素。至此,研究葡萄果實顏色形成機理的焦點主要集中在了MYB轉錄因子基因的調控方面,而這種調控作用主要圍繞著其對花色苷合成途徑中的調控作用而展開。
2 轉錄因子對葡萄花色苷合成的調控
2.1 MYB轉錄因子結構特點
在目前發現的轉錄因子家族中,MYB是分布范圍最廣的一類。MYB最早是在動物中發現的,在禽成髓細胞瘤病毒(avian myeloblastosis virus)中鑒定出一個能直接導致急性成髓細胞白血病(acute myeloblastic leukemia)的癌基因,稱為v-Myb[17]。第一個從植物中發現的MYB轉錄因子是玉米的Clorlessl(cl)基因所編碼的蛋白,其參與了類黃酮的代謝調控[18]。之后在矮牽牛、擬南芥、金魚草、蘋果、葡萄、草莓等植物中都有MYB轉錄因子參與類黃酮代謝調控的報道[19-20]。在擬南芥中已發現超過198 個MYB家族基因,棉花中發現有200 個MYB轉錄因子,葡萄中約有108 個,玉米中有100多個,在其他高等植物中也有相應的或更多數量的R2R3-MYB轉錄因子[5]。根據所含MYB結構域的數量,植物中MYB轉錄因子可分為三類:單一MYB結構域蛋白(single-MYB)、2 個串聯MYB結構域蛋白(R2R3-MYB)和3 個串聯MYB結構域蛋白(R1R2R3-MYB),植物中絕大多數MYB轉錄因子均屬于R2R3-MYB類[5,21-23]。
MYB蛋白的N端有序列特異性結合的DNA區域,每個結構域含有50~53 個氨基酸殘基,形成螺旋-轉角-螺旋(helix-turn-helix,HTH)的構型,插入到目標DNA大溝中,MYB結構域中每隔18~19 個氨基酸有3 個保守的色氨酸殘基,是疏水核心的重要成分,維持著HTH構型;MYB轉錄因子的N端結構域序列是非常保守的,而C端的轉錄激活域蛋白序列卻極其不保守(圖2)[24],這使得MYB蛋白雖然在序列上有一定的相似性,但在不同物種,或者同一物種的不同個體,甚至同一個體的不同組織器官中的功能都會存在較大的差異。
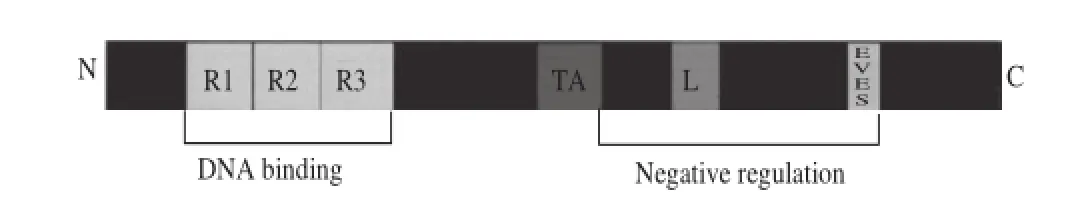
圖2 c-MYB結構示意圖[24]Fig.2 Functional domain map of c-MYB transcription factor structure[24]
2.2 VvmybA1基因型與葡萄花色苷合成
Yakushiji等[25]發現,歐亞種品種“黑比諾”(Pinot Noir)的VvmybA1基因型是VvmybA1a/VvmybA1c,由于缺失了具有功能的VvmybA1c基因,“黑比諾”突變成了白色品種“白比諾”(Pinot Blanc)。而有的白色葡萄品種VvmybA1基因序列的intra-LTR重組變成了solo-LTR,從而發生變異,產生有色品種[14,26]。
有關葡萄MYB轉錄因子基因VvmybA1的基因型,目前報道過的VvmybA1等位基因有VvmybA1a、VvmybA1b、VvmybA1c、VlmybA1-3以及VvmybA1BEN等類型[16,27]。通過對歐亞種、美洲種群和東亞種群不同顏色葡萄的研究發現,有色品種都存在一條或者兩條功能性的VvmybA1等位基因,而白色品種主要表現為VvmybA1a的純合基因型,即啟動子區域存在Gret1的插入,而且插入的位點基本一致;同時還發現,VvmybA1a基因型只存在于歐亞種及其種間雜交種葡萄中[28-29]。
但是,有研究發現,非VvmybA1a的純合基因型也有可能產生白色果實[30-31];而且,在原產于中國的野生種刺葡萄(Vitis davidii)中發現了白色株系,對其基因型分析后發現為VvmybA1a的純合型[32],這些現象雖然不符合已有理論,卻為葡萄轉錄因子VvmybA1基因的研究增加了新的研究素材,為完整準確地揭示形成葡萄果皮顏色的機理提供了新的研究內容。
2.3 MYB轉錄因子基因多態性與花色苷合成
越來越多的 研究表明,VvmybA1基因型是葡萄果皮顏色多樣性的主要因素,但卻不是唯一因素。Kobayashi等[10]在發現VvmybA1基因型時,就從“巨峰”葡萄的cDNA文庫中分離鑒定出了一個MYB相關基因VlmybA1-1。該基因和VvmybA1功能相似,能夠通過調節UFGT的表達從而參與歐美雜種葡萄(Vitis labruscana)花色苷生物合 成的調控,但目前它還沒有被定位到染色體上。后來,Walker等[33]在歐亞種品種“赤霞珠”中發現了和VvmybA1功能相似的VvmybA2基因,兩者均位于同一染色體。進一步研究發現,含有VvmybA2基因的白色品種是由于其編碼區發生了單核苷酸突變產生了VvmybA2w,導致R2R3結構域的一個α-螺旋的改變,從而使VvmybA2w喪失功能,無法調節UFGT的表達[25]。
盡管關于VvmybA1的突變造成葡萄果皮顏色發生變化的現象只是少數幾個品種研究的結果,并不能說明所有葡萄果實著色的機理 都如此,但這也恰好說明,白色葡萄的產生或許不僅僅只是由于VvmybA1基因突變的結果,可能還有由幾個不同調控基因的突變所引起。因此,人們還需要對更多的品種做進一步的研究,來明確葡萄果皮顏色的分子遺傳基礎。
2.4 MYB調控方式與花色苷形成
MYB相關基因對葡萄花色苷物合成的調控起到至關重要的作用,在不同品種群與品種中表現出多種模式。Fournier-Level等[34]證明,位于2號染色體上的由3 個MYB相關基因組成的基因簇是決定歐亞種葡萄果皮顏色的基因位點,其中VvmybA1和VvmybA2對花色苷的合成具有調節功能,如果兩個基因中只有一個發生突變并喪失功能,另一個會繼續調控花色苷的合成;VvmybA3的表達與花色苷的合成在統計分析上具有相關性,但其功能尚不清楚。在對這些基因進行瞬時表達后發現也只有ybA1-1、mybA1-2和mybA2能夠在葡萄體細胞胚中誘導出紫紅色斑點。
Kobayashi等[10]從“巨峰”葡萄中除了分離得到mybA外,還發現了一系列定位于葡萄第二條染色體上的MYB相關基因mybB、mybC、mybD、mybE、mybF、mybG及mybH等。進一步研究發現,mybA、mybB和mybC主要在果實著色時表達,mybD主要在果實發育前期表達;而對mybE至mybH尚無法確定 其準確表達時間;其他相關基因的作用位點見圖1。
由于葡萄屬于多年生植物,其遺傳背景復雜,與MYB轉錄因子的調控主要集中在果實顏色的相關基因,而葡萄果實顏色形成的一系列生化反應主要在次生代謝途徑中完成,這使得相關基因功能驗證異常艱難。盡管經過多年努力,關于MYB轉錄因子的相關功能驗證仍然是在模式植物擬南芥、煙草及番茄中完成,但是尚未找到有效的轉化體系直接在葡萄中進行驗證。
3 MYB轉錄因子與其他物質的協同作用
3.1 MYB轉錄因子對花色苷合成途徑中其他物質的調控
自葡萄基因組測序完成后,人們逐漸發現,不同葡萄品種果實著色機理也許并非一種簡單模式,或許是由多個基因組合、多種作用方式共同作用的結果[35]。從“赤霞珠”的cDNA文庫中分離出來的兩個MYB相關基因Vvmyb5a和Vvmyb5b,分別編碼由320 個和311 個氨基酸殘基組成的R2R3-MYB蛋白,Vvmyb5a主要在果實的發育早期表達,在果實成熟過程中為表達下調,VvmybA5b主要在果實成熟過程中表達,在果實發育前期表達量很低,在轉色期以后表達量最高。Vvmyb5a和Vvmyb5b都能促進ANS(anthocyanidin synthase)、CHI(chalcone isomerase)、F3’5’H(flavonoid 3’,5’-hydroxylase)、LAR(leucoanthocyanidin reductase)的表達,Vvmyb5b還能促進ANR(anthocyanidin reductase)的表達,但它們都不能促進UFGT的表達[36-38]。
此外,Azuma等[26]發現,F3’H和F3’5’H的表達水平決定花青素/花翠素和花色苷的比率,從而影響了葡萄果皮的顏色,而UFGT、OMT(O-methyltransferase)、GST(glutathione S-transferase)基因的表達量也對花色苷的含量具有明顯的促進作用。
3.2 MYB轉錄因子與環境因素的協同作用對花色苷合成的影響
葡萄花色苷含量的多少不僅受到基因型的影響,還受外界環境條件,如光照、溫度、含糖量和激素水平等的影響,正是由于這些因素對花色苷合成的共同作用,使葡萄花色苷在合成過程中表現出了一定的數量性狀特點[10]。Jeong等[4]在“赤霞珠”開始轉色時控制光照為正常水平的18%~20%,發現果實果皮花色苷水平有所降低,這主要表現在花色苷結構基因和VvmybA1的表達量降低。而有人在對歐亞種葡萄品種“Aki Queen”和“赤霞珠”等做了類似研究后發現,花色苷結構基因和Vvmyb A1的表達與溫度并沒有直接關系,之所以葡萄中花色苷的含量有所變化,主要是因為抑制作用或者是底物的缺失,而非MYB轉錄作用的影響[39-40]。Azuma等[6]研究了不同溫度和光照處理下MYB相關基因的表達,測定了不同處理下花色苷各組分的變化,并對花色苷合成一系列酶的基因表達都做了定量分析,結果發現,較低的溫度(15 ℃)和光照對花色苷合成的積累有明顯的促進作用,而較高的溫度(35 ℃)和黑暗明顯抑制花色苷的合成酶基因表達,并指出,環境因素協同效應也許是影響花色苷合成的新的作用方式。
4 結 語
近年來,MYB轉錄因子與花色苷生物合成之間的關系受到了 廣泛關注,并且在整個花色苷生物合成途徑中,轉錄因子的調節功能也逐漸被揭示,不斷有新的MYB轉錄因子調節基因被鑒定,這些都為葡萄果實顏色形成的分子機制提供了有力的依據。但是,花色苷的生物合成來自于植物非常復雜的次生代謝途徑,要想徹底揭開其真實面目,還需要解決許多相關問題,比如:1)MYB轉錄因子與所調節的結構基因的結合方式、結合位點及順式作用元件等;2)MYB蛋白與其靶標DNA作用方式是獨立的,還是與其他轉錄因子如bHLH(basic helix-loop-helix)、WD40和WRKY等共同或者相互作用的;3)轉錄因子的作用是否會受到溫度和光照等環境因素的影響等。此外,人們發現,雖然調節基因和結構基因的差異都會影響果實顏色的變化,但是孤立研究某單個基因及其表達并不能完全準確地反映其內在規律,而且轉錄因子家族內部成員在結構和功能上具有一定的相關性,只有借助現代功能基因組學及蛋白質組學分析,如特殊物種的全基因組測序、特定表達時期的轉錄組測序等,才有可能將花色苷合成相關基因的生物學功能逐一揭示,最終闡明果實顏色形成的詳細途徑。
目前,關于環境因素對轉錄因子影響葡萄花色苷合成調控的研究已經有相關的文獻報道,但是這些研究還處于零星分散狀態,所得結論也不能互相印證,因此,有關環境因素和MYB轉錄因子協同對葡萄花色苷合成的作用將是今后研究的重點領域。
[1] FRITZ J, KERN M, PAHLKE G, et al. Biological activities of malvidin, a red wine anthocyanidin[J]. Molecular Nutrition & Food Research, 2006, 50: 390-395.
[2] CHAPPLE C C S, SHIRLEY B W, ZOOK M, et al. Secondary metabolism in Arabidopsis[M]//MEYEROWITZ E M, SOMERVILLE C R. Arabidopsis. New York: Cold Spring Harbor Laboratory Press,1994: 989-1030.
[3] CASTELLARIN S D, GASPERO G D, MACCONI R, et al. Colour variation in red grapevines (Vitis vinifera L.): genomic organization,expression of flavonoid 3’-hydroxylase, flavonoid 3’,5’-hydroxylase genes and related metabolite profiling of red cyaniding-blue delphinidin-based anthocyanins in berry skin[J]. BMC Genomics,2006, 7: 1-17.
[4] JEONG S T, GOTO-YAMAOTO N, HASHIZUME K, et al. Expression of the flavonoid 3’-hydroxylase and flavonoid 3’,5’-hydroxlase genes and flavonoid composition in grapes and flavonoid composition in grape (Vitis vinifera L.)[J]. Plant Science, 2006, 170: 61-69.
[5] CZEMMEL S, HEPPEL S C, BOGS J. R2R3 MYB transcription factors: key regulators of the flavonoid biosynthetic pathway in grapevine[J]. Protoplasma, 2012, 249: 109-118.
[6] AZUMA A, YAKUSHIJI H, KOSHITA Y, et al. Flavonoid biosynthesis-related genes in grape skin are differentially regulated by temperature and light conditions[J]. Planta, 2012, 236: 1067-1080.
[7] BARRITT B H, EINSET J. The inheritanace of three major fruit colors in grapes[J]. Journal of The American Society for Horticultural Science, 1969, 94: 87-89.
[8] SLINKARD K, SINGLETON V L. Total phenol analyses: automation and comparison with manual methods[J]. American Journal of Enology and Viticulture, 1977, 28: 49-55.
[9] BOSS P K, DAVIES C, ROBINSON S P. Analysis of the expression of anthocyanin pathway genes in developing Vitis vinifera L. cv Shiraz grape berries and the implications for pathway regulation[J]. Plant Physiology, 1996, 111: 1059-1066.
[10] KOBAYASHI S, ISHIMARU M, HIRAOKA K, et al. MYB-related genes of the Kyoho grape (Vitis labruscana) regulate anthocyanin biosynthesis[J]. Planta, 2002, 215: 924-933.
[11] HOLTON T A, CORNISH E C. Genetics and biochemisty of anthocyanin biosynthesis[J]. Plant Cell, 1995, 7: 1071-1083.
[12] AGEORGES A, FERNANDEZ L, VIALET S, et al. Four specific isogenes of the anthocyanin metabolic pathway are systematically coexpressed with the red colour of grape berries[J]. Plant Science, 2006,170: 372-383.
[13] KOBAYASHI S, GOTO-YAMAMOTO N, HIROCHIKA H. Retrotransposon-induced mutations in grape skin color[J]. Science,2004, 304: 982.
[14] LIJAVETZKY D, RUIZ-GARCIA L, CABEZAS J A, et al. Molecular genetics of berry colour variation in table grape[J]. Molecular Genetics and Genomics, 2006, 276: 427-435.
[15] AZUMA A, KOBAYASHI S, YAKUSHIJI H, et al. VvmybA1 genotype determines grape skin color[J]. Vitis, 2007, 46(3): 154-155.
[16] AZUMA A, UDO Y, SATO A, et al. Haplotype composition at the color locus is a major genetic determinant of skin color variation in Vitis × labruscana grapes[J]. Theoretical and Applied Genetics, 2011,122: 1427-1438.
[17] KLEMPNAUER K H, GONDA T J, BISHOP J M. Nucleotide sequence of the retroviral leukemia gene v-myb and its cellular progenitor c-myb: the architecture of a transduced oncogene[J]. Cell,1982, 31: 453-463.
[18] PAZ-ARES J, GHOSAL D, WIENAND U, et al. The regulatory cl locus of Zea mays encodes a protein with homology to myb protooncogene products and with structural similarities to transcriptional activators[J]. The EMBO Journal, 1987, 6: 3553-3558.
[19] WINKEL-SHIRLEY B. Flavonoid biosynthesis. A colorful model for genetics, biochemistry, cell biology, and biotechnology[J]. Plant Physiology, 2001, 126: 485-493.
[20] LEPINIEC L, DEBEAUJON I, ROUTABOUL J M, et al. Genetics and biochemistry of seed flavonoids[J]. Annual Review of Plant Biology, 2006, 57: 405-430.
[21] MARTIN C, PAZ-ARES J. MYB transcription factors in plants[J]. Trends in Genetics, 1997, 13: 67-73.
[22] JIN H, MARTIN C. Multifunctionality and diversity within the plant MYB-gene family[J]. Plant Molecular Biology, 1999, 41: 577-585.
[23] HUANG Y F, VIALET S, GUIRAUD J L, et al. A negative MYB regulator of proanthocyanidin accumulation, identifide through expression quantitative locus mapping in the grape berry[J]. New Phytologist, 2014, 201: 795-809.
[24] OGATA K, HOJO H, AIMOTO S, et al. Solution structure of a DNA-binding unit of Myb: a helix-tum-helix-related motif with conserved tryptophans forming a hydrophobic core[J]. Proceedings of the National Academy of Sciences USA, 1992, 89: 6428-6432.
[25] YAKUSHIJI H, KOBAYASHI S, GOTO-YAMAMOTO N, et al. A skin color mutation of grapevine, from black-skinned ‘Pinot Noir’ to white-skinned ‘Pinot Blanc’ is caused by the deletion of the functional VvmybA1 allele[J]. Bioscience, Biotechnolgy, and Biochemistry, 2006,70: 1506-1508.
[26] AZUMA A, KOYBAYASHI S, GOTO-YAMAMOTO N, et al. Color recovery in berries of grape (Vitis Vinifera L.) ‘Benitaka’, a bud sport of ‘Italia’, is cause by a novel allel at the VvmybA1 locus[J]. Plant Science, 2009, 176: 470-478.
[27] AZUMA A, KOBAYASHI N, MITANI N, et al. Genomic and genetic analysis of Myb-related genes that regulate anthoyanin biosynthesis in grape berry skin[J]. Theoretical and Applied Genetics, 2008, 117: 1009-1019.
[28] CADLE-DAVIDSON M, OWENS C. Genomic amplification of the Gret1 retroelement in white-fruited accessions of wild Vitis and interspecific hybrids[J]. Theoretical and Applied Genetics, 2008, 116: 1079-1094.
[29] MITANI N, AZUMA A, FUKAI E, et al. A retrotransposon-inserted VvmybA1a allele has been spread among cultivars of Vitis vinifera but not North American or East Asian Vitis species[J]. Vitis, 2009, 48(1): 55-56.
[30] THIS P, LACOMBE T, CADLE-DAVIDSON M, et al. Wine grape (Vitis vinifera L.) color associates with allelic variation in the domestication gene VvmybA1[J]. Theoretical and Applied Genetics,2007, 114: 723-730.
[31] 慕茜, 吳為民, 房經貴, 等. 不同葡萄品種的VvmybA1基因型及其特征性DNA片段的序列分析[J]. 園藝學報, 2011, 38(11): 2075-2084.
[32] 焦健, 劉崇懷, 樊秀彩, 等. 中國野生種葡萄及種間雜種VvmybA1基因型和表達分析[J]. 中國農業科學, 2013, 46(12): 2514-2525.
[33] WALKER A R, LEE E, BOGS J, et al. White grapes arose through the mutation of two similar and adjacent regulatory genes[J]. Plant Journal, 2007, 49: 772-785.
[34] FOURNIER-LEVEL A, LE C L, GOMEZ C, et al. Quantitative genetic bases of anthocyanin variation in grape (Vitis vinifera L. ssp. sativa) berry: a quantitative trait locus to quantitative trait nucleotide integrated study[J]. Genetics, 2009, 183: 1127-1139.
[35] JAILLON O, AURY J M, NOEL B. The grapevine genome sequence suggests ancestral hexaploidization in major angiosperm phyla[J]. Nature, 2007, 449: 463-467.
[36] DELUC L, BARRIEU F, MARCHIVE C, et al. Characterization of a grapevine R2R3-MYB transcription factor that regulates the phenylpropanoid pathway[J]. Plant Physiology, 2006, 140: 499-511.
[37] DELUC L, BOGS J, WALKER A R, et al. The transcription factor VvMYB5b contributes to the regulation of anthocyanin and proanthocyanidin biosynthesis in developing grape berries[J]. Plant Physiology, 2008, 147: 2041-2053.
[38] CASTELLARIN S D, MATTHEWS M A, GASPERO G D, et al. Water deficits accelerate ripening and induce changes in gene expression regulation flavonoid biosynthesis in grape berries[J]. Planta, 2007,277: 101-112.
[39] YAMANE T, JEONG S T, GOTO-YAMAMOTO N, et al. Effects of temperature on anthocyanin biosynthesis in grape berry skins[J]. American Journal of Enology and Viticulture, 2006, 57: 54-59.
[40] MORI K, GOTO-YAMAOTO N, KITAYAMA M, et al. Loss of anthocyanins in red wine grape under high temperature[J]. Journal of Experimental Botany, 2007, 58: 1935-1945.
Progress in Regulation of Anthocyanin Biosynthesis in Grape Berries
NIU Shengyang1,2,3, WU Lingfeng1, ZHAO Ruixiang1, LIU Chonghuai2,*, WANG Hua3
(1. College of Food Science, Henan Institute of Science and Technology, Xinxiang 453003, China; 2. Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences, Zhengzhou 450009, China; 3. College of Enology, Northwest A&F University, Yangling 712100, China)
Grape berry skin is an important factor that affects commercial quality of grape and wine, especially for red wine. Due to the versatility of functions, the skin color is one of the key traits in grape breeding. The skin color of grapes is mainly determined by the content and composition of anthocyanins. Recent research showed that the expression of the genes encoding UDP glucose and flavonoid 3-O-glucosyltransferase (U FGT) is critical for anthocyanin biosynthesis in grapes. Anthocyanin biosynthesis is controlled by MYB transcription factors, which activate the structural genes in the flavonoid pathway. This review summarizes recent progress in the study of plant MYB transcription factors on grape anthocyanin biosynthesis. Meanwhile, future research directions in this field are also discussed.
grape berries; berry sk in color; anthocyanin; MYB transcription factors
S663.1
A
1002-6630(2015)09-0219-05
10.7506/spkx1002-6630-201509041
2014-04-09
國家自然科學基金面上項目( 31372024);國家級大學生創新創業訓練計劃項目(201310467061);河南省教育廳科學技術研究重點項目(14A550015)
牛生洋(1976—),男,博士研究生,研究方向為葡萄與葡萄酒學。E-mail:niushengyang@163.com
*通信作者:劉崇懷(1965—),男,研究員,博士,研究方向為葡萄種質資源學。E-mail:liuchonghuai@caas.cn

