運動對糖尿病誘導的大鼠海馬氧化應激的影響
李靖
(巢湖學院體育學院,安徽 巢湖 238000)
運動對糖尿病誘導的大鼠海馬氧化應激的影響
李靖
(巢湖學院體育學院,安徽 巢湖 238000)
背景:氧化應激形成誘導多細胞通路的基礎,其能導致糖尿病并發癥,最能導致身體虛弱的疾病——是神經系統疾病。研究的目的是評價跑臺運動是否能減輕鏈脲霉素誘導的糖尿病大鼠海馬氧化應激和細胞凋亡率。方法:40只雄性Wistar大鼠隨機分為4組,每組10只,即對照組、運動組、糖尿病組和糖尿病運動組,通過給大鼠注射鏈脲霉素誘導糖尿病模型。所有運動組大鼠在動物電動跑臺上進行8周運動,在8周末,大鼠海馬在冰凍中立即分離并冷凍保存。收集上清液于-80°C保存,用于測定抗氧化酶和TBARs,用ELISA試劑盒檢測細胞死亡檢測細胞凋亡指數。結果:糖尿病不運動組和糖尿病運動組的TBARs水平顯著高于對照組;運動組SOD和GPx顯著增高,糖尿病不運動組顯著降低;與對照組相比,糖尿病不運動組CAT活性顯著降低;與對照組相比,糖尿病不運動組細胞凋亡率顯著增加,運動組顯著降低。結論:運動對糖尿病大鼠產生有益影響,部分原因可能是因為運動誘導氧化應激適應能力的改變。
氧化應激;糖尿病;跑臺運動;凋亡;海馬
1 前言
糖尿病是世界上一個重要的醫療問題,影響超過1.65億人,導致心血管疾病、腎病、視網膜病變和廣泛的周圍和中樞神經系統疾病。神經系統疾病可能成為最能導致身體虛弱的并發癥之一,會影響大腦敏感認知區域,如海馬,其調節記憶功能,呆滯顯著的功能障礙和癡呆。氧化應激是形成誘導多細胞通路形成的基礎,能最終導致糖尿病發生和后繼并發癥[1]。
海馬突觸可塑性和傳遞性缺損導致學習和記憶損害是糖尿病中樞系統并發癥的表現[2]。越來越多的實驗和臨床研究證據表明氧化應激在糖尿病發生和后繼并發癥如視網膜病變中起關鍵作用[3]。
活性氧和氮族,即過氧化物、羥自由基、過氧化氫和一氧化氮(NO)的產生是中樞神經系統生理代謝反應的結果。超氧自由基被超氧物歧化酶(SOD)轉換為過氧化氫,過氧化氫被谷胱甘肽過氧化物酶(GPx)和/或過氧化氫酶轉換為水[4]。過氧化氫能穿過所有細胞膜,在更遠位置導致羥自由基形成。羥自由基能引起脂質過氧化,損害細胞器和細胞膜,導致細胞死亡[4]。NO被超氧自由基快速破壞,其活性在SOD存在下增高[5]。
因為其高氧消耗率,大腦尤其易受氧化損傷,過度的活性自由基產生和高水平轉換金屬,如鐵,催化活性自由基產生。此外,神經膜富含多不飽和脂肪酸,這是脂質過氧化的一個來源[6]。糖尿病患者的葡萄糖氧化、非酶糖基化蛋白和隨后的糖基化蛋白氧化降解反應,會不成比例的形成自由基。自由基水平的異常升高,同時抗氧化防御機制下降能導致細胞器和酶的損傷、脂質過氧化的增加和胰島素抵抗的形成。氧化應激的這些后果能促進糖尿病并發癥的發生[7]。
一些研究表明,規律的適度的身體活動會對大腦產生有益的影響[8]。運動能刺激海馬中的神經發生、改善學習和記憶[9-11]。據報道,運動能增強健康和糖尿病動物海馬的細胞增殖[12-13]。最近,有研究指出運動可能防止鏈脲霉素誘導的糖尿病大鼠海馬突觸可塑性損害[2]。可以認為規律運動增加氧化酶活性、增加抵抗氧化應激,因此降低細胞氧化損害[14]。
據筆者所知,目前缺少規律運動影響糖尿病大鼠海馬氧化應激和凋亡的研究證據。當前的研究目的是檢驗跑臺跑是否能減輕鏈脲霉素誘導的糖尿病大鼠海馬中氧化應激和細胞凋亡率。
2 材料與方法
40只雄性Wistar大鼠,2月齡,平均體重190±12 g,購于復旦大學實驗動物科學部。大鼠室內飼養,室溫控制在23±2°C,12小時光照循環,自由進食和飲水。
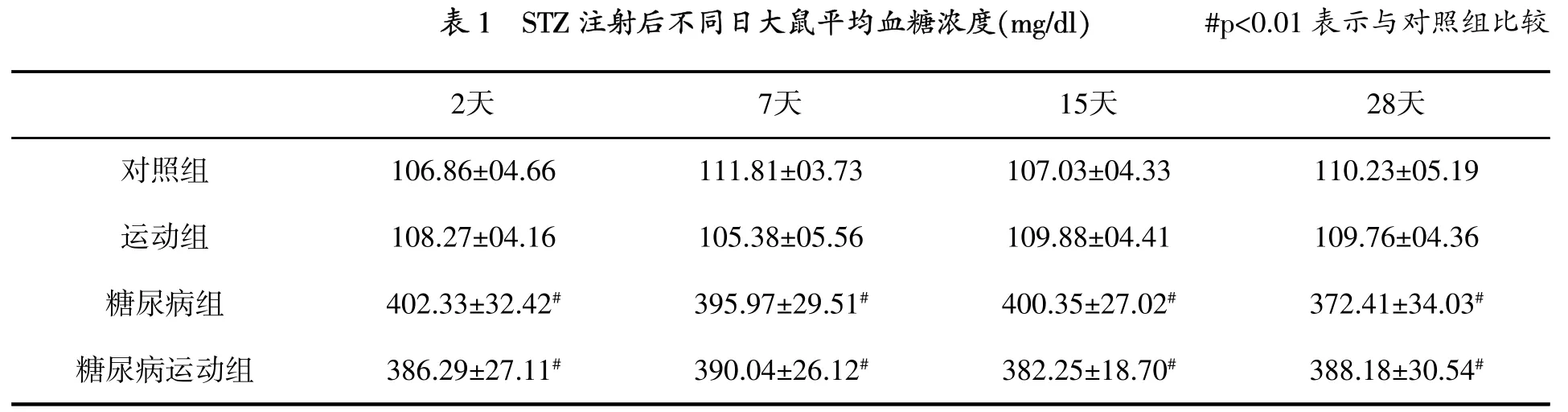
大鼠隨機分為4組,每組10只,即對照組(不運動)、運動組、糖尿病組(不運動)和糖尿病運動組。所有運動組大鼠在動物電動跑臺上進行8周運動,坡度為0%,速度為17m/min,每天40min,每周7天[2]。運動組大鼠接受運動計劃的同時,糖尿病組大鼠每天放置于跑臺上10 min,熟悉跑臺環境。為了建立糖尿病大鼠模型,大鼠腹膜內注射50 mg/kg鏈脲霉素(STZ),對照組大鼠注射生理鹽水。STZ注射后2天,用血糖測試儀測定血糖水平,大鼠血糖水平≥300 mg/dl為建模成功(表1)。所有大鼠在建模成功后8周解剖。
運動組和糖尿病運動組大鼠在最后一次運動后24小時,所有大鼠乙醚麻醉,斷頭。迅速分離海馬,1 mL冰凍預冷的裂解緩沖液 (10 mM NaCl,1.5 mM MgCl2,20 mM HEPES,20%甘油,0.1%Triton X-100,1mM二硫蘇糖醇,pH=7.4)中勻漿。勻漿后于4°C,1000 rpm分離1 min。收集含有細胞質蛋白的上清液,加入蛋白酶抑制劑混合物 (104 mM AEBSF,0.08 mM抑肽酶,2 mM亮肽素,4 mM抑氨肽酶b,1.5 mM胃酶抑素A和1.4 mM E-64)于-80℃保存。用Bradford法評估上清液蛋白濃度[15]。
通過測定勻漿中硫代巴比妥酸反應物(TBARs)分析脂質過氧化[16]。簡單的說,樣本與1 mL10%的三氯乙酸和1 mL0.67%的硫代巴比妥酸混合。接著樣本在沸水浴中加熱15 min,加丁醇(2∶1,v∶v)于溶液中。800 g,離心5 min后,在535 nm吸光度測定TBARs。
用Griffith法測定海馬中谷胱甘肽濃度。勻漿制備如下:海馬在5 vol.1%三氯乙酸(w/v)中勻漿,接著以18000 g離心10 min。為了測定總谷胱甘肽,等分上清液稀釋1/50,10 μL制劑加入含有0.21 mM NADPH,0.6 mM5,5¢-二巰代(2-硝基苯甲酸),5 mM EDTA,和0.5 U谷胱甘肽還原酶的100 mM磷酸鈉緩沖液,pH=7.5的混合物,最終容積為1 mL。記錄412 nm吸光度。與谷胱甘肽標準曲線對照計算總谷胱甘肽[17]。
用RANSOD試劑盒測定超氧物歧化酶(SOD)活性[18]。上清液中SOD活性用分光光度計在505 nm處測定。依據這種方法,用葉黃素和葉黃素氧化酶產生超氧自由基,與碘硝基氯化四氮唑藍(INT)反應形成紅色甲臜。葉黃素的底物濃度為0.05 mmol/L,INT底物濃度為0.025 mmol/L。通過這個反應的抑制程度測定SOD活性。
用RANSEL試劑盒測定谷胱甘肽過氧化物酶(GPx)活性[19]。通過過氧化氫異丙苯,GPx催化谷胱甘肽氧化(濃度為4 mmol/L)。在谷胱甘肽還原酶(濃度為0.5 units/L)和0.28 mmol/L NADPH存在條件下,氧化型谷胱甘肽立即轉換為還原形式,同時NADPH氧化為NAD+。用分光光度計測定340 nm處吸光度。之前,海馬勻漿4°C,1000 g離心10 min。
過氧化氫酶活性(CAT)測定方法如文獻所述[20]。H2O2分解后直接降低20°C,于240 nm測吸光度。適量上清液(60 μL相當于1.5 mg濕組織)加入反應混合物,含有0.002%Triton X-100,0.1 mm EDTA,0.5 m磷酸氫二鉀緩沖液,pH=7.0和15 mm H2O2,最終容積1 mL。用最初30 s分解率計算活性。
根據試劑盒的說明,用細胞凋亡檢測ELISA試劑盒定量測定細胞質組蛋白相關DNA片段。簡要的說,萃取的海馬細胞質作為酶聯免疫雙抗原夾心法的抗原與一抗組蛋白鼠單克隆抗體涂層微量滴定板和二抗DNA鼠單克隆抗體配對的過氧化物酶。在20°C,免疫復合物與2,2-聯氮雙(3-乙基苯并噻唑啉-6-磺酸)二銨鹽(ABTS)孵化10 min,分光光度計于405 nm下測的定固定的過氧化物酶色澤變化。所有測量進行雙份,對照組和訓練組樣本的分析在相同的微量滴定板上、相同環境中進行。接著OD405讀數標準化為樣本中總蛋白量。OD405/mg蛋白作為細胞凋亡指數,表示細胞漿單體和寡核苷酸酶的水平。
3 統計分析
用SPSS18.0對數據進行分析。用Shapiro-Wilk檢驗數據的常態分布,用單因素ANOVA分析組間差異,變量包括TBARs、抗氧化酶和細胞凋亡指數。當獲得顯著性P值時,Tukey post-hoc檢驗確定組間差異。設P<0.05為統計顯著性。
4 結果
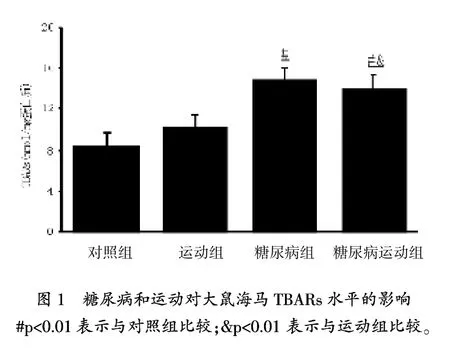
圖1顯示,與對照組相比,糖尿病組和糖尿病運動組TBARs水平顯著增高(p=0.001),但運動的TBARs水平沒有變化。雖然運動組和糖尿病運動組與對照組相比,海馬GSH水平沒有變化(表2),但是與對照組(p=0.009)和運動組(p= 0.004)相比,糖尿病組GSH水平顯著降低。
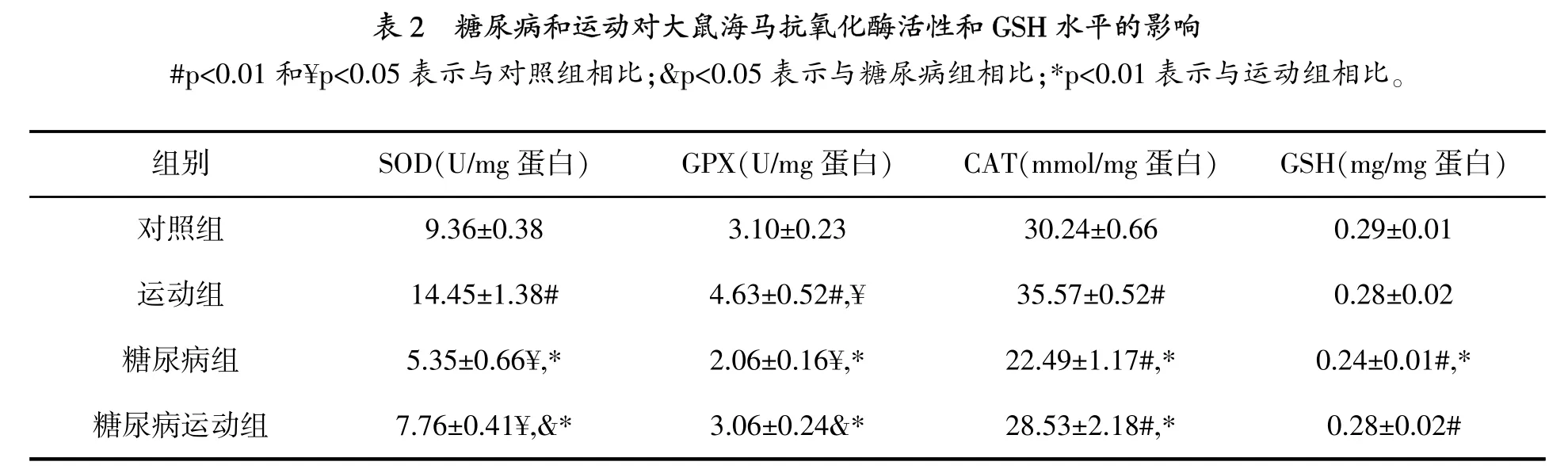
研究結果顯示,與對照組相比,運動組大鼠海馬SOD活性顯著增高 (p=0.001),糖尿病組SOD活性顯著降低(p=0.004)(表2)。雖然與對照組相比,糖尿病運動組SOD活性降低(p=0.032),但是比糖尿病組高(p=0.041)。
如同SOD活性,運動組海馬GPX活性增加(p=0.009),糖尿病組降低(p=0.019)。雖然與對照組相比,運動組GPX活性沒有變化,但是高于糖尿病組(p=0.029)。
與對照組相比,糖尿病組大鼠海馬CAT活性顯著降低(p=0.001)。然而,與對照組相比,運動組CAT活性顯著增高(p=0.004)。與對照組相比,糖尿病運動組CAT活性沒有變化,但是與糖尿病組相比,顯著增高(p=0.002)。
5 討論
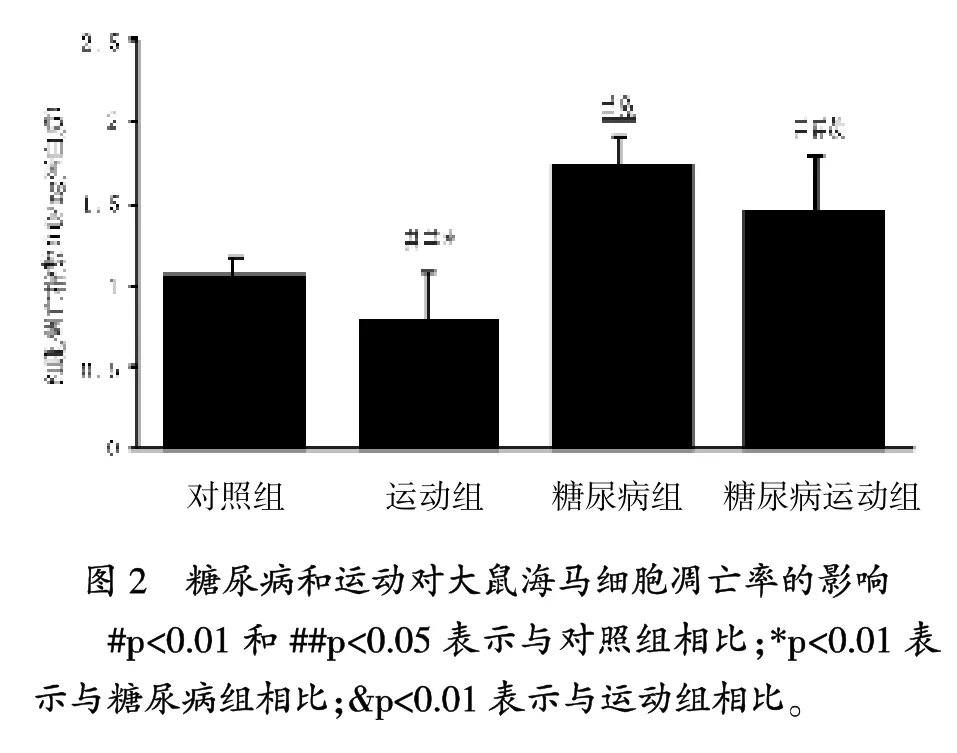
當前的研究中,糖尿病與海馬脂質過氧化增加相關,其是一個已知的氧化應激標志,伴隨抗氧化酶SOD、GPX和CAT顯著下降。另外,糖尿病引起GSH水平顯著增加,海馬細胞凋亡率也顯著增加。
糖尿病大鼠TBARs水平增高,表明氧化應激增加,預期抗氧化劑活性增加。研究發現SOD、GPX和CAT降低,表明這些酶的活性受糖尿病的影響。先前的研究表明,糖尿病誘導氧化應激,大腦和海馬中抗氧化酶活性和能力減少[3][21-22]。然而,Ramanathan等報道,誘導糖尿病后72 h,SOD和CAT活性增加,GPX活性沒有變化[23]。相反,在誘導糖尿病后1個月,CAT活性增加,GPX活性降低,SOD活性沒有變化。筆者測定誘導糖尿病后2個月的抗氧化酶活性。Lappalainen等報道,誘導糖尿病后2個月,大鼠大腦中的谷胱甘肽還原酶降低,GPX活性增高,CAT和SOD活性沒有變化[21]。但是,筆者測定海馬中的這些酶活性,大腦不同區域這些酶活性可能不同[24]。
在凋亡神經病變過程中,氧化應激是一個關鍵的參與者,伴隨代謝受損和興奮性中毒[25]。氧化應激過程中,幾個脂質過氧化產物形成,這些涉及神經死亡和成為GSH的一個中間底物,聚集進一步的氧化應激[6]。GSH是細胞內主要的抗氧化分子,是構成抗氧化應激的一個重要機制[21]。 GSH水平降低與凋亡神經死亡有關[26]。本研究結果與這個想法一致,與對照組相比,糖尿病大鼠海馬GSH率顯著降低和細胞凋亡顯著增加。Lappalaine等報道,糖尿病通過GSH減少誘導大鼠大腦氧化應激[21]。此外,Piotrowski等描述細胞凋亡蛋白酶-3活性,是凋亡細胞死亡的一個關鍵酶,糖尿病大鼠的海馬中升高[27]。這些數據顯示,糖尿病導致氧化應激,可能誘導海馬細胞凋亡。
筆者研究表明,非糖尿病運動大鼠比對照組有更高的SOD、GPX和CAT活性。而且,與對照組相比,非糖尿病運動組細胞凋亡率顯著降低。非糖尿病運動組和對照組的TBARs水平沒有差異,表明規律運動不能影響過氧化指數。Aksu等也報道,規律運動沒有引起大鼠海馬的氧化應激,通過降低超氧化自由基形成對海馬有一個有利影響[28]。另一方面,Lappalainen等報道,8周運動后大腦中的抗氧化酶 (除了谷胱甘肽還原酶)沒有增加[21]。這個差異可能是由方法不同、評價大腦區域不同、運動計劃不同和最后一次運動與動物處死之間的時間不同產生的。
筆者也研究了運動對糖尿病誘導的大鼠海馬氧化應激和細胞凋亡率的影響。結果顯示規律運動有效地預防大鼠海馬抗氧化酶活性和GSH水平降低。Lappalainen等研究顯示,規律運動沒有影響大鼠大腦中SOD、GPX和CAT活性[21]。這個差異的原因不清楚,但是可能歸因于運動對大腦不同區域的不同效應或評價方法的不同和運動計劃的不同。
研究結果表明,規律運動防止糖尿病大鼠海馬中脂質過氧化的增加和細胞凋亡率增加。關于抗氧化酶活性的增加,可能是防止凋亡增加而導致氧化應激降低的產生。先前,有人提出涉及氧化應激與海馬細胞凋亡的建議[29],Lee等研究顯示,跑臺運動開始后24小時,大腦出血和誘導糖尿病,齒狀回凋亡細胞數量顯著降低[13]。另外,跑臺運動顯著增強高血糖大鼠齒狀回細胞的增殖。
6 結論
研究結果表明,規律的運動能減少糖尿病誘導的海馬氧化應激和細胞凋亡率。降低周圍和中樞神經系統病變,預防學習和記憶損害,防止老年癡呆的發生。
參考文獻:
[1]段淑芳,葉真.糖尿病血管并發癥與內皮細胞氧化應激的關系[J].浙江中醫藥大學學報,2010,(6)∶944-946.
[2]Reisi P.,Babri S.,Alaei H.,et al.Effects of treadmill running on short-term pre-synaptic plasticity at dentate gyrus of streptozotocin-induced diabetic rats[J].Brain Res.,2008,(1211)∶30-6.
[3]陳放,徐珊,呂偉紅,程宏,等.糖尿病大鼠視網膜氧化應激損傷及葛根素的干預作用[J].眼科新進展,2012,(1)∶15-19.
[4]孫備,姜洪池,趙金鵬,等.大鼠肝臟保存再灌注時羥自由基與細胞凋亡、Bcl-2蛋白表達的關系及丹參的保護作用[J].中華普通外科雜志,2000,(9)∶27-30.
[5]Rubanyi G.M.,Vanhoutte P.M.Superoxide anions and hyperoxia inactivate endothelium-derived relaxing factor[J].Am J Physiol.,1986,(250)∶822-7.
[6]Ansari M.A.,Roberts K.N.,Scheff S.W.Oxidative stress and modification of synaptic proteins in hippocampus after traumatic brain injury[J].Free Radic Biol Med.,2008,(45)∶443-52.
[7]徐華,納春祥,李海龍,等.糖尿病并發癥相關性氧化應激的實驗研究[J].中國醫藥指南,2012,(28)∶1-2.
[8]Ahlskog J.E.,Geda Y.E.,Graff-Radford N.R.&Petersen R.C.Physical exercise as a preventive or disease-modifying treatment of dementia and brain aging[J].Mayo Clin Proc.,2011,(86)∶876-84.
[9]Wolf,S.A.,Melnik,A.&K.empermann,G.Physical exercise increases adult neurogenesis and telomerase activity,and improves behavioral deficits in a mouse model of schizophrenia[J].Brain Behav Immun.,2011,(25)∶971-80.
[10]Liu H.L.,Zhao G.,Cai K.,Zhao H.H.&Shi L.D.Treadmill exercise prevents decline in spatial learning and memory in APP/PS1 transgenic mice through improvement of hippocampal long-term potentiation[J].Behav Brain Res.,2011,(218)∶308-14.
[11]孟兆輝,徐波,李世昌,等.運動誘導海馬內IGF-1的變化與學習記憶能力的關系[J].中國康復理論與實踐,2008,(10)∶912-915.
[12]Kim H.B.,Jang M.H.&Shin M.C.,et al.Treadmill exercise increases cell proliferation in dentate gyrus of rats with streptozotocin-induced diabetes[J].J Diabetes Complications,2003,(17)∶29-33.
[13]Lee H.H.,Shin M.S.&Kim Y.S.,et al.Early treadmill exercise decreases intrastriatal hemorrhage-ind-uced neuronal cell death and increases cell prolifera-tion in the dentate gyrus of streptozotocin-induced hyperglycemic rats[J].J Diabetes Complications,2005,(19)∶339-46.
[14]Mazzola P.N.,Terra M.,Rosa A.P.,et al.Regular exercise prevents oxidative stress in the brain of hyperphenyla-laninemic rats[J].Metab Brain Dis.,2011,(26)∶291-7.
[15]Bradford M.M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Anal Biochem.,1976,(72)∶248-54.
[16]Draper H.H.&Hadley M.Malondialdeyde determination as an index of lipid peroxidation[J].Methods Enzymol.,1990,(186)∶421-31.
[17]Griffith O.W.Determination of glutathione and glutathione disulfide using glutathione reductase and 2-vinylpyridine[J].Anal Biochem.,1980,(106)∶207-12.
[18]Delmas-Beauvieux M.C.,Peuchant E.,Dumon M.F.,et al.Relationship between red cell antioxidant enzymatic system status and lipid peroxidation during the acute phase of malaria[J].Clin Biochem.,1995,(28)∶163-9.
[19]Paglia D.E.&Valentine W.N.Studies on the quantitative and qualitative characterization of erythrocyte glutathione peroxidase[J].J Lab Clin Med.,1967,(70)∶158-69.
[20]Aebi H.Catalase in vitro[J].Methods Enzymol.,1984,(105)∶121-6.
[21]Lappalainen,Z.,Lappalainen,J.,Oksala,N.K.,et al.Diabetes impairs exercise training-associated thioredoxin response and glutathione status in rat brain[J].Appl Physiol,2009,(106)∶461-7.
[22]Kosenko E.A.,Kaminskii AIu,Kaminskii,I.G.Activity of antioxidant enzymes in liver and brain is decreased in the early stage of diabetes,and this decrease depends on the function of NMDA-receptors[J].Vopr Med Khim.,1999,(45)∶304-8.
[23]Ramanathan M.,Jaiswal A.K.&Bhat-tacharya S.K.Superoxide dismutase,catalase and glutathione peroxidase activities in the brain of streptozotocin induced diabetic rats[J].Indian J Exp Biol.,1999,(37)∶182-3.
[24]Somani S.M.,Ravi R.&Rybak L.P.Effect of exercise training on antioxidant system in brain regions of rat[J].Pharmacol Biochem Behav.,1995,(50)∶635-9.
[25]Alexi T.,Borlongan C.V.,Faull R.L.,et al.Neuroprotective strategies for basalganglia degeneration∶Parkinson′s and Hunt-ington′s diseases[J].Prog Neurobiol.,2000,(60)∶409-70.
[26]Ansari M.A.,Joshi G.,Huang Q.,et al.Invivo administration of D609 leads to protection of subsequently isolated Gerbil brain mitochondria subjected to invitro oxidative stress induced by amyloid betapeptide and other oxidative stressors∶relevance to Alzheimer′s disease and other oxidative stress-related neurodegenerative disorders[J].Free Radic Biol Med.,2006,(41)∶1694-703.
[27]Piotrowski P.,Wierzbicka K.&Smialek M.Neuronal death in the rat hippocampus in experimental diabetes and cerebral ischaemia treated with antioxidants[J].Folia Neuropathol.,2001,(39)∶147-54.
[28]Aksu I.,Topcu A.,Camsari U.M.,et al.Effect of acute and chronic exercise on oxidant-antioxidant equilibrium in rat hippocampus,prefrontal cortex and striatum[J].Neurosci Lett.,2009,(452)∶281-5.
[29]Zhang Q.,Zhang G.,Meng F.,Tian H.Biphasic activation of apoptosis signal-regulating kinase 1-stress-activated protein kinase 1-c-Jun N-terminal protein kinase pathway is selectively mediated by Ca2+-permeable alpha-amino-3-hydroxy-5-methyl-4-isoxazolepropionate receptors involving oxidative stress following brain ischemia in rat hippocampus[J].Neurosci Lett.,2003,(337)∶51-5.
THE EFFECT OF EXERCISE ON THE OXIDATIVE STRESS OF THE DIABETES-INDUCED RAT-HIPPOCAMPUS
LI Jing
(School of Physical Education,Chaohu College,Chaohu Anhui 238000)
Background∶Oxidative stress forms the foundation for the induction of multiple cellular pathways which can lead to the complications of diabetes mellitus.The most debilitating ones are diseases of the nervous system.In this study,whether treadmill running could alleviate the oxidative stress and cellular apoptosis rate in the hippocampus of streptozotocin-induced diabetic rats is evaluated.Methods∶Forty male Wistar rats were randomly divided into four groups(n=10)∶Control group,exercised group,diabetic group and diabetic-exercised group.Diabetes was induced by injection of streptozotocin in male rats.All rats in the trained group run on a rodent motor-driven treadmill for eight weeks.At the end of eight weeks,hippocampi of animals were immediately removed on ice and kept frozen.The light supernatant was taken and stored at-80°C.They were used for determination of antioxidant enzymes and TBARs level.Index of apoptosis was detected by cell death detection ELISA Kit.Results∶Levels of TBARs in diabetic group and diabetic-exercised group were significantly higher than control group.SOD and GPx activities significantly increased in exercised group and decreased in diabetic group.CAT activity significantly decreased in diabetic group versus control group.The apoptosis rate significantly increased and decreased in diabetic group and exercised group respectively compared to control group.Conclusion∶exercise has beneficial effects in the diabetic exercised rats,possibly in part because of alterations in the ability to adapt to exercise-induced oxidative stress.
oxidative stress;diabetes;treadmill exercise;apoptosis;hippocampus
G80
A
1672-2868(2015)06-0100-06
責任編輯:楊松水
2015-06-25
李靖(1982-),男,安徽巢湖人。巢湖學院體育學院,講師。研究方向:運動生理學。

