攜帶肝細胞生長因子的腺病毒感染臍帶間充質干細胞的實驗研究
張玉鎮 婁季宇△ 楊霄鵬 曾志磊 王珊珊 劉新珊 張曉明 尹紅蕾 王運良
1)鄭州大學第二附屬醫院神經內科 鄭州 450014 2)解放軍第一四八中心醫院神經內科 淄博 255300 3)解放軍第一五九中心醫院神經內科 駐馬店 463000
近年來,細胞移植治療帕金森病(Parkinson’s disease,PD)已吸引許多研究者的關注[1],而人臍帶間充質干細胞(mesenchymal stem cells derived from human umbilical cord,hUC-MSC)因具備較多的優點已成為優先修復PD的種子細胞之一[2]。同時肝細胞生長因子(hepatocyte growth factor,HGF)作為一個多功能的生長因子,參與多種細胞的分化、增殖、再生、遷移及形態的發生,包括hUC-MSC[3]。據Salehi等[4]報道,HGF可能參與了帕金森病的病理生理過程。因此,將hUC-MSC和HGF結合可能會成為治療PD的一種新型方法。
本研究將hUC-MSC分離并鑒定后,感染攜帶肝細胞生長因子基因的腺病毒載體(adenoviral vector carrying HGF gene,Ad-HGF),觀察hUC-MSC內酪氨酸羥化酶(tyrosine hydroxylase,TH)和多巴胺轉運體(Dopamine transporter,DAT)的表達情況,以明確在HGF過表達的情況下,hUCMSC是否有類多巴胺神經元分化的潛能,為HGF基因修飾hUC-MSC治療PD提供依據。
1 材料與方法
1.1 材料 攜帶綠色熒光蛋白基因的重組腺病毒毒株Ad-GFP由美國百特醫療用品公司基因治療部提供,攜帶HGF的重組腺病毒毒株Ad-HGF由本室構建;臍帶組織取自我院住院的健康產婦,所有標本的獲得均經產婦知情同意,并經醫院倫理委員會批準。F12培養基購自美國Gibco公司。DA ELISA試劑盒購自德國IBL公司。所有的抗體均購自美國R&D公司。
1.2 方法
1.2.1 hUC-MSC分離培養和鑒定:足月健康新生兒臍帶用無血清F12培養基清洗殘余血液,挑出臍動靜脈后,將剩余組織剪成約2mm的組織塊,再轉至離心管中,用無血清培養基清洗數遍以去除臍帶組織表面的黏液,后轉移至25cm2的培養瓶中,添加10%胎牛血清和雙抗的F12培養基,置于細胞培養箱中5%CO2,37℃培養,待細胞從組織塊周圍爬出進行傳代培養,只取3~6代細胞用于實驗。
將細胞用無血清培養基洗滌3次后,胰酶消化制成細胞懸液(1×106mL-1),取0.1mL加入每個離心管中,再加入CD44、CD29和CD105一抗,并在黑暗條件下4℃孵育30min;然后加入熒光標記的二抗,同樣條件下孵育30min。甲醛溶液固定后,用流式細胞儀(Becton Dickinson公司)和CellQuest軟件分析細胞表面是否表達CD44、CD29和CD105。
1.2.2 重組腺病毒轉染hUC-MSC后轉染效率的測定:將hUC-MSC接種于6孔細胞培養板中,每孔5×105個細胞,待細胞生長融合至80%左右,吸出原來的培養液,用無血清無雙抗的F12洗滌3遍,分別加入MOI為50、100、150、200和400的Ad-GFP,以F12做為對照,2h后棄掉病毒液,換成完全培養基繼續培養,48h后收取細胞用流式細胞儀檢測轉染效率。
1.2.3 細胞免疫酶化學方法檢測TH和DAT的表達:將無菌蓋玻片置于細胞培養板內,Ad-HGF感染細胞不同時間點,將玻片取出;磷酸鹽緩沖液(PBS)漂洗3×2min;4%多聚甲醛處理(室溫)20min;PBS漂洗3×2min;0.5%Txiton X-100處理(室溫)20min;PBS漂洗3×2min;3%H2O2處理15min;試劑盒中的血清封閉液,37℃封閉20min;取出甩干封閉液后加一抗,陰性對照用PBS代替一抗,37℃1~2 h或4℃過夜;PBS漂洗3×2min;加生物素標記的二抗37℃孵育30min;PBS漂洗3×2min;DAB顯色2~10min,蘇木素復染觀察。
1.3 統計學分析 使用SPSS 10.0統計軟件,組間比較采用單因素方差分析,所有數據以均值±標準差(±s)表示,P<0.05為差異有統計學意義。免疫組化結果運用Image-Pro Plus 5.0圖像分析軟件進行分析,得到集成光學密度值(IOD)值后再進行統計學比較。
2 結果
2.1 hUC-MSC分離培養及鑒定 采用組織塊法分離hUCMSC,組織塊貼壁后3~4d后可見少數細胞從組織塊周圍爬出,細胞呈梭形,多角形,可見細胞核,隨著細胞增殖,形狀逐漸轉向典型的成纖維樣細胞。當細胞融合至90%左右,細胞呈平行排列或漩渦狀。然后按1︰2將細胞傳代。取第3代用流式細胞儀檢測細胞分子表面標志。如圖1所示,分離培養出的hUC-MSC表達間質干細胞表面標志物CD29、CD44和CD105,而不表達內皮細胞標志CD31和造血細胞表面抗原CD45。
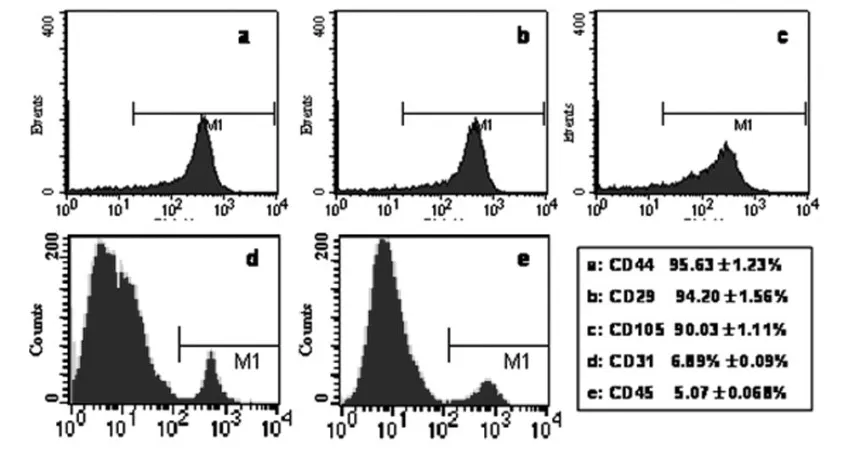
圖1 流式細胞儀檢測hUC-MSC表面CD44、CD29和CD105的表達情況
流式細胞儀結果表明hUC-MSC表達間質干細胞分子表面標志CD44、CD29和CD105,而不表達內皮細胞標志CD31和造血細胞表面抗原CD45。
2.2 重組腺病毒可高效感染hUC-MSC 運用不同MOI(50、100、150、200和400)的Ad-GFP感染hUC-MSC,48h后流式細胞儀和熒光顯微鏡檢測感染效率。結果顯示隨著MOI值的升高,感染效率逐步提高,當MOI為200時感染效率就能達到99.55%左右,但當MOI值為400時,感染效率也只有99.99%(圖2)。本研究結果表明,我們構建的腺病毒可高效感染hUC-MSC。本著細胞損傷小,所用腺病毒少,還要高感染效率的原則,接下來的實驗中腺病毒感染MOI值統一為200。
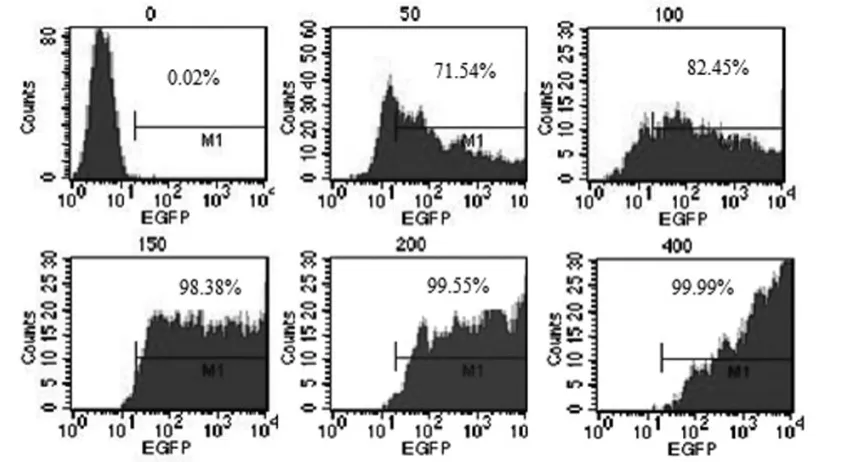
圖2 流式細胞儀檢測hUC-MSC感染效率
不同MOI(0、50、100、150、200和400)的Ad-GFP感染細胞后繼續培養48h。流式細胞儀檢測感染效率。隨著病毒滴度的變化感染效率可達99.99%。但MOI 200和400組間無明顯差異。
2.3 Ad-HGF感染后hUC-MSC細胞內TH和DAT表達逐漸增加 hUC-MSC感染Ad-HGF后,連續觀察3d,如圖3所示,hUC-MSC內TH和DAT的表達逐漸增多,隨著時間的推移,這種現象越來越明顯,同時發現細胞形態逐漸改變,轉為多邊形和不規則形,還會看到有長的突起。對免疫組化結果進行圖像分析,隨機選取10個視野得到IOD值,再進行統計學分析(圖3),結果表明對照組和Ad-HGF組間差異有統計學意義(P<0.01)。
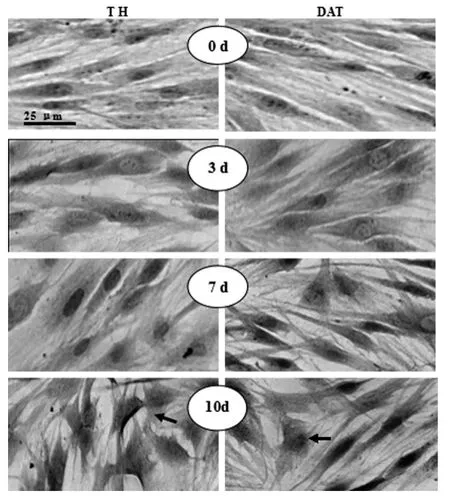
圖3 細胞免疫酶化學方法檢測hUC-MSC感染Ad-HGF后TH和DAT的表達
hUC-MSC感染Ad-HGF后,隨著時間的推移,細胞內TH和DAT的表達逐漸增多,同時細胞形態逐漸改變,轉為多邊形和不規則形,還會看到有長的突起(如箭頭所示,左邊是TH,右邊是DAT,從上而下依次為0、3、7、10d)。
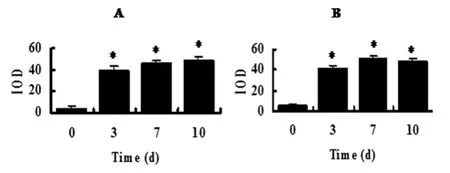
圖4 圖像分析軟件分析細胞免疫酶化學結果
對細胞免疫酶化學結果進行圖像分析,隨機選取10個視野得到IOD值,再進行統計學分析,結果表明對照組和Ad-HGF組間有顯著性差異(*P<0.01,A:TH,B:DAT)。(圖4)。
3 討論
hUC-MSC治療PD成為目前比較感興趣的話題,證據表明,hUC-MSC移植進入患者體內后表現出很強的可塑性,一定條件下,可分化成多種功能細胞。越來越多的資料證實,細胞因子、免疫和炎癥反應的產物,在帕金森病發生發展的過程中起非常重要的作用[5]。HGF作為一種多功能的生長因子,對運動神經元的發育、存活、軸突的生長和導向,以及對周圍神經損傷后神經元的保護、軸突的延長和神經纖維的修復等具有重要作用[6]。Lan等[7]發現,HGF可調控多巴胺能神經祖細胞的增殖和遷移,為治療帕金森綜合征提供新的思路。日本學者用6-羥多巴胺制作大鼠的帕金森模型,單側紋狀體內注射攜帶HGF基因的質粒,并與注射lacZ基因的質粒相對照,24周時HGF組癥狀明顯減輕,且與劑量有關。免疫組化結果發現對照組約90%的多巴胺能神經元消失,而HGF組僅減少70%左右,提示HGF過表達可以阻止帕金森大鼠多巴胺能神經元的死亡[8]。Salehi等[4]運用免疫印跡方法檢測PD和正常人腦脊液及血液中的HGF,發現2組血液中HGF濃度無明顯差異,而PD患者腦脊液中HGF的濃度遠高于正常人群,表明HGF參與了PD的病理生理過程。
外源性HGF蛋白在體內半衰期短,不易通過血腦屏障。構建含HGF基因的腺病毒載體可直接用于感染靶細胞,轉染宿主細胞后,外源基因至少持續表達2周,同時不整合入宿主細胞。因此,Ad-HGF與hUC-MSC結合將是修復PD的一種新型方法。本研究中,我們將Ad-HGF轉移到hMUMSCs中,重點觀察hMU-MSCs向多巴胺能樣細胞分化的情況。結果表明,hMU-MSCs感染Ad-HGF后逐步表達TH和DAT。同時還發現,hMU-MSCs的形狀在慢慢改變,從長梭形向多角形,而且還有一些長的突起,類似于對神經干細胞的形態,提示hUC-MSC在HGF的作用下具有向多巴胺能樣神經元分化的能力,為HGF基因修飾hUC-MSC治療帕金森病提供一定的細胞基礎。
[1]Sharma R,McMillan CR,Niles LP.Neural stem cell transplantation and melatonin treatment in a 6-hydroxydopamine model of Parkinson's disease[J].J Pineal Res,2007,43(3):245-254.
[2]Can A,Balci D.Isolation,culture,and characterization of human umbilical cord stroma-derived mesenchymal stem cells[J].Methods Mol Biol,2011,698(1):51-62.
[3]Bot taro DP,Rubin JS,Falet to DL,et al.Identification of hepatocyte growth Factor receptor as the c-met proto-oncogene product[J].Science,1991,251(2):802-804.
[4]Salehi Z,Rajaei F.Expression of hepatocyte growth factor in the serum and cerebrospinal fluid of patients with Parkinson's disease[J].J Clin Neurosci,2010,17(12):1 553-1 556.
[5]Fiszer U.Does Parkinson's disease have an immunological basis The evidence and its therapeutic implications[J].BioDrugs,2001,15(6):351-355.
[6]Hu ZX,Geng JM,Liang DM,et al.Hepatocyte growth factor protects human embryonic stem cell derived-neural progenitors from hydrogen peroxide-induced apoptosis[J].Eur J Pharmacol,2010,645(1/3):23-31.
[7]Lan F,Xu J,Zhang X,et al.Hepatocyte growth factor promotes proliferation and migration in immortalized progenitor cells[J].Neuroreport,2008,19(7):765-769.
[8]Koike H,Ishida A,Shimamura M,et al.Prevention of onset of Parkinson's disease by in vivo gene transfer of human hepatocyte growth factor in rodent model:a model of gene therapy for Parkinson's disease[J].Gene Ther,2006,13(23):1 639-1 644.

