血清高遷移率族蛋白B1白細胞介素-18和-23S100B及同型半胱氨酸和神經肽Y水平檢測對缺血性腦卒中預后的影響
沈顯群 龔自力
1)重慶市北部新區第一人民醫院檢驗科 重慶 401121 2)第三軍醫大學附屬新橋醫院神經內科 重慶 400037
本研究通過觀察血清高遷移族蛋白B1(HMGB1)、白細胞介素-18(IL-18)、白細胞介素-23(IL-23)、S100B蛋白、同型半胱氨酸(Hcy)以及神經肽Y(NPY)水平的變化情況,分析其對缺血性腦卒中患者的預后影響,為臨床治療提供幫助和指導,現總結如下。
1 資料與方法
1.1 一般資料 選取我院2010-10—2013-04神經內科收治的新發缺血性腦卒中患者100例為觀察組,并選取同期入院體檢的健康志愿者100例為對照組。診斷標準按照全國第4次腦血管病會議(1995年)制定的缺血性腦卒中診斷標準。入選條件:臨床診斷新發缺血性腦梗死;頭顱CT 或MRI證實;缺血發生至就診48h內;有局灶性或區域性神經系統癥狀和體征。排除標準:無癥狀性腦梗死患者;短暫性腦缺血發作;復發及并發后遺癥;合并惡性腫瘤、腦出血等患者;且無嚴重心、肺、肝、腎疾病,無全身性感染以及自身免疫性疾病、免疫抑制的患者。對象均符合上述入選標準,觀察組中男58例,女42例;年齡45~83歲,平均(65.2±10.7)歲;收縮壓90~170mmHg,平均(141.4±17.5)mmHg;合并糖尿病22例,高脂血癥33例。對照組男60例,女40例;年齡44~85歲,平均(63.9±11.3)歲;動脈壓68~130mmHg,平均(101.3±15.2)mmHg。2 組患者年齡、性別比較差異無統計學意義(P>0.05),具有可比性。
1.2 方法
1.2.1 標本采集:觀察組患者至入院起,采集當天、第3、7、14天的靜脈血。對照組在體檢后采血1次。所有收集的標本均放入無菌抗凝管,經過3 000r/min,20min離心處理,分離出血清,放入-70 ℃的冰箱保存待測。
1.2.2 標本測定:采用上海森雄科技實業公司提供的儀器與試劑,進行白細胞介素-18(IL-18)、白細胞介素-23(IL-23)的測定。使用芬蘭丹尼WK-II型酶標儀,并由瑞典CanAg公司提供的S100B-ELISA 試劑盒與血漿高遷移率族蛋白B1試劑盒,進行S100B 蛋白與血清高遷移族蛋白B1 的測定。同型半胱氨酸(Hcy)測定采用熒光偏振免疫分析法,使用美國雅培公司的Hcy試劑盒,神經肽Y(NPY)的測定采用放射免疫分析法,試劑盒由北京科美東雅生物技術有限公司提供[1]。所有操作均按嚴格的操作及試劑盒使用說明進行。
1.2.3 觀察指標:對入選患者的血糖、血壓、血清高遷移族蛋白B1(HMGB1)、白細胞介素-18(IL-18)、白細胞介素-23(IL-23)、S100B 蛋白、同型半胱氨酸(Hcy)以及神 經肽Y(NPY)等水平進行測定。評價觀察組患者入院后的神經功能缺損(SSS)情況,根據NIHSS評分系統和改良Rankin量表(mRS)衡量患者神經功能。
1.3 診斷標準 預后分為死亡:發病后1a內任何原因所致的死亡;殘障:日常生活上需要依賴他人,生活自理能力出現困難,mRS評分>2;復發:在上一次缺血性腦卒中后,出現新的急性神經血管系統疾病,主要指腦梗死,且癥狀持續超過24h。將mRS 0~2分患者定義為預后良好組,mRS 3~6分患者定義為預后不良組[2]。
1.4 統計學方法 采用Stata統計軟件進行錄入、核實和處理。計量資料用±s表示,組間均數比較采用t檢驗,計數資料以率(%)表示,比較采用χ2檢驗,對于存在差異的采用Cox單因素分析,P<0.05為差異有統計學意義。
2 結果
2.1 觀察組患者的預后情況 通過隨訪,觀察組患者分為預后良好組(n=61)和預后不良組(n=39),2組平均NIHSS評分、高血壓史以及糖尿病史差異有統計學意義(P<0.05)。觀察組12例死亡,病死率12%。見表1。

表1 觀察組患者預后情況
2.2 2 組患者各項指標比較 2 組膽固醇、血糖、CRP、NPY、IL-18、IL-23、S100B、HMGB1以及Hcy等指標差異有統計學意義(P<0.05)。見表2。
表2 2組各項檢測指標對比情況 (±s)

表2 2組各項檢測指標對比情況 (±s)
組別 n 膽固醇 血糖 CRP NPY IL-18 IL-23 S100B HMGB1 Hc y觀察組 100 2.83±0.52 5.7±2.3 0.11±0.05 6.6±2.1 0.4±0.2 2.24±0.87 0.5±0.04 8.4±2.5 16.3±2.6對照組 100 1.07±0.45 4.1±1.5 0.04±0.01 1.7±1.2 0.1±0.01 1.01±0.03 0.01±0.01 2.1±0.8 6.5±1.4
2.3 檢查指標對觀察組患者預后的影響 NPY、S100B 蛋白、IL-18、IL-23隨著病情進展呈逐漸增加的趨勢,與對照組相比,NPY 為對照組的2.2倍,IL-18、IL-23、S100B蛋白與對照組比較差異有統計學意義(P<0.05)。HMGB1以及Hcy的水平變化同樣也反映缺血性腦卒中患者的預后情況,血漿高遷移率族蛋白B1濃度是患者死亡的獨立危險因素。單因素Cox回歸分析結果見表3。
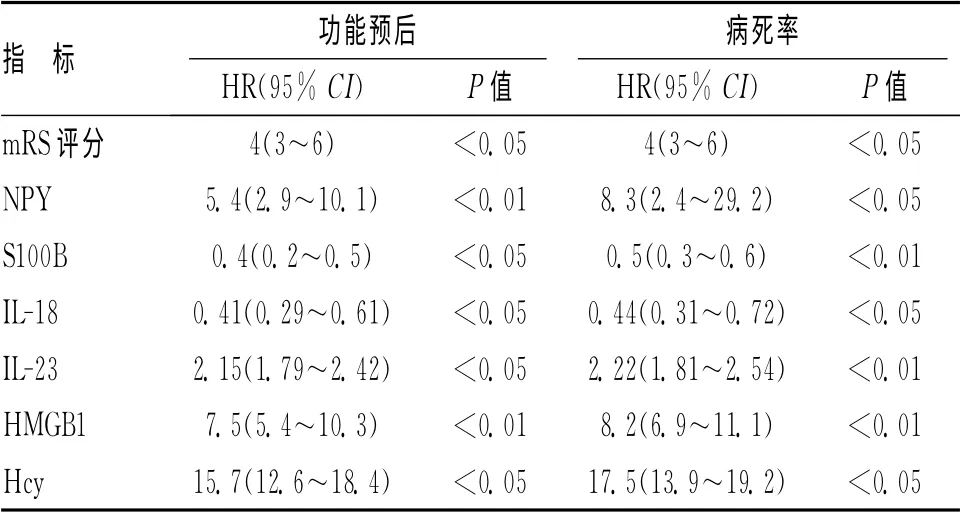
表3 觀察組患者預后及死亡的單因素Cox回歸分析
3 討論
缺血性腦卒中是神經內科常見的一種腦血管疾病,患者病死率及致殘率較高,資料顯示,患者發病1a內的病死率達20%,且超過15%的幸存者遺留終身殘疾。如何對缺血性腦卒中患者的病情嚴重程度預估和預后早期評價是提高患者生存質量以及合理配置醫療資源的關鍵。通過快速識別高危患者,不僅可以針對性地采取預防措施,還可以充分改善患者康復情況,有助于提高患者的遠期預后[3]。然而,目前臨床上的功能缺損癥狀很難準確預測患者的預后情況。因此,臨床上急需能夠迅速預測疾病死亡風險和進程的指標。筆者通過觀察NPY、S100B蛋白、IL-18、IL-23、HMGB1以及Hcy水平的變化,分析缺血性腦卒中患者的預后影響因素。
血清高遷移族蛋白B1(HMGB1)是一種能夠促進炎性細胞活化的單鏈多肽,可刺激促炎因子的產生和分泌[4]。當缺血的細胞壞死時,HMGB1 就由細胞核內釋放至胞外,發揮其致炎作用,且HMGB1受到促炎因子的作用,又會大量分泌,形成一種正反饋環,刺激中性粒細胞。通過巨噬細胞表面抗原的相互作用,導致細胞因子的生成與釋放,促進了炎性細胞因子的分泌,活化了HMGB1[5]。HMGB1 濃度的增加促進了血管內皮炎癥因子的表達,增加內皮與炎癥細胞的附著作用,加劇了炎癥環境,易化了內源性免疫細胞,使得疾病的預后向不利的方面發展。
IL-18與IL-23在多種疾病中發揮著功能,缺血性腦卒中主要是由于炎癥介導下產生局部缺血壞死。而IL-18 是致炎的決定因子,缺氧缺血的環境誘導IL-18的釋放,促進了干擾素產生,而干擾素又激活免疫因子,讓巨噬細胞反應,提高了細胞毒性T 細胞的分化[6],加劇了炎癥反應。IL-18與IL-23關系非常密切,都具有許多共同特性,在誘導細胞死亡方面,兩者均可作為炎性反應增效劑,IL-23與IL-18相互作用,促進了炎性效應。進一步誘導腫瘤壞死因子的產生,使得促炎基因和誘導性酶的產生,使炎性損傷加重[7]。現已證實,記憶T 細胞、NK 細胞以及DCs細胞中IL-18與IL-23均有表達,又使炎癥因子和趨化因子激活了IL-18與IL-23,促進TNF和IL炎性介質的產生,在缺血性腦卒中IL-18與IL-23作用下使得病情加重。
S100B蛋白是一種酸性鈣結合蛋白,主要存在膠質細胞中,一旦神經功能受到損傷,S100B 蛋白能夠通過血腦屏障進入血液,而神經未受損的患者則不易被測出。相關資料顯示,S100B蛋白血清水平的測定可以反映腦損傷的程度,S100B能促進神經細胞的生長、分化和修復,但濃度超過正常值時就會導致細胞死亡[8]。其與細胞中的一氧化氮合酶反應,導致神經細胞的加速死亡,表明S100B 的表達與患者預后進展密切相關。
同型半胱氨酸(Hcy)是氨基酸半胱氨酸的一種,Hcy本身并不參與蛋白的合成,主要是通過各種轉甲基作用,是中樞神經系統唯一的甲基提供者[9]。Hcy是缺血性腦卒中的高危風險,已有研究證明,血清中Hcy含量的升高與患者的預后有密切聯系,這與Hcy內含有自由基有關[10]。Hcy脂質的過氧化可以使生物膜遭到破壞,促進單核巨噬細胞的轉變。Hcy還能夠抑制抗氧化酶的表達,使機體更利于誘發缺血性腦卒中的發生。Hcy的超氧化物和過氧化物具有促血栓形成作用,易于動脈粥樣硬化的形成。Hcy及其衍生物可影響凝血因子V 的活性,通過氧化應激反應破壞血管內皮細胞,使得血小板功能活化失衡,加速血小板的聚集,抑制纖溶功能,進一步加重病情。
神經肽Y(NPY)是機體產生的一種多肽,與去甲腎上腺素共同釋放,具有收縮血管的作用,主要參與細胞的識別、分化以及信息傳遞等過程,還可以引起腦血管的收縮。因此,對于缺血性腦卒中的患者NPY 的水平同樣反映了患者疾病進展程度[11]。NPY 還具有感知、傳遞功能,作用于神經遞質、激素、病毒和干擾素的受體,對神經組織的再生、修復、分化有相當重要的作用。
綜上所述,血清高遷移族蛋白B1、白細胞介素-18、白細胞介素-23、S100B蛋白、同型半胱氨酸以及神經肽Y 水平與缺血性腦卒中患者的預后有密切聯系,這些指標的惡化表明病情程度越嚴重,患者預后越差,因此,臨床通過對上述指標的檢測,可較好預測缺血性腦卒中患者的預后情況。
[1]湯魯明,盧中秋,姚詠明.高遷移率族蛋白B1的胞外作用與免疫效應[J].生理科學進展,2011,42(3):188-194.
[2]Liu X,Wang L,Wen A,et al.Ginsenoside-Rd improves outcome of acute ischaemic stroke-a randomized,doubleblind,placebo-controlled,multicenter trial[J].Eur J Neurol,2012,19(6):855-863.
[3]Thulin E,Kesvatera T,Linse S.Molecular determinants of S100Boligomer formation [J].PLoS One,2011,6(3):e14 768.
[4]張蕊,鮑紅光.高遷移率族蛋白B1在炎癥性疾病中的研究進展[J].現代生物醫學進展,2012,12(30):5 988-5 992.
[5]Ye R,Yang Q,Kong X,et al.Ginsenoside Rd attenuates early oxidative damage and sequential inflammatory response after transient focal ischemia in rats[J].Neurochem Int,2011,58(3):391-398.
[6]Fritz G,Botelho HM,Morozova-Roche LA,et al.Natural and amyloid self-assembly of S100proteins:structural basis of functional diversity[J].FEBS J,2010,277(22):4 578-4 590.
[7]Zeng X,Deng Y,Feng Y,et al.Pharmacokinetics and safety of ginsenoside Rd following a single or multiple intravenous dose in healthy Chinese volunteers [J].J Clin Pharmacol,2010,50(3):285-292.
[8]Sarra M,Pallone F,Macdonald TT,et al.IL-23/IL-17axis in IBD[J].Inflamm Bowel Dis,2010,16(10):1 808-1 803.
[9]李淑萍,李春,趙蕾.急性腦梗死患者同型半胱氨酸、超敏C反應蛋白及白細胞介素-6的表達及臨床意義[J].臨床醫學,2010,30(11):44-45.
[10]劉建軍.急性腦梗死患者同型半肌氨酸和超敏C反應蛋自檢測的臨床意義[J].現代預防醫學,2012,39(5):1 301-1 304.
[11]Run ML,Yun FX,Su JC,et al.Correlation of plasma neuropeptide Y and neurotensin with cardiac functional damage and prognosis in essential hypertension patients[J].Chinese Journal of Clinical Rehabilitation,2004,8(30):6 794-6 795.

