糙米多酚3 種純化方法的比較
羅舜菁,張玫美,龔二生,劉成梅*,耿 勤,曾子聰,馬 燁
(南昌大學 食品科學與技術國家重點實驗室,江西 南昌 330047)
糙米多酚3 種純化方法的比較
羅舜菁,張玫美,龔二生,劉成梅*,耿 勤,曾子聰,馬 燁
(南昌大學 食品科學與技術國家重點實驗室,江西 南昌 330047)
分別用液液萃取、大孔樹脂、固相萃取法純化糙米多酚粗提物,對純化物的多酚回收率和抗氧化性進行研究,并通過高效液相色譜分析3 種純化方法總酚酸和其中9 種酚酸的回收率,3 種純化方法多酚回收率分別為20.51%、53.45%、87.87%,總酚酸回收率分別為56.84%、67.35%、68.99%,多酚純度由粗提物的19.23%分別提高到40.72%、46.84%和78.71%。多酚含量與1,1-二苯基-2-苦肼基自由基清除能力、鐵還原能力極顯著相關(P<0.01)。除品種因素外,純化方法是導致提取物中非酚酸多酚物質回收率差異大,進而引起多酚含量差異顯著的另一重要原因;純化方法對酚酸回收率有顯著影響,應依據純化目標物回收率來進行純化方法的篩選,而非以傳統的總多酚或總酚酸回收率判斷具體某種酚酸的最適純化方法。
糙米;多酚;純化;高效液相色譜法
多酚具有抗氧化、抗病毒、抗腫瘤、保護心血管、抑菌等生物功能[1],Massaretto等[2]研究發現糙米多酚能夠抑制血管緊張素轉化酶,Phetpornpaisan等[3]發現米糠提取物能夠抑制基質金屬蛋白酶以控制皮膚老化和乳腺癌的轉移。
多酚純化是多酚物質分離、鑒定和應用中非常重要的一個步驟,目前還沒有一個簡單化和標準化的純化方法。最常用的多酚純化方法有液液萃取法、大孔樹脂法和固相萃取法[4]。液液萃取法常用的溶劑有乙酸乙酯、乙醚和石油醚,乙酸乙酯萃取的提取物具有極好的抗氧化性[5]。對于多酚而言,大孔樹脂法的最適用樹脂和洗脫劑并不唯一,實驗篩選出的最適樹脂分別為D101、AB-8、NKA-9和NKA-Ⅱ[6-11];而最適洗脫液分別為體積分數不同的乙醇溶液和丙酮溶液[7,11-13]。固相萃取法是基于范德華力、氫鍵或者偶極相互作用對多酚吸附-解吸來進行純化的,在多酚純化中常使用C18作為吸附劑[14],Tian等[15]用C18柱純化糙米多酚,分離純化得到11 種多酚。
實驗條件和樣品的不同給方法之間的比較造成困難,目前對同一樣品不同純化方法的比較研究較少,且不以糙米為研究對象,未涉及對其中單一酚酸的純化效果比較。本研究比較了液液萃取法、大孔樹脂法和固相萃取法對糙米多酚、總酚酸和其中9 種酚酸的回收率,旨在為明確目標物的最適純化方法篩選提供理論依據和技術支持。
1 材料與方法
1.1 材料與試劑
稻谷品種為松-237,購自江西南昌,收獲年份為2014年10月,于水分含量小于14%條件下進行稻谷的儲藏,經2014年12月壟谷、去除雜物獲得糙米于4 ℃避光保存。
綠原酸、咖啡酸、2,4-二羥基苯甲酸、丁香酸標準品、冰乙酸(色譜純) 上海阿拉丁生化科技股份有限公司;對羥基苯甲酸、對香豆酸、阿魏酸、香草酸、芥子酸、1,1-苯基-2-苦基肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,4,6-三吡啶基三嗪(2,4,6-tris(2-pyridyl)-s-triazine,TPTZ)標準品 美國Sigma-Aidrich公司;福林酚 上海藍季科技發展有限公司;大孔吸附樹脂(NKA-9、AB-8、S-8、NKA-Ⅱ)南開大學化工廠;D101大孔吸附樹脂 安徽三星樹脂科技有限公司。其余試劑均為分析純。
1.2 儀器與設備
AK/QC-058飛鴿牌離心機 上海安亭科學儀器廠;T6新世紀紫外-可見分光光度計 北京普析通用儀器有限公司;FBC1001超純水機 青島富勒姆科技有限公司;RE-52C旋轉蒸發儀 上海亞榮生化儀器廠;AR224CN電子天平 奧豪斯儀器(上海)有限公司;SHB-Ⅲ循環水式多用真空泵 山東省菏澤市祥龍電子科技有限公司;SHZ-82數顯恒溫振蕩器 江西省金壇市榮化儀器公司;QL-866漩渦混合器 海門市其林貝爾儀器制造有限公司;Sep-Pak Vac 20cc(5 g)C18固相萃取柱 美國Waters公司;1260 Infinity高效液相色譜(high performance liquid chromatography,HPLC)儀美國安捷倫公司。
1.3 方法
1.3.1 糙米多酚的提取
糙米粉碎后過60 目篩得糙米粉,糙米粉與預冷80%丙酮溶液按1∶4(g/mL)混合浸提24 h。抽濾得濾液,殘渣繼續用相同方法再提取1 次。合并濾液,在45 ℃條件下旋轉蒸發至無丙酮味,定容至一定體積后于-20 ℃貯存備用,此為糙米多酚粗提液。
1.3.2 液液萃取純化
將5 mL糙米多酚粗提液、20 mL乙酸乙酯依次加入50 mL離心管中,振搖均勻,3 500 r/min條件下離心10 min,收集上層乙酸乙酯部分,殘液繼續用相同方法再提取2 次,合并3 次提取液,45 ℃條件下減壓旋 干后加少量去離子水將其進行超聲溶解,轉移至10 mL容量瓶中,定容至10 mL,得液液萃取純化液。
1.3.3 大孔樹脂純化[16]
1.3.3.1 大孔樹脂的篩選
準確稱取預處理后的5 種型號樹脂(NKA-9、AB-8、S-8、D101、NKA-Ⅱ)各1.0 g分別置于250 mL錐形瓶中,各加入50 mL糙米多酚粗提液,封口后置于25 ℃水浴搖床振蕩24 h后測定此時溶液 中糙米多酚總質量濃度,計算吸附量。將吸附后樹脂過濾,再各用50 mL 95%乙醇溶液解吸吸附后樹脂,振蕩解吸24 h得解吸液,解吸液旋干后用去離子水定容至10 mL,測定解吸液中多酚含量,計算解吸量和解吸率。通過吸附量和解吸率篩選出適合純化糙米多酚粗提液的樹脂。
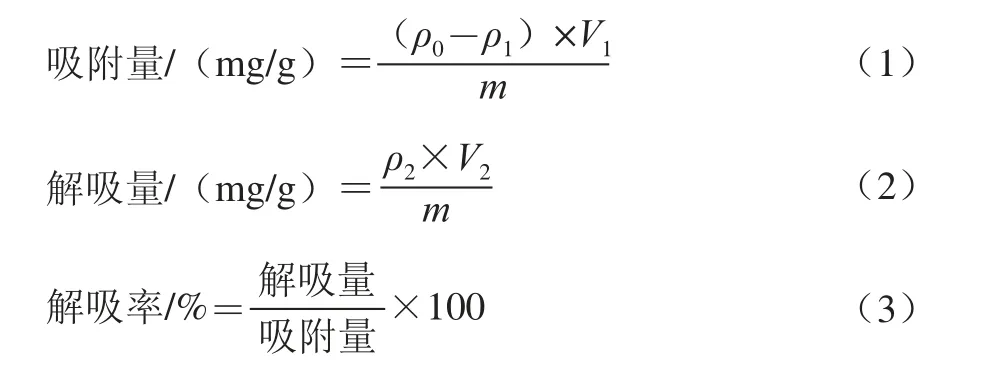
式(1)~(3)中:ρ0為吸附前糙米多酚粗提液多酚質量濃度/(mg/mL);ρ1為吸附后糙米多酚粗提液中剩余多酚質量濃度/(mg/mL);V1為糙米多酚粗提液體積/mL;m為樹脂干質量/g;ρ2為解吸液多酚質量濃度/(mg/mL);V2為解吸液體積/mL。
1.3.3.2 靜態吸附動力學特性測定
準確稱取1 g樹脂,置于250 mL錐形瓶中,樹脂型號由1.3.3.1節實驗確定,并向其加入35 mL質量濃度為0.47 mg/mL的糙米多酚粗提液,25 ℃水浴搖床上振蕩吸附24 h,繪制靜態吸附動力學曲線。
1.3.3.3 洗脫液極性對樹脂解吸性能的影響
按1.3.3.1節實驗條件進行吸附,吸附完全后,用選定的洗脫液進行洗脫。收集解吸液,測定其多酚含量,計算解吸率,考察洗脫液極性對樹脂解吸性能的影響,其中最適方法得到的為大孔樹脂純化液。
1.3.4 固相萃取純化
C18小柱用20 mL甲醇沖洗2 次進行活化,再用20 mL超純水沖洗2 次,此為固相萃取柱的預處理。將不同體積(5、10 mL)的樣液加入預處理過的固相萃取柱,然后加入40 mL去離子水除去未吸附雜質,最后用20 mL乙醇洗脫3 次,合并3 次解吸液在45 ℃條件下旋轉蒸發至干后用去離子水定容至10 mL得固相萃取純化液。
1.3.5 多酚回收率及純度的測定[17]
于10 mL比色管中加入1 mL去離子水和250 μL純化液或不同稀釋梯度的阿魏酸溶液,加入250 μL Folin-Ciocalteu福林酚試劑反應6 min。然后加入2.5 mL 7%的碳酸鈉溶液終止反應,加入去離子水至刻度后混合均勻。于室溫條件下避光放置90 min后,在波長760 nm處用紫外分光光度計測定吸光度。以阿魏酸含量與吸光度線性關系作為標準曲線,多酚含量以阿魏酸的質量表示。
分別按式(4)、(5)計算多酚回收率以及多酚純度。

式中:ρ1為該純化方法對應的純化液多酚質量濃度/(mg/mL);ρ0為糙米多酚粗提液多酚質量濃度/(mg/mL);V1為該純化方法對應得到的純化液液體積/mL;V0為純化時所取糙米多酚粗提液體積/mL。
1.3.6 抗氧化性測定
1.3.6.1 DPPH法測定糙米多酚的體外抗氧化活性[18]
準確稱取DPPH 7.9 mg,用95%乙醇溶液溶解,定容于100 mL容量瓶中,得2.0×10-4mol/L的溶液,避光備用。于比色管中加入3 mL DPPH溶液和1 mL純化液或1 mL水或1 mL不同稀釋梯度的阿魏酸標準溶液,充分搖勻溶液,在背光處靜置30 min,用1 mL去離子水和3 mL 95%乙醇溶液調零,于517 nm波長處測定其吸光度。多酚純化物對DPPH自由基清除率按式(6)計算。
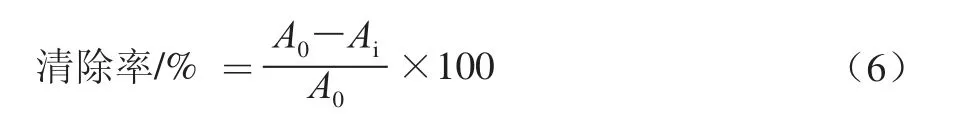
式中:Ai為3 mL DPPH溶液+1 mL純化液或不同稀釋梯度的阿魏酸標準溶液的吸光度;A0為3 mL DPPH溶液+1 mL去離子水的吸光度。
以阿魏酸含量與DPPH自由基清除活性線性關系作為標準曲線,純化液的DPPH自由基清除活性以阿魏酸的物質的量來表示。
1.3.6.2 FRAP法測定糙米多酚的鐵還原力[19]
將NaAc-HAc緩沖液(pH 3.6,300 mmol/L)、10 mmol/L TPTZ(40 mmol/L HCl溶液配制)和12.024 mmol/L FeCl3溶液按體積比25∶2.5∶2.5配制而成FRAP試劑。取0.5 mL純化液或不同稀釋梯度的阿魏酸,加入2 mL FRAP試劑,混勻后在37 ℃水浴條件下反應10 min,測定593 nm波長處吸光度,用去離子水調零,以阿魏酸含量與吸光度線性關系作為標準曲線,樣品多酚的鐵還原力以阿魏酸的物質的量來表示。
1.3.7 HPLC檢測分析
1.3.7.1 酚酸標品標準曲線繪制
用50%甲醇分別配制15、30、75、120、150 μg/mL 9 種酚酸標準品(對羥基苯甲酸、香草酸、咖啡酸、2,4-二羥基苯甲酸、丁香酸、對香豆酸、阿魏酸、芥子酸、綠原酸),以標準品質量濃度為橫坐標,峰面積為縱坐標繪制標準曲線。
1.3.7.2 多酚樣品的HPLC檢測分析
將糙米多酚粗提液和最優條件所得糙米多酚純化液于45 ℃旋轉蒸發至干,用5 mL 50%甲醇溶液將其溶解備用。
色譜條件:液相色譜柱:C18(4.6 mm×250 mm,5 μm);流動相:流動相A(0.1%乙酸)、流動相B(乙腈);紫外檢測波長:280 nm;流動相流速:0.8 mL/min;進樣量:20 μL;柱溫:30 ℃;線性洗脫程序如表1所示。

表1 HPLC 105 min線性洗脫程序Table1 HPLC 105-min linear elution program
2 結果與分析
2.1 不同純化方法的優化
2.1.1 液液萃取純化糙米多酚
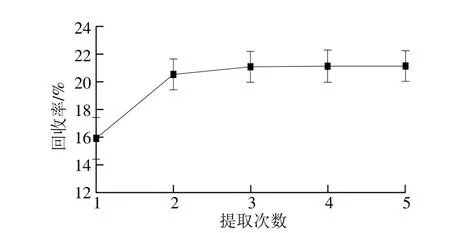
圖1 提取次數對糙米多酚回收率的影響Fig.1 Effect of extraction number on the extraction effi ciency of phenolics from brown rice
有機溶劑萃取法主要用于分離可溶 性酚類化合物。付曉燕等[20]得出氯仿、乙酸乙酯和正丁醇這3 種溶液中,乙酸乙酯是分離燕麥多酚最有效的試劑,其總酚回收率能達到60%~70%,Krygier等[21]也用乙酸乙酯對谷物中的多酚進行純化,所以本實驗用乙酸乙酯進行多酚粗提液的純化,由圖1可知,在用乙酸乙酯提取3 次后多酚的回收率基本穩定,為21.01%,所以采用乙酸乙酯提取3 次對糙米多酚粗提物進行純化。
2.1.2 大孔樹脂靜態純化糙米多酚
2.1.2.1 大孔樹脂的篩選從表2可以看出,5種樹脂中,吸附量由大到小依次為:S-8>NKA-Ⅱ>NKA-9>D101>AB-8。但吸附量最高的S-8樹脂其解吸率是5種樹脂中最低的,NKA-Ⅱ的解吸率最高,吸附率也較高。綜合考慮吸附及解吸兩方面因素,選擇NKA-Ⅱ、D101樹脂進行靜態動力學實驗,并篩選出合適的 解吸溶劑。
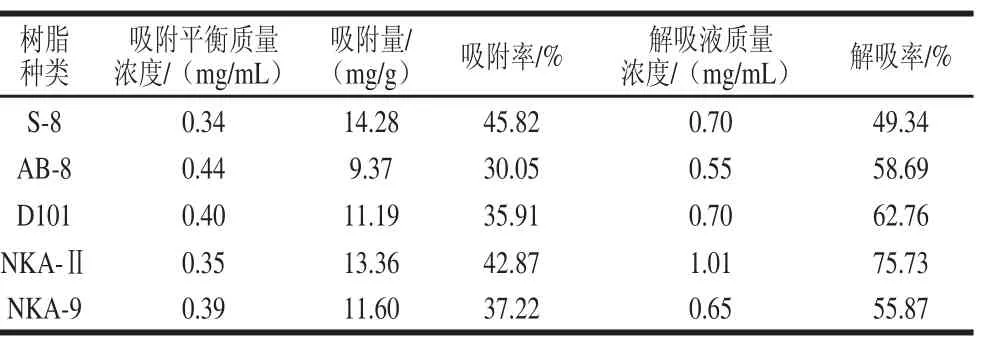
表2 5 種樹脂對糙米多酚的平衡吸附性質Table2 Equilibrium adsorbability of phenolics from brown rice by fi ve resins
2.1.2.2 D101、NKA-Ⅱ的靜態吸附動力學特性由圖2可看出,D101對多酚的吸附為快速平衡型,吸附起始階段吸附量較大,0.5 h時已經能達到23.21%,但是其吸附不穩定,12 h后其吸附率降為27.72%;NKA-Ⅱ雖然達到吸附平衡的時間較長,但最終吸附率較大,最大吸附率能達到53.44%,所以選用NKA-Ⅱ作為大孔吸附樹脂。

圖2 D101、NKA-Ⅱ的靜態吸附動力學曲線Fig.2 Static absorption kinetic curves of D101 and NKA-Ⅱ
2.1.2.3 洗脫液極性對樹脂解吸性能的影響

表3 NKA-Ⅱ的靜態解吸實驗(n=3)Table3 Static desorption capacity of NKA-Ⅱ (n=3) %
由表3可看出,解吸率隨解吸溶劑極性變化而變化,其中70%乙醇溶液解吸液最高。
2.1.3 固相萃取純化糙米多酚
固相萃取法是利用固體吸附劑吸附液體樣品中的目標物,使目標物與樣品的基體和干擾化合物分離,然后再用洗脫液洗脫,達到分離和富集目標物的目的[22]。由圖3可知,5 mL樣液比10 mL樣液上樣解吸后所得的總回收率更高,所以選用5 mL的上樣量。洗脫2 次與洗脫3 次回收率無明顯變化,所以采用洗脫2 次進行糙米多酚粗提物的純化。
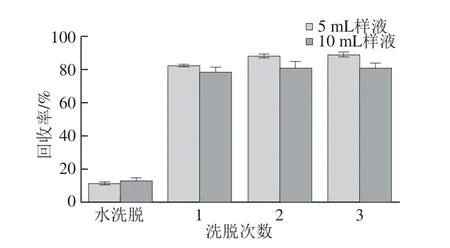
圖3 洗脫次數對糙米多酚回收率的影響Fig.3 Effect of elution number on the extraction effi ciency of phenolics from brown rice
2.2 不同純化方法的比較
2.2.1 不同純化方法對多酚的回收率、抗氧化性比較
液液萃取、大孔樹脂和固相萃取純化其多酚回收率與抗氧化性的測定結果見表4。

表4 3種純化方法的多酚回收率、抗氧化性、多酚純度比較Table4 Phenolics yield, antioxidant activity and polyphenols purity by three purifi cation methods
表4表明,不同純化方法其多酚回收率差異很大,液液萃取法回收率最小為20.51%,大孔樹脂法53.45%,固相萃取法回收率最大為87.87%,是最佳純化方法。乙酸乙酯純化法多酚回收率最小,可能是由于乙酸乙酯是液液萃取,水溶性多酚由水相轉移至有機相的量有限,所以導致其對多酚的回收率并不高。多酚純度經過乙酸乙酯、大孔樹脂和固相萃取純化后由粗提物的19.23%分別提高到40.72%、46.84%和78.71%。

表5 各純化物的多酚含量與抗氧化能力之間的線性相關分析Table5 Linear correlation analysis between phenolics extraction yield and antioxidant activity
從表5可以看出,多酚含量與DPPH自由基清除能力、鐵還原力之間顯著相關(P<0.01),說明糙米中主要抗氧化物質為多酚。
2.2.2 不同純化方法對糙米總酚酸的回收率比較
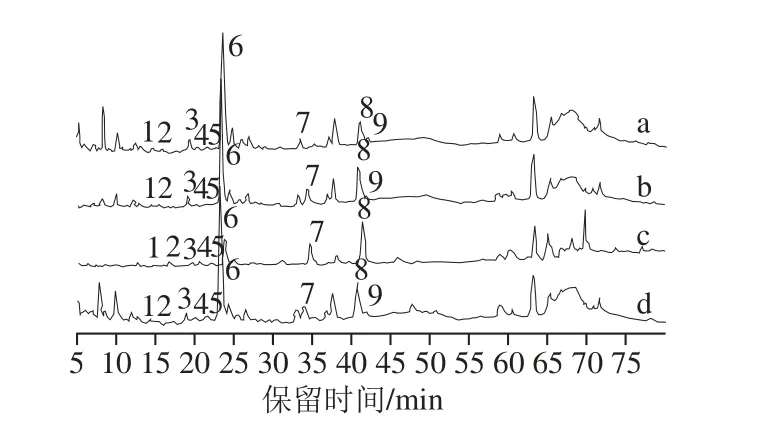
圖4 糙米多酚及其純化物的HPLC圖Fig.4 HPLC of crude and purifi ed phenolics from brown rice
圖4為不同純化方法的純化物的HPLC圖,依據各酚酸峰面積對其酚酸組分含量進行分析計算,得到各純化物的總酚酸回收率(表6)。
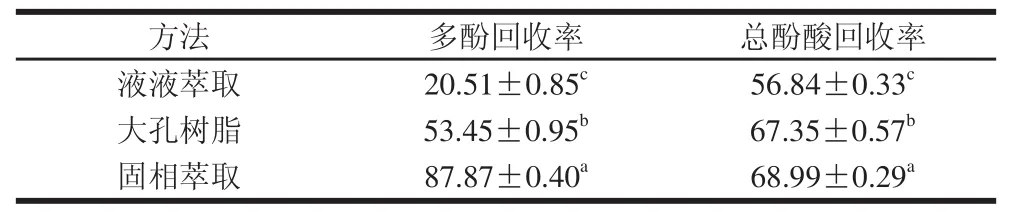
表6 各純化物的多酚、總酚酸回收率比較Table6 Extraction yields of phenolics and phenolic acids by three purifi cation methods%
比較表6中乙酸乙酯、大孔樹脂和固相萃取3 種純化方法多酚回收率,發現差異很大,分別為20.51%、53.45%、87.87%,但是總酚酸回收率相近,分別為56.84%、67.35%、68.99%。這說明3 種純化方法對糙米多酚粗提物中非酚酸多酚的提取效率相差很大,從而導致了多酚回收率的差異。
根據HPLC條件,圖4中45~75 min的大量未確認物質,可能是非酚酸物質。3 種純化方法在這段的出峰面積各不相同、差異較大,其出峰面積大小與多酚回收率的數據比較,趨勢一致。糙米多酚粗提物中非酚酸物質主要由黃酮、黃酮糖苷等組成,有待后續采用液質聯用對其進行進一步的分析鑒定。
文獻[23]對2010年前發表的所有糙米多酚含量的數據進行了統計,不同種類糙米多酚的含量范圍為24.0~252.4 mg沒食子酸當量/100 g谷粉,其中HPLC測得的12 種酚酸的含量為(3.74±2.26)mg/100 g谷粉,總類黃酮含量為30.0~293.0 mg兒茶素當量/100 g谷粉,花青素含量為2.00~3.26 mg矢車菊素當量/100 g谷粉。該文獻分析認為造成差異的原因是糙米品種的不同,但文獻未說明不同數據的純化方法。
本實驗數據說明針對同種谷物,純化方法不同將導致其提取物中非酚酸多酚物質回收率差異很大,說明文獻報道的不同種類全谷物總類黃酮含量和花青素含量的差異,純化方法也可能是造成差異的原因之一。
2.2.3 不同純化方法對糙米各酚酸的回收率比較
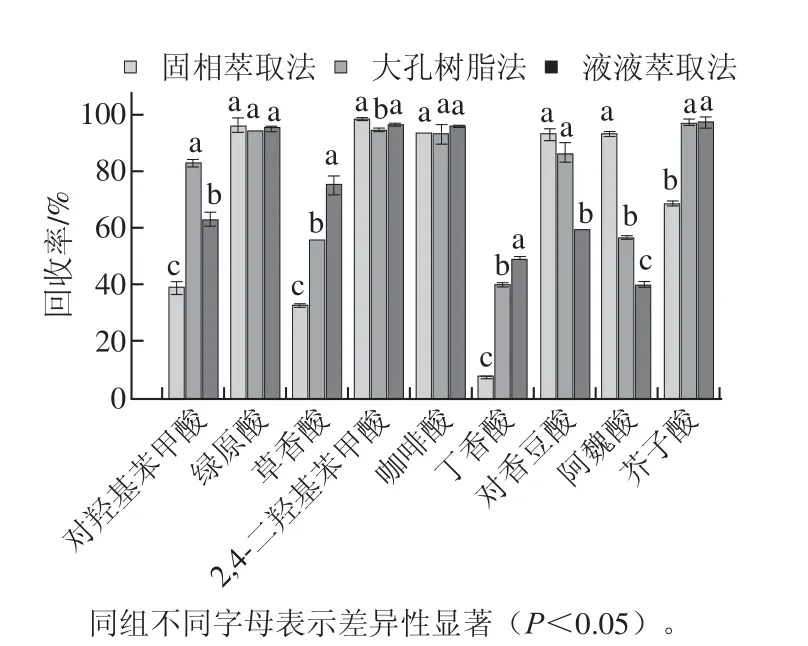
圖5 糙米各酚酸的回收率Fig.5 Recoveries of individual phenolic acids from brown rice
根據純化物各酚酸的HPLC峰面積比較了3 種純化物中9 種酚酸的回收率,結果見圖5。分析數據可知,使用不同純化方法酚酸回收率往往有顯著的差異(P<0.05),根據總多酚或者總酚酸回收率高低來選擇純化方式,可能得到的是不合適的純化前處理方法。
例如主要多酚物質阿魏酸在使用液液萃取、大孔樹脂和固相萃取3 種純化方法后多酚回收率分別為93.54%、56.74%和40.35%,具有顯著差異性(P<0.05),對阿魏酸最適合的純化方法應該為總多酚回收率最低的液液萃取法。每種酚酸都有最適純化方法,應該依據酚酸的回收率大小來選擇最適純化方法。表7為各酚酸的最適純化方法及相應回收率。
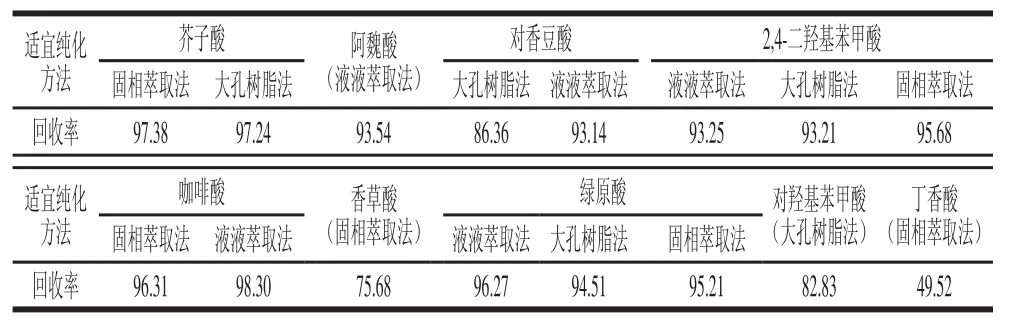
表7 各酚酸的適宜純化方法及相應回收率Table7 Comparison of purifi cation and recovery of individual phenolic acids by two different purifi cation methods%
3 結 論
3 種純化方法的多酚回收率和抗氧化性有顯著差異(P<0.05),總酚酸回收率則相近。其中液液萃取、大孔樹脂和固相萃取3 種純化方法的多酚回收率分別為20.51%、53.45%、87.87%,且多酚含量與DPPH自由基清除能力、鐵還原能力之間顯著相關(P<0.01),說明粳米糙米中主要抗氧化物質為多酚;而3 種方法的總酚酸回收率相近,分別為56.84%、67.35%、68.99%。
大量文獻針對不同品種糙米多酚含量進行了分析比較,目前國內外對造成不同種類糙米多酚含量差異的原因,基本歸結為糙米品種的不同,針對純化方法導致糙米多酚含量差異的研究未見報道。本實驗數據說明針對同種谷物,純化方法不同往往導致其提取物中非酚酸多酚物質回收率差異較大,是造成多酚含量差異的重要原因之一。
雖然3 種提取方法總酚酸回收率相近,但是通過比較3 種純化物中9 種酚酸的回收率數據,發現不同純化方法酚酸回收率往往有顯著的差異(P<0.05)。在針對某種具體的酚酸種類進行最適純化方法選擇時,根據總多酚或者總酚酸回收率高低來選擇純化方式,可能得到的是不合適的純化前處理方法。每種酚酸都有相應的最適純化方法,依據純化的目標物回收率來進行純化方法的篩選,能夠大大減少目標物的損失。
[1] LIU R H. Whole grain phytochemicals and health[J]. Journal of Cereal Science, 2007, 46(3): 207-219.
[2] MASSARETTO I L, ALVES M F M, de MIRA N V M, et al. Phenolic compounds in raw and cooked rice (Oryza sativa L.) and their inhibitory effect on the activity of angiotensin Ⅰ-converting enzyme[J]. Journal of Cereal Science, 2011, 54(2): 236-240.
[3] PHETPORNPAISAN P, TIPPAYAWAT P, JAY M, et al. A local Thai cultivar glutinous black rice bran: a source of functional compounds in immunomodulation, cell viability and collagen synthesis, and matrix metalloproteinase-2 and-9 inhibition[J]. Journal of Functional Foods, 2014, 7: 650-661.
[4] DAHER S, Gü LA? AR F O. Analysis of phenolic and other aromatic compounds in honeys by solid-phase microextraction followed by gas chromatography?mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2008, 56(14): 5775-5780.
[5] NACZK M, SHAHIDI F. Extraction and analysis of phenolics in food[J]. Journal of Chromatography A, 2004, 1054(1): 95-111.
[6] 吳國宏, 熊何健. 荔枝葉中多酚類物質的提取制備[J]. 食品科學, 2007, 28(6): 131-135.
[7] 蒲博, 李兵, 楊舒慧, 等. 石榴皮多酚分離純化及對脂肪酸合成酶抑制作用的研究[J]. 食品科學, 2014, 35(17): 99-103. doi: 10.7506/ spkx1002-6630-201417020.
[8] 劉榮, 何嬌, 王振宇. 大孔樹脂對樟子松樹皮多酚的純化工藝的研究[J]. 食品工業科技, 2013, 34(11): 201-205.
[9] 侯方麗, 張名位, 蘇東曉, 等. 黑米皮花色苷的大孔樹脂吸附純化研究[J]. 華南師范大學學報: 自然科學版, 2009(1): 100-104.
[10] 王雅. 沙棗果實可食部分活性物質提取及抗氧化, 抗腫瘤作用研究[D].楊凌: 西北農林科技大學, 2012.
[11] 張名位, 郭寶江, 池建偉, 等. 黑米皮抗氧化活性物質的提取與分離工藝研究[J]. 農業工程學報, 2005, 21(6): 135-139.
[12] 蘇東曉. 荔枝果肉多酚的分離鑒定及其調節脂質代謝作用機制[D].武漢: 華中農業大學, 2014.
[13] 王振宇, 劉春平. 大孔樹脂AB-8對蘋果多酚的分離純化[J]. 食品研究與開發, 2009, 30(4): 21-24.
[14] LIBERATORE L, PROCIDA G, D’ALESSANDRO N, et al. Solid-phase extraction and gas chromatographic analysis of phenolic compounds in virgin olive oil[J]. Food Chemistry, 2001, 73(1): 119-124.
[15] TIAN S, NAKAMURA K, CUI T, et al. High-performance liquid chromatographic determination of phenolic compounds in rice[J]. Journal of Chromatography A, 2005, 1063(1): 121-128.
[16] 劉清, 李虎虎, 姚惠源, 等. 大孔吸附樹脂分離富集大麥多酚的研究[J].食品科學, 2008, 28(11): 98-102.
[17] SINGLETON V L, ORTHOFER R, LAMUELA-RAVENTOS R M. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent[J]. Methods in Enzymology, 1999, 299(14): 152-178.
[18] SHIMADA K, FUJIKAWA K, YAHARA K, et al. Antioxidative properties of xanthan on the antioxidantion of soybean oil in cyclodextrin emulsion[J]. Journal of Agricultural and Food Chemistry, 1992, 40(6): 945-948.
[19] HUANG X, TU Z, JIANG Y, et al. Dynamic high pressure microfluidization-assisted extraction and antioxidant activities of lentinan[J]. International Journal of Biological Macromolecules, 2012, 51(5): 926-932.
[20] 付曉燕, 隋勇, 謝筆鈞, 等. 燕麥多酚純化、發芽燕麥不同組分的多酚分布及抗氧化活性[J]. 食品工業科技, 2014, 35(8): 83-87.
[21] KRYGIER K, SOSULSKI F, HOGGE L. Free, esterified, and insoluble-bound phenolic-acids.1. extraction and purification procedure[J]. Journal of Agricultural and Food Chemistry, 1982, 30(2): 330-334.
[22] 李存法, 何金環. 固相萃取技術及其應用[J]. 天中學刊, 2005, 20(5): 13-16.
[23] GOUFO P, TRINDADE H. Rice antioxidants: phenolic acids, fl avonoids, anthocyanins, proanthocyanidins, tocopherols, tocotrienols, γ-oryzanol, and phytic acid[J]. Food Science and Nutrition, 2014, 2(2): 75-104.
A Comparative Study of Three Purifi cation Methods for Phenolics from Brown Rice
LUO Shunjing, ZHANG Meimei, GONG Ersheng, LIU Chengmei*, GENG Qin, ZENG Zicong, MA Ye
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
The phenolics in brown rice were purified with liquid extraction, macroporous resin method and solid phase extraction method, respectively. The recovery of polyphenol and antioxidant activity were studied. The recoveries of total phenolic acids and nine individual compounds were analyzed by HPLC. The recoveries of polyphenols purifi ed with the above purifi cation methods were 20.51%, 53.45% and 87.87%, respectively, whereas the recoveries of total phenolic acids with the three purifi cation methods were 56.84%, 67.35% and 68.99%, respectively. The purity of polyphenols from brown rice was increased from 19.23% to 40.72%, 46.84% and 78.71%, respectively. Polyphenol content displayed significant correlations with 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging ability and ferric reducing ability of plasma (FRAP) (P < 0.01). Except for the rice varieties, the purification methods resulted in a large difference in the phenolic content by infl uencing the recovery of non-phenolic acid polyphenols. The purifi cation methods had a signifi cant infl uence on the recovery of phenolic acids. Thus, the appropriate method should be chosen by recovery of the targets but not by the recovery of total polyphenols or total phenolic acids.
brown rice; polyphenol; purifi cation; high performance liquid chromatography (HPLC)
TS201.1
A
1002-6630(2015)20-0157-06
10.7506/spkx1002-6630-201520030
2015-06-01
江西省贛鄱英才555工程領軍人才項目(18000007);南昌大學食品科學與技術國家重點實驗室目標導向項目(SKLF-ZZA-201304)
羅舜菁(1969—),女,副教授,碩士,研究方向為現代高新技術與食品加工工程。E-mail:luoshunjing@aliyun.com
*通信作者:劉成梅(1963—),男,教授,博士,研究方向為食物資源利用與開發。E-mail:liuchengmei@aliyun.com

