香菇中粗多糖含量測定的方法比較
◎何東慧 郭曉燕
(譜尼測試集團股份有限公司,北京 100000)
香菇,又名香菌、花菇、冬菇、香蕈等,俗稱中國蘑菇,是一種重要的食藥用栽培真菌。香菇肉質肥厚細嫩,味道鮮美,香氣獨特,營養豐富,是一種食藥同源的食物,具有很高的營養、藥用和保健價值。隨著人們生活水平的提高,香菇食品、藥品、保健品等制品將日益受到人們的青睞。
多糖是由多個單糖分子縮合、失水而成,是一類分子機構復雜且龐大的糖類物質。它包括有淀粉、纖維素、糖元等。一般檢測的粗多糖并不包含所有的多糖,是指從植物、中草藥或真菌中提取的活性多糖,具有水溶性。隨著分子生物學的發展,人們逐漸認識到多糖具有極其重要的生物功能。多糖與免疫功能的調節、細胞與細胞的識別、細胞間物質的轉運、癌癥的診斷與治療等都有著密切的關系,近年來又發現多糖的糖鏈能控制細胞的分裂和分化、調節細胞的生長和衰老。
關于食用菌中粗多糖測定的方法沒有國家標準,只有一個農業部推薦的方法。另外,《保健食品功效成分檢測方法》介紹了幾種粗多糖的測定方法。本文就香菇中粗多糖含量的測定方法:農業部推薦方法和《保健食品功效成分檢測方法》中苯酚-硫酸法進行了一些介紹和討論。
1 材料與方法
1.1 材料與試劑
(1)干香菇;
(2)硫酸;
(3)無水乙醇;
(4)苯酚;
(5)80%乙醇溶液;
(6)葡萄糖,使用前應于105℃烘干至恒重;
(7)80%苯酚溶液;
(8)5%苯酚溶液:吸取5mL苯酚溶液(2.1.7),溶于75mL水中,混勻,現用現配;
(9)100mg/L標準葡萄糖溶液:稱取0.1000g葡萄糖(2.1.6)于100mL燒杯中,加水溶解,定容至1000mL,置4℃冰箱中貯存。
1.2 儀器
紫外可見分光光度計;分析天平,感量為0.001g;超聲提取器;離心機。
1.3 實驗方法
1.3.1 實驗原理
在硫酸作用下,粗多糖先水解為單糖,單糖迅速脫水生成糖醛衍生物,該衍生物與苯酚反應生成的溶液在490nm下有特征吸收,以此測定樣品中粗多糖含量。
1.3.2 樣品的提取
方法一:稱取0.5g左右粉碎過20mm孔徑篩的樣品,置于50mL具塞離心管內,加5mL水浸潤樣品,然后緩慢加入20mL無水乙醇(即溶液中乙醇的濃度為80%),使用渦旋振蕩器振搖,使混合均勻,于4℃冰箱中靜置4小時以上,在以4000r/min離心5min,棄去上清液。不溶物用10mL乙醇溶液洗滌、離心。用水將上述不溶物轉移入圓底燒瓶,加入50mL蒸餾水,裝上磨口的空氣冷凝管,于沸水浴中提取2h。冷卻至室溫,過濾,將上清液轉移至100mL容量瓶中,用水洗滌殘渣2~3次,洗滌液轉至容量瓶中,加水定容。此溶液為樣品測定液。
方法二:稱取混合均勻的樣品1.0~2.0g,置于100mL容量瓶中,加水80mL左右,于沸水浴中加熱1小時,冷卻至室溫后補加水至刻度,混勻后過濾,棄去初濾液。準確吸取5mL濾液置于50mL離心管中,加入無水乙醇20mL,混勻,于4℃冰箱靜置4小時以上,以4000r/min離心5min,棄去上清液,殘渣用80%乙醇溶液10mL洗滌,離心后棄去上清液。殘渣用水溶解并定容至50mL。此溶液為樣品溶液。
線性方程為y=9.418 4x+0.008 3,R2=0.999 6
1.3.3 標準曲線
方法一:分別吸取0、0.2、0.4、0.6、0.8、1.0mL的標準葡萄糖工作溶液置于20mL具塞玻璃試管中,用蒸餾水補至1.0mL。向試液中加入1.0mL苯酚溶液,然后快速加入5.0mL硫酸(與液面垂直加入,勿接觸試管壁,以便與反應液充分混合),靜置10min。使用渦旋振蕩器使反應液充分混合,然后將試管放置于30℃水浴中反應20min,490nm測吸光值。以葡萄糖質量為橫坐標,吸光度為縱坐標,制定標準曲線。
方法二:吸取標準葡萄糖工作液的體積及試劑加入量同方法一,試劑加入后,置于沸水浴中加熱15min,冷卻后,同樣在490nm測吸光值。以葡萄糖質量為橫坐標,吸光度為縱坐標,制定標準曲線。
1.3.4 測定
分別吸取方法一和方法二的樣品溶液1mL于20mL具塞試管中,分別按1.3.3步驟操作,測定吸光度。同時做空白試驗。
1.3.5 結果計算
樣品中粗多糖含量按下面兩個公式計算。
方法一:
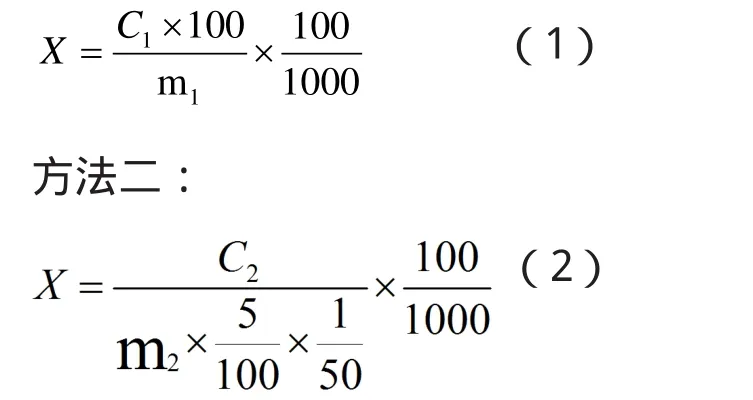
其中:X—樣品中粗多糖含量,g/100g;
C1—方法一中從標準曲線上查得樣品定容液中含糖量,mg;
C2—方法二中從標準曲線上查得樣品定容液中含糖量,mg;
m1—方法一中樣品質量,g;
m2—方法二中樣品質量,g。
2 結果與分析
2.1 兩種方法標準曲線的繪制
按照上述方法要求,分別繪制方法一和方法二的標準曲線。標準序列分別見表1和表2,曲線線性圖見圖1和圖2。從圖1和圖2看出,方法二的線性要比方法一線性好。

表1 方法一葡萄糖標準序列表

圖1 方法一葡萄糖標準曲線
線性方程為y=9.139 7x+0.002 3,R2=0.996 4

表2 方法二葡萄糖標準序列表
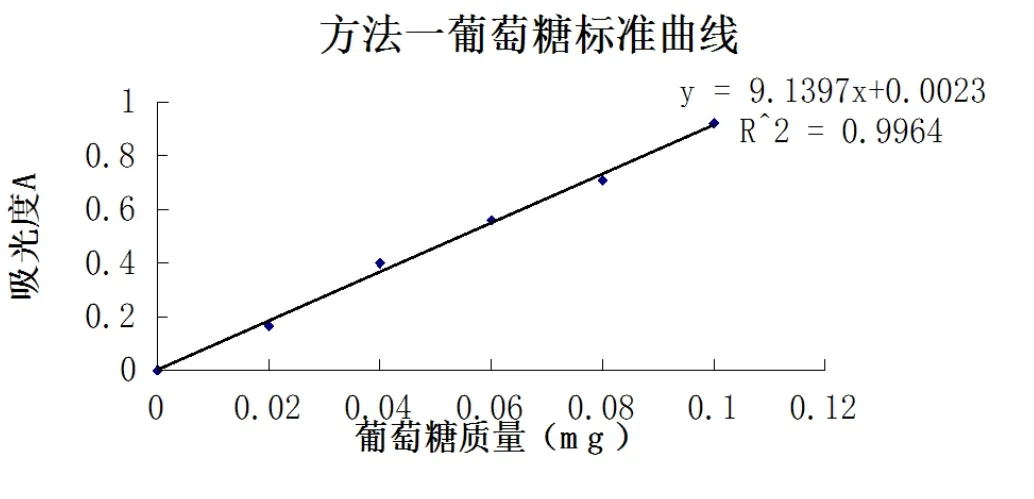
圖2 方法二葡萄糖標準曲線
2.2 兩種方法的精密度分析
按照上述兩種方法分別測定同一個干香菇樣品,測定結果見表3。通過數據比較得出,兩種方法測定結果比較接近,但方法二的精密度較高。
2.3 兩種方法的準確度分析
分別對兩種方法進行加標回收實驗,實驗數據見表4。由于加入葡萄糖標準溶液為單糖溶液,再加入乙醇進行分離時,葡萄糖很容易被分離出去,故標品均在顯色前加入,所以兩種方法的準確度都很好。

表3 樣品測定結果

表4 樣品加標回收實驗
2.4 兩種測定法的比較
從分析結果來看,兩種方法測定結果沒有明顯的差異。下面對這兩種方法的區別、優缺點分別進行分析。

表5 兩種測定方法的區別
2.4.1 兩種測定方法的區別
兩種測定方法的區別見表5。
2.4.2 兩種方法優缺點
兩種方法的優缺點見下表6。

表6 兩種方法優缺點
3 結論
香菇中粗多糖的測定方法比較簡單,但實際操作過程比較麻煩,要注意的方面很多。比色法測定多糖并非特異性反應,方法靈敏度高,在測定過程中會出現偏差較大的結果,主要是操作不夠嚴謹所致,反復沉淀、洗滌、棄上清液、樣液的轉移等都是造成測定結果偏差的原因。在操作過程中要多思考,控制好操作過程,這樣才能得到較好的實驗結果。
[1]王國佳,曹紅.香菇多糖的研究進展[J].解放軍藥學學報,2011(5):451-455.
[2]李月梅.香菇的研究現狀及發展前景[J].微生物學通報,2005(4):149-152.
[3]張軍霞,胡喜巧.香菇多糖幾種提取方法的比較[J].河南科技學院學報:自然科學版,2008(1):45-49.
[4]郭金龍,陳有君.苯酚-硫酸法的改進發展[J].食品科學,2008(12):555-558.
[5]王超,張曜武.苯酚-硫酸法測定杏鮑菇多糖方法的研究[J].天津化工,2011(6).
[6]白鴻.保健食品功效成分檢測方法[M].北京:中國中醫藥出版社,2011.
[7]耿安靜,陳健.香菇精多糖乙醇沉淀規律的研究[J].食品科學, 2010(4):99-102.
[8]閆巧娟,韓魯佳,江正強,等.黃芪多糖分子量的分布研究[J].食品科學,2004(8):27-31.

