戶太八號葡萄酒本土酵母篩選*
葛含靜
(陜西學前師范學院生物科學與技術系,陜西 西安,710100)
葡萄酒中的芳香物質有上千種成分,對葡萄酒的風味有著非常重要的作用,是決定葡萄酒質量的重要因素之一[1-2]。其中,有400多種香氣成分是由酵母菌發酵產生的[3]。在葡萄酒的釀造過程中,酵母菌利用葡萄中的糖類進行代謝作用,生成酒精,同時形成許多風味物質,即形成葡萄酒特殊的發酵香氣。在參與葡萄酒釀造的多種酵母菌中,釀酒酵母(S.cerevisiae)最為重要[4]。在葡萄酒釀造的中期和后期,釀酒酵母大量存在,是葡萄酒釀造過程中的主要微生物,可修正酒精發酵過程中的香氣成分,還可產生特殊的發酵香氣[5]。不同的葡萄酒在發酵過程中接種的釀酒酵母不同,因而代謝途徑會有或多或少的差異,發酵香氣也會不同,從而使葡萄酒具有各自獨特的香氣特征[6-7]。葡萄酒原始的自然發酵是直接利用附著在葡萄果實上的酵母進行發酵,在此過程中,該地區特有的微生物菌群也參與了發酵,賦予葡萄酒特有的風味[8]。但自然發酵釀制的葡萄酒品質不穩定,各年份各批次之間差異較大[9]。于是,為了得到品質穩定的葡萄酒產品,目前,許多葡萄酒生產企業大量使用進口活性釀酒酵母,這樣雖然使葡萄酒的發酵速率和產品風味得以穩定,但卻大大降低了本土釀酒酵母對葡萄酒香氣成分的貢獻,導致我國葡萄酒在品種和風格上較為單一,品質同質化嚴重,地域特色不突出[10-12]。本土酵母適應產區當地的微環境,易于在葡萄酒發酵中占主導地位,還可以保證產區的典型特色[9,13]。因此,研究本土酵母的分離及其發酵特性對釀造具有地域特色的葡萄酒意義重大。
西安地區具有規模化的葡萄種植基地,蘊藏著豐富的本土酵母資源。戶太八號葡萄是西安地區特有的葡萄品種。通過對其自然發酵過程中釀酒酵母發酵特性的研究及酒樣品質的分析,選育出優勢釀酒酵母菌種,從而為生產具有本土特色的葡萄酒提供良好的菌種保證。
1 材料
1.1 實驗材料
2014年9月中旬從西安市白鹿原葡萄產區采集成熟的戶太八號葡萄果實,自然釀造制酒。商品釀酒酵母EC1118。
1.2 培養基
富集培養基[8]:葡萄糖50 g/L,(NH4)2SO42 g/L,KH2PO42.5 g/L,MgSO4·7H2O 1 g/L,FeSO4·7H2O 0.1 g/L,酵母膏0.5 g/L,滅菌后加Na2SO30.03 g/L。固體培養基需加2 g/L瓊脂。
分離培養基(YEPD培養基):酵母膏10 g/L,蛋白胨20 g/L,葡萄糖20 g/L。固體培養基需加2 g/L瓊脂。保藏培養基與活化培養基同分離培養基。
WL營養瓊脂培養基[14]:酵母浸粉 4 g/L,蛋白胨5 g/L,葡萄糖50 g/L,瓊脂20 g/L。無機鹽類:KH2PO40.55 g/L,KCl 0.425 g/L,CaCl20.125 g/L,MgSO40.125 g/L,FeCl30.025 g/L,MnSO40.002 5 g/L,溴酚綠0.022 g/L,pH5.5。
所有培養基均在121℃高壓滅菌15 min后備用,所有試劑均為分析純或生物純。
2 方法
2.1 酵母菌分離
將葡萄破碎,裝入2個2 L滅菌的發酵瓶,每瓶裝1 200 mL,25℃自然發酵,其中一瓶加入40 mg/L SO2作對照,做2組平行試驗。在發酵前、中、后期分別量取酒樣10 mL,加入到100 mL液體富集培養基中,25℃、170 r/min培養24 h,用無菌生理鹽水按不同濃度梯度稀釋,吸取0.2 mL,均勻涂布于分離培養基平板,25℃培養72 h,選擇菌落生長良好且密度適宜的平板,隨機挑取10~20個單菌落進行轉接,并多次劃線培養以獲得純酵母菌株,編號,4℃冰箱試管斜面保藏。
2.2 戶太八號葡萄酒本土酵母篩選
初篩:向大試管中加入杜氏發酵管,再加入25 mL葡萄汁,滅菌后按體積分數為3%接種量接入活化酵母,并加入40 mg/L SO2,25℃培養。以杜氏管法定時測定菌株的發酵力,篩選出產氣能力較強的菌株,并對酒液進行感官評定。以空白作對照。
復篩:將初篩得到的菌株按體積分數為3%接種量接入25 mL滅菌的新鮮戶太八號葡萄汁中,25℃培養72 h,測定發酵液的酒精度,進一步篩選產酒精能力強的菌株。
三級篩選:按體積分數為3%接種量分別向不同無水乙醇濃度(體積分數為6%、9%、12%、15%、18%)、SO2濃度(50、100、150、200、250 mg/L)的10 mL葡萄汁中接入活化的復篩酵母菌液,25℃培養48 h,以杜氏管法測定酵母的耐受力,全程定時測定發酵速率,篩選出耐酒精且耐SO2能力強的菌株。
2.3 菌種鑒定
表型鑒定[15-16]:菌株劃線接種于WL營養瓊脂培養基,25℃培養72 h,觀察其菌落形態,并記錄。取活化的菌株種子液,顯微鏡下觀察菌株個體形態。
分子生物學鑒定:采用珠磨法提取酵母基因組DNA[17-18]。以基因組DNA為模板,NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTGTTTCAAGACGG-3')為引物,擴增 26S rRNA D1/D2區域[19]。產物以2%瓊脂糖凝膠電泳檢測,由北京華大生物公司測序。序列在國際核酸數據庫(NCBI)中進行Blast同源性比對,用MEGA4繪制系統發育樹,結合表型特征確定其生物學地位。
2.4 發酵條件優化
向1 L葡萄汁中接入體積分數為3%菌株種子液,并加入40 mg/L SO2,分別在不同溫度條件下和不同pH值條件下恒溫發酵72 h,根據酒液酒精度大小確定最適發酵溫度和pH值。
向10 L葡萄汁中接入體積分數為3%的活化菌株種子液,并加入40 mg/L SO2,在最適發酵條件下發酵96 h,酒樣經5 000 r/min離心后,測定酒精度、還原糖、干浸出物、總酸、揮發酸、pH值等指標,以此小試發酵來驗證優化的發酵條件。以EC1118作對照。
2.5 香氣成分分析
取6 mL酒樣于20 mL樣品瓶中,40℃水浴15 min,插入經250℃老化40 min的萃取頭,頂空萃取35 min,將萃取頭插入GC進樣口,解析5 min。以EC1118作對照。
升溫程序:35℃保持4 min,以10℃/min升至110℃,保持6 min;再以5℃/min升至150℃,保持2 min;最后以7℃/min升至230℃,保持4 min。
色譜條件:色譜柱 DB-5MS(30 m×0.25 mm,0.25 μm),進樣口溫度250℃。載氣為高純He,流量1.0 mL/min。電離方式E1。電子能量70 eV。離子源溫度230℃.質量掃描范圍35~500 amu。用計算機檢索標準質譜庫NIST08和WILEY7對照分析并確認。
3 結果與分析
3.1 酵母菌分離
從戶太八號葡萄發酵的前、中、后期醪液中共篩選到135株酵母菌。
3.2 本土酵母篩選
初篩:由表1可知,有1株菌發酵10 h產氣滿管,5株菌發酵24 h產氣滿管,7株菌發酵48 h產氣滿管。搖動這13株菌的培養試管,均有淡淡酒香溢出。以這13株產氣能力較強的初篩菌株進行下一步試驗。
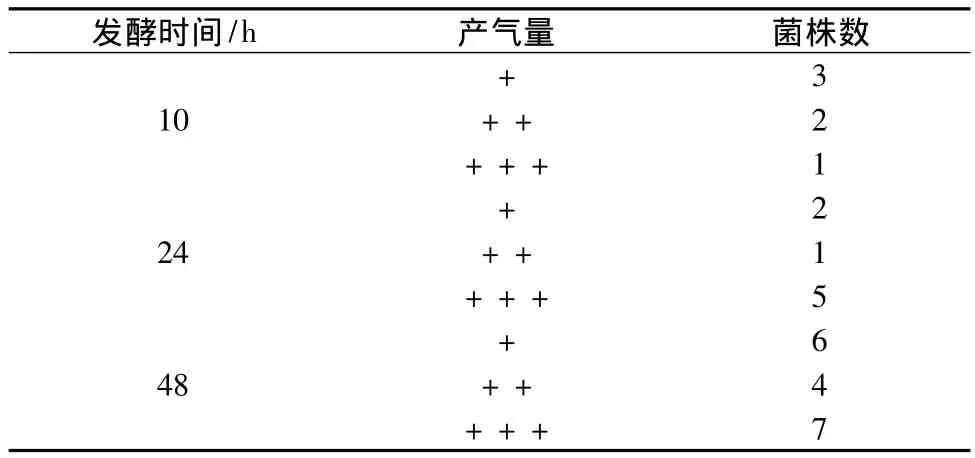
表1 酵母初篩Table 1 Result of preliminary screening
復篩:13株初篩菌株所釀酒液中,酒精度不足5%vol的有6株,5% ~6%vol的有3株,6% ~7%vol的有2株,高于7%vol的有2株。選擇所釀酒液酒精度高于5%的7株菌作為產酒精能力強的菌株,進入下一步試驗。
三級篩選:由表2可知,復篩得到的7株菌酒精耐受力均在9%vol以上;4株可耐受12%vol酒精度,3株可耐受15%vol酒精度,1株可耐受18%vol酒精度。在葡萄酒釀造中,SO2的添加量一般為60 mg/L[20]。因此,由表3可知,7株菌均滿足生產要求。

表2 耐酒精菌株篩選 單位:株Table 2 Screening of strains for alcohol tolerance
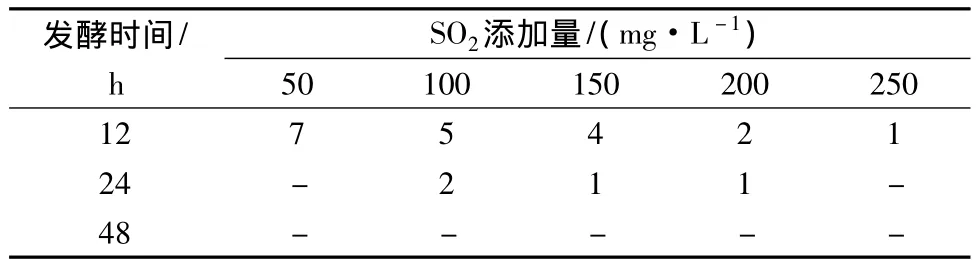
表3 耐SO2菌株篩選 單位:株Table 3 Screening ofstrains for SO2tolerance
綜合三級篩選和感官評定結果,以耐酒精度為18%、編號S37的菌株為目的菌株,即戶太八號葡萄酒本土酵母菌株。
3.3 菌種鑒定
酵母菌株S37在WL營養瓊脂培養基平板上的菌落形態如圖1A所示,呈奶油色,略帶淡綠,球形突起,表面光滑,不透明,具有典型釀酒酵母的形態特征。S37的個體形態如圖1(b)所示,為卵圓形,一端出芽生殖。
大量文獻表明,WL營養瓊脂培養基對葡萄酒自然發酵過程中的絕大多數酵母菌具有很好的鑒別力[21-22]。更有文獻表明,WL營養瓊脂培養基對釀酒酵母的鑒別準確度可達100%[23]。為了使鑒定結果更可靠,對菌株S37進行26S rRNA序列擴增及系統發育分析,如圖2和圖3,菌株S37與釀酒酵母AB733454.1同枝,親緣關系最近,相似度高達100%。結合菌株S37的表型特征可知,菌株S37為釀酒酵母。
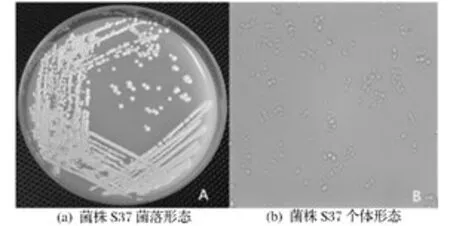
圖1 酵母菌株S37的菌落形態和個體形態Fig.1 Colony and microscopic characteristics of yeast S37
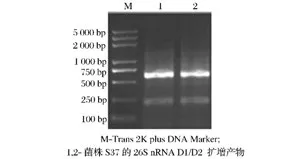
圖2 酵母菌株S37的26S rRNA D1/D2擴增產物Fig.2 Amplified products of 26S rRNA D1/D2 from yeast S37
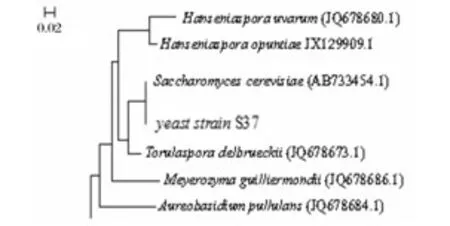
圖3 酵母菌株S37的系統發育樹Fig.3 Phylogenetic tree of yeast S37
3.4 發酵條件優化及酒樣品質分析
由圖4、圖5可知,菌株S37在24℃發酵和在pH 5.0條件下產酒精能力最強。經小試發酵試驗驗證,24℃、pH 5.0是菌株S37的最適發酵條件。在驗證試驗中,該菌株在發酵開始24 h內產氣,發酵開始48 h內產氣滿管,產酒精力為 7.5%vol,能耐受18%vol的酒精,SO2耐受性為 150 mg/L。
小試發酵結束后,取酒樣進行理化指標分析,結果如表4所示,菌株S37產酒能力與對照商品酵母EC1118僅相差0.4%vol酒精度,且各項理化指標均符合GB 1037—2006的要求。此外,菌株S37所釀酒液酒香濃郁,口感醇厚、協調。綜上,菌株S37的最適發酵條件為24℃、pH 5.0。
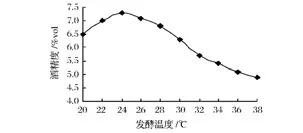
圖4 菌株S37發酵溫度優化Fig.4 Optimizing fermentation temperature for yeast S37
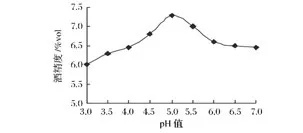
圖5 菌株S37發酵pH優化Fig.5 Optimizing fermentation pH for yeast S37

表4 葡萄酒理化指標Table 4 Properties of wine
3.5 酒樣香氣成分分析
菌株S37和商業菌株EC1118所釀酒液香氣成分分析GC-MS總離子圖分別如圖6和圖7所示。利用氣相色譜峰面積歸一化法計算出各化學成分的相對含量,見表5。
圖6 菌株S37所釀酒液香氣成分GC-MS圖Fig.6 The GC-MS total ion chromatogram of aromatic components in wine made by strain S37
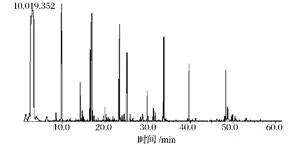
圖7 菌株EC1118所釀酒液香氣成分GC-MS圖Fig.7 The GC-MS total ion chromatogram of aromatic components in wine made bycontrast strain EC1118
由表5可知,菌株S37和商業菌株EC1118所釀的葡萄酒中分別檢出了67種與53種揮發性化合物,主要香氣物質均為高級醇、酯及酸。相對于菌株EC1118,菌株S37所釀葡萄酒的主要優勢含量香氣成分(在對照組未檢出)有18種,其中2-庚醇、2-辛醇、9-癸烯-1-醇、壬醛、異戊酸乙酯、乙酰苯、苯并噻唑、2-乙酰基呋喃等香氣較好,且含量以絕對優勢勝過對照組;正己醇、苯乙醇、乙酸異戊酯、乙酸苯乙酯、2-甲基四氫噻吩-3-酮、β-突厥烯酮等香氣優雅,含量也高于對照組。由各種香氣成分及特有比例,形成了菌株S37所釀葡萄酒的獨特風味。
4 結論
本研究戶太八號葡萄的自然釀造醪液中分離出135株酵母菌,經篩選,最終獲得了適合戶太八號桃紅葡萄酒釀造的釀酒酵母S37。該菌株是兼性厭氧菌,無氧條件下亦能發芽生長;釀酒起酵快,產生的泡沫細膩,發酵平穩,且不產生H2S;向酒樣中下明膠后澄清速度快且效果好,酒腳壓實程度良好;發酵所產酒樣各項理化指標均接近商業菌株EC1118,香氣濃郁、口感醇厚、協調,香氣組成與比例適宜,形成了S37所釀葡萄酒的獨特風味,為釀造具有西安地區特有風格特征的葡萄酒創造了酵母資源條件,可作為西安地區葡萄酒生產特征酵母進一步商品化的出發菌株。
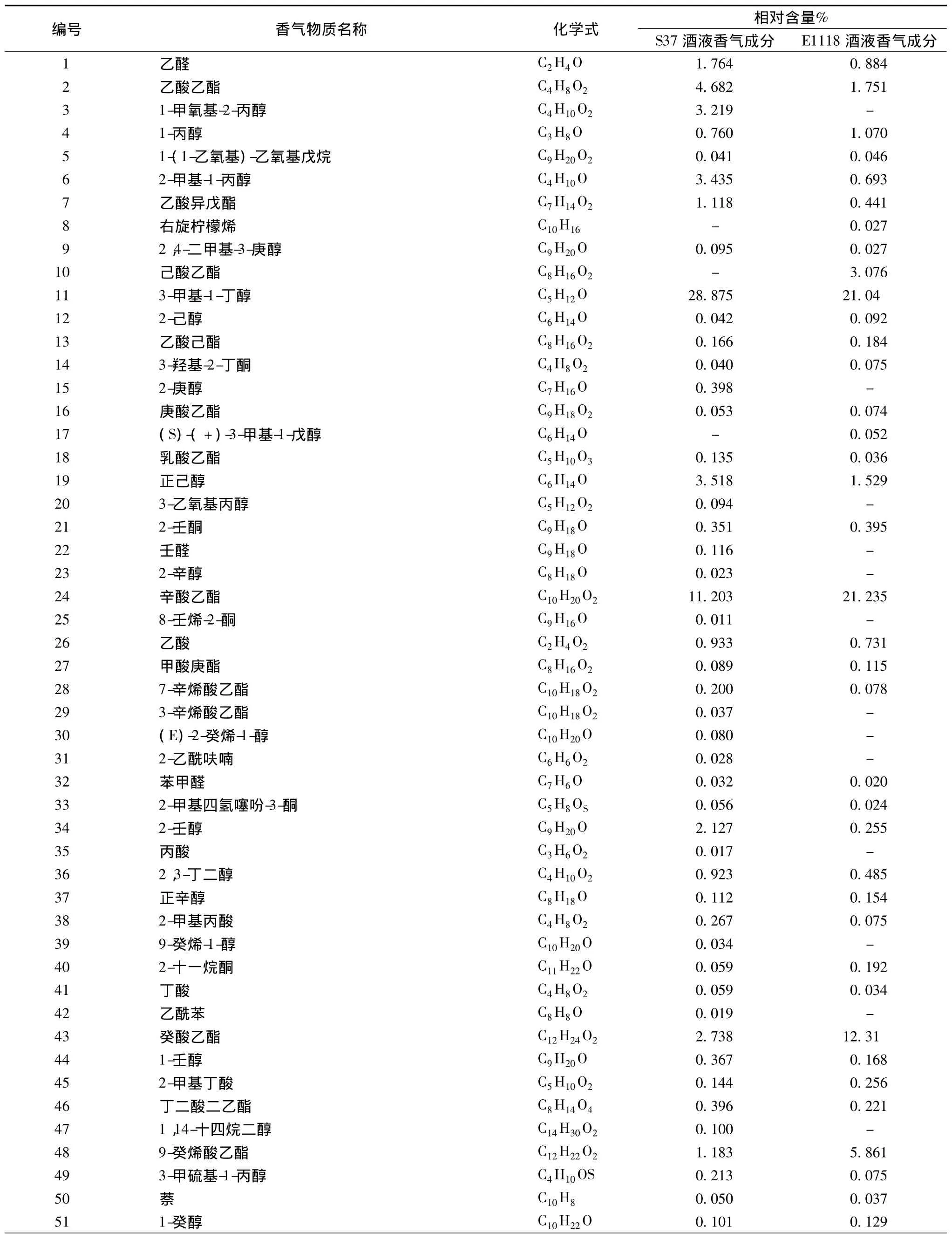
表5 菌株S37與菌株EC1118所釀酒液主要香氣成分對比表Table 5 Aromacompositions of wine fermented by strain S37 and contrast strain EC1118
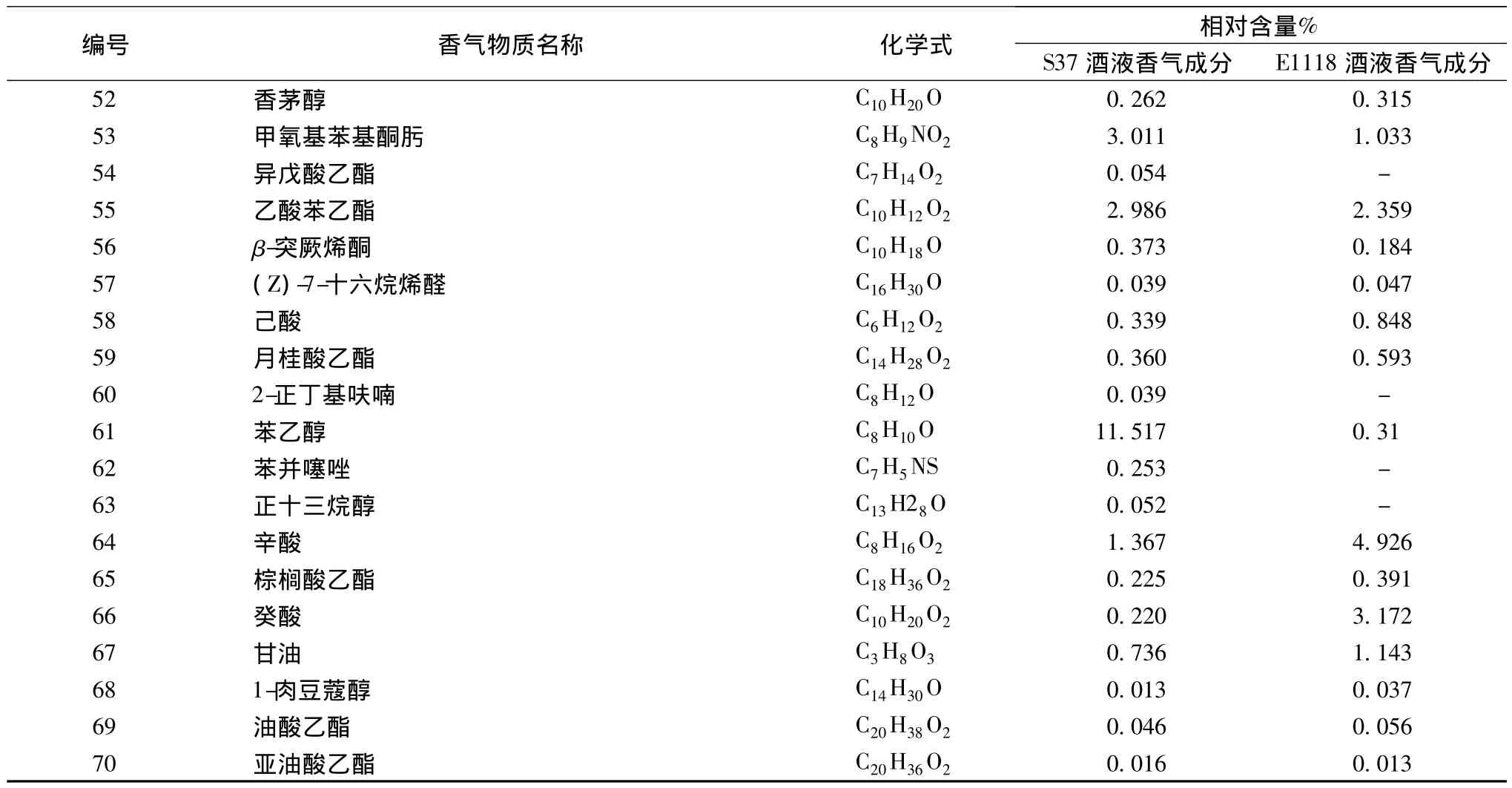
續表5
[1] Viana F,Belloch C,Vallés S,et al.Monitoring a mixed starter of Hanseniaspora vineae-Saccharomyces cerevisiae in natural must:Impact on 2-phenylethyl acetate production[J].International Journal of Food Microbiology,2011,151(2):235-240.
[2] YE M,YUE T,YUAN Y,et al.Production of yeast hybrids for improvement of cider by protoplast electro fusion[J].Biochemical Engineering Journal,2013,81:162-169.
[3] De Lerma N L,Peinado R A.Use of two osmoethanol tolerant yeast strain to ferment must from Tempranillo dried grapes effect on wine composition [J].International Journal of Food Microbiology,2011,145(1):342-348.
[4] 李慧.釀酒酵母海藻糖合成對高溫、酒精、滲透壓脅迫響應機理的研究[D].北京:中國農業大學,2010.
[5] LI X,CHAN L J,YU B,et al.Fermentation of three varieties of mango juices with a mixture of Saccharomyces cerevisiae and Williopsis saturnus var.mrakii[J].International Journal of Food Microbiology,2012,158(1):28-35.
[6] Comitini F,Gobbi M,Domizio P,et al.Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae [J].Food Microbiology,2011,28(5):873-882.
[7] Herrero O,Ramon D,Orejas M.Engineering the Saccharomyces cerevisiae isoprenoid pathway for de novo production of aromatic monoterpenes in wine[J].Metabolic Engineering,2008,10(2):78-86.
[8] 王慧,張立強,劉天明,等.產地葡萄酒優良酵母菌株的篩選及鑒定[J].釀酒科技,2007(9):29-31,34.
[9] Capece A,Romaniello R,Siesto G,et al.Selection of indigenous Saccharomyces cerevisiae strains for Nero d'Avola wine and evaluation of selected starter implantation in pilotermentation[J].International Journal of Food Microbiology,2010,144(1):187-192.
[10] 龐紅勛,崔艷,劉金福,等.本土葡萄酒酵母的選育及發酵性能[J].食品研究與開發,2010,31(6):169-174.
[11] 劉天明,王可,李記明,等.天然酵母菌株對赤霞珠葡萄酒香氣構成的影響[J].中國釀造,2010,224(11):171-174.
[12] 苑偉,王學鋒,劉延琳.優選釀酒酵母菌株發酵性能研究[J].中國釀造,2010,222(9):48-52.
[13] Soufleros N E,Bouloumpasi E H,Bouloumpasi E,et al.Selection of indigenous Saccharomyces cerevisiae strains according to their oenological characteristics and vinification results[J].Food Microbiology,2006,23(2):205-211.
[14] Cavazza A,Grando M S,Zini C.Rilevazione della flora microbica dimostie vini[J].Vignevini,1992(9):17-20.
[15] 程仕偉,韓鵬,趙慧,等.赤霞珠葡萄自然發酵過程中的釀酒酵母篩選及其發酵特性[J/OL].釀酒科技,2015(3):16-19.
[16] 劉興艷,潘軍,顧一洪,等.四株野生酵母菌株耐受性的研究[J].食品工業科技.2015,36(1):149-153.
[17] Chumillas M R,Cortines M B,Gomez A L,et al.Evalua-tion of a rapid DNA extraction method to detect yeast cells by PCR in orange juice [J].Food Control,2007,18(1):33-39.
[18] 趙宏宇,李珺,趙玥,等.4種酵母基因組提取方法的比較[J].食品科學,2011,32(9):170-173.
[19] 陳金麗,郭陽,薛潔,等.優良野生葡萄酒釀酒酵母的篩選及性能評價[J].食品與發酵工業,2012,38(5):106-116.
[20] Christ K L,Burritt R L.Critical environmental concerns in wine production:an integrative review [J].Journal of Cleaner Production,2013,53:232-242.
[21] 張珍,韓舜愈,王婧,等.祁連葡萄酒產區葡萄酒相關野生酵母菌株的分離及初步分類[J].食品工業科技,2013(8):179-182.
[22] 李雙石,陳晶瑜,韓北忠,等.中國本土葡萄酒酵母種群多樣性分布的研究進展[J].中國釀造,2011(12):4-8.
[23] 楊瑩,徐艷文,薛軍俠.營養瓊脂對葡萄酒相關酵母的鑒定效果驗證[J].微生物學雜志,2007,27(5):75-78.

