關于大學化學基礎課教材中幾個問題的討論
郭新華
(高等教育出版社 北京 100029)
關于大學化學基礎課教材中幾個問題的討論
郭新華
(高等教育出版社 北京 100029)
針對現已出版的大學化學基礎課教材中存在的一些問題,遴選7個具體的實例,提出解決的方法與建議。
大學化學 誘導效應 銀氨溶液 苯胺 自發反應 熵判據 價層電子對 赫斯定律
隨著我國高等教育教學改革的不斷深化,如何提高本科教育教學質量,大力提升人才的培養水平,成為了教育從業人員需要重點思考并解決的問題。教材作為教學環節中不可或缺的關鍵元素,承擔著固化教學成果、傳遞知識、體現教育理念等諸多職責。筆者從自身工作的角度出發,在“如何更好地編寫大學化學基礎課教材”這一命題下,結合7個具體的實例加以具體闡述。
1.烷基的誘導效應
在《有機化學》教材中,普遍認為烷基的誘導效應小于氫原子,具有給電子的誘導效應。但是,由于碳元素的電負性大于氫元素,因此烷基的電負性一定大于氫元素,故此烷基的誘導效應要大于氫元素,烷基具有吸電子的誘導效應。
2.銀氨溶液的組成
在《有機化學》教材中,普遍認為銀氨溶液的有效成分是[Ag(NH3)2] OH。實際上,這是不正確的。銀氨溶液的制備方法是將濃氨水逐漸滴加到AgNO3溶液中,中間有沉淀生成,繼續滴加濃氨水至沉淀溶解完全,所得混合溶液即為銀氨溶液。制備銀氨溶液的反應方程式為

由制備的反應方程式可知銀氨溶液的有效成分是[Ag(NH3)2]NO3,而并非是[Ag(NH3)2]OH。
3.苯胺的分子結構
在《有機化學》教材中,認為苯胺分子中的N原子為sp3雜化,苯胺的結構為

N原子的孤對電子與苯環的π鍵形成了一個7原子8電子的共軛π鍵。由于大π鍵只能由參與成鍵的原子的p軌道重疊,而N的sp3雜化軌道與苯環的大π鍵只能產生少部分重疊,形成類似于σ-π的超共軛效應。因此上述苯胺的結構和N原子的雜化方式不能解釋氨基(—NH2)為強鄰對位定位基及苯胺與苯酚都能與溴水生成三溴取代物沉淀。無機化學和結構化學中認為,苯胺分子中的N原子為sp2雜化,苯胺的結構為

由于形成了一個7原子8電子的大π鍵,使N原子的給電子共軛效應比吸電子的誘導效應大得多,因此—NH2為強鄰對位定位基,并且苯胺和苯酚相似,分子中都存在一個7原子8電子的大π鍵,均不與溴水生成三溴取代物。
4.自發反應的定義
國內多數教材中對自發反應均定義為不需借助于外力就能進行的反應,并未指明外力是什么,這就導致一些師生產生了誤解。例如,會錯誤地認為碳酸鈣在高溫下的分解和高溫高壓下石墨轉化為金剛石的反應均為非自發反應,得出這一結論的理由是碳酸鈣的分解為吸熱反應,該反應需要環境提供熱才能進行,而石墨轉換為金剛石需要環境提供體積功。實際上,自發反應定義中的外力是指非體積功(如電功和機械功等),但自發反應并不排除體系與環境之間熱和體積功的交換。因此,自發反應的定義應改為不需要環境提供非體積功就能進行的化學反應。
5.封閉體系的熵判據
借助于卡諾循環和卡諾定理,推導出熱力學第二定律的數學表達式:

上式適用于封閉體系的任意過程。
對于隔離體系,上式可改寫為

這就是熵判據,僅適用于隔離體系。由于真正的隔離體系并不存在,因此熵判據并無實際意義。
國內教材的通常處理方法是,把封閉體系和環境組成一個新的隔離體系,用總熵變作為過程發生可能性的判據,總熵變等于體系的熵變與環境的熵變之和。總熵變判據為
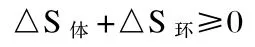
上述處理方法對于部分學生來講是費解的,為什么要把封閉體系設計成一個實際上并不存在的隔離體系呢?筆者認為,對于封閉體系其實并不需要采用上述處理方法。由熱力學第二定律的數學表達式可得封閉體系的判據為

只要比較過程的熵變與過程的熱溫商的相對大小,就能判斷出封閉體系內過程發生的可能性。
6.確定中心原子的價層電子對的經驗規則的局限性
在利用價層電子對互斥理論判斷以共價鍵形成的多原子分子或多原子離子的空間構型時,首先要確定中心原子的價層電子對的數量。為了能在不了解分子的結構時,僅根據分子式或離子化學式就能快速、準確地判斷出中心原子的價層電子對的數量,科學家總結出一個經驗公式和相關的經驗規則。確定中心原子的價層電子對數量的經驗公式為

利用上式確定中心原子的價層電子對時,可采用下列經驗規則:
(1)O原子和S原子為配位原子時不提供電子;
(2)其他原子為配位原子時只提供1個電子;
(3)對于多原子離子,把離子的電荷數看作是中心原子的電荷數;
(4)中心原子有成單電子時,看作是一對電子。
實際上,上述判斷多原子分子和多原子離子的經驗規則是有局限性的。只有當中心原子與配位原子之間形成大π鍵和配位鍵時,上述經驗規則才適用。例如,用上述經驗規則判斷S8分子中S原子的價層電子對為3對,S原子采取sp2雜化;而S原子有4對價層電子對,S原子采取sp3雜化。產生上述錯誤的原因,是由于S原子之間只形成σ鍵。
7.關于赫斯定律的應用
有些教材認為,赫斯定律的應用價值不大,對其只進行了簡單的介紹。實際上,赫斯定律具有很大的應用價值。在《無機化學》教材中,利用赫斯定律不僅可以根據已知反應的摩爾焓變計算出給定的化學反應的摩爾焓變,還可以根據反應物與生成物的鍵能、標準摩爾生成焓和標準摩爾燃燒焓計算出反應的摩爾焓變。
將赫斯定律加以推廣,如果把幾個化學反應乘以系數后相加得到一個總反應,該總反應的摩爾焓變(ΔrHm)等于幾個化學反應的摩爾焓變(ΔrHm,i)與系數(ai)乘積的代數和,即

