大腸桿菌耐酸分子機制研究進展
陳卓逐,闞建全,石 慧
(西南大學食品科學學院,重慶市農產品加工與貯藏重點實驗室,農業部農產品貯藏保鮮質量安全風險評估實驗室(重慶),重慶 400715)
大腸桿菌耐酸分子機制研究進展
陳卓逐,闞建全,石 慧*
(西南大學食品科學學院,重慶市農產品加工與貯藏重點實驗室,農業部農產品貯藏保鮮質量安全風險評估實驗室(重慶),重慶 400715)
具有耐強酸能力的大腸桿菌在酸性脅迫條件下更易生存。這主要是由于其具有葡萄糖-阻礙耐酸系統、氨基酸依賴型耐酸系統、伴侶蛋白抗酸作用以及保持膜電荷穩定等耐酸機制。了解大腸桿菌的這些耐酸分子機制,可以為食品加工工業控制大腸桿菌的污染提供新的認識,也對一些食源性致病菌的臨床預防和治療具有積極的作用。本文就大腸桿菌耐酸分子機制的研究進行綜述。
大腸桿菌;葡萄糖-阻礙;氨基酸依賴型;伴侶蛋白;膜電荷;交叉保護
大腸桿菌(Escherichia coli)是與人們日常生活關系非常密切的一類細菌,是腸道桿菌大類中的一種,包括非致病性大腸桿菌和致病性大腸桿菌。前者是人類及動物的腸道正常菌,后者可引起食物中毒。大腸桿菌分布非常廣泛,土壤表層、水體、家畜、家禽、蚊蠅等都含有致病性大腸桿菌,肉類、乳與乳制品、水產品、豆制品、蔬菜、發酵食品等各種食品都有可能被致病性大腸桿菌污染,并通過飲水和食物使人中毒[1-4]。致病性大腸桿菌是引起食物中毒最常見的病原菌之一。
大腸桿菌有較強的耐酸性,特別是其處于穩定期的細胞能夠耐受pH 2.5或更低的酸性條件數小時,王金玲等[5]分離出了一株在pH 2.5條件下耐受29 h的O157:H7。因此,大腸桿菌很容易污染酸性或發酵食品如果汁、香腸、奶酪、酸奶、腌制食品等[6-9];另一方面,致病性大腸桿菌能夠通過哺乳動物的胃(pH 1~3)進入腸道生存繁殖而致病,給人類的健康帶來威脅[10-12]。因此,對于大腸桿菌的這種能夠在強酸環境生存的機制備受關注,研究人員發現大腸桿菌存在多種耐酸機制,且多種機制及其相互間的影響構成了一個復雜的耐酸調節網絡。
當大腸桿菌暴露于非致死的酸性條件下時,會誘導多種耐酸系統的作用及相關基因的表達(acid resistant systems,ARs),如葡萄糖-阻礙耐酸系統、氨基酸(谷氨酸、精氨酸、谷氨酰胺)依賴型耐酸系統,ARs可保護細胞在pH 2.0~4.0的可致死條件下存活[11-13]。最近的研究發現大腸桿菌周質空間存在分子伴侶HdeA和HdeB,在酸性條件下,HdeA和HdeB可與蛋白質結合并防止其聚集沉淀[14-16]。大腸桿菌的其他耐酸機制包括通過改變細胞膜成分和保持膜電荷穩定以及交叉保護的機制也對其耐酸能力起重要的輔助作用。大腸桿菌在不含氨基酸的培養基(如只含有葡萄糖的基本培養基)條件下的抗酸能力明顯低于其在富含氨基酸的培養基(如Luria broth,LB)中的抗酸能力[10,17]。氨基酸依賴型耐酸系統在富含氨基酸的培養基里能發揮有效的耐酸性,而且氨基酸依賴型耐酸系統消耗質子的能力更強。但是,若大腸桿菌生存在成分復雜的酸性食品或者哺乳動物的胃中,其多種耐酸機制將同時發揮作用。
1 葡萄糖-阻礙耐酸系統(AR1)
葡萄糖-阻礙耐酸系統(AR1)是研究人員根據當大腸桿菌在pH 5.5的基本培養基生長到穩定期(stationary phase)時,pH值迅速調整到2.5后大腸桿菌仍然能夠存活的現象發現的。選擇性信號因子σs和總調控蛋白CRP(cAMP receptor protein)是抵抗酸性環境所需要的[17-18]。此外,傳遞質子的F0F1-ATP酶(F0/F1protontranslocating ATPase)也參與其間,但AR1是否由F0F1-ATP酶系統提供能量還是未知的[17-22]。谷氨酸和谷氨酰胺能激活此耐酸系統,葡萄糖會對其產生抑制作用;pH 8.0時,細胞會產生抑制劑阻止該系統的活化[21]。選擇性信號因子σs由RpoS編碼,RpoS是細菌一般脅迫反應的主要調控因子。可以誘導RpoS表達包括脅迫條件(如碳源和氮源饑餓、滲透壓升高、低pH值、溫度升高等)以及一些細胞內信號。

圖1 葡萄糖-阻礙耐酸系統作用機制[23-27]Fig.1 Mechanism of the glucose-repressed acid resistance[23-27]
AR1的結構組分和保護機制仍不明確,研究人員推出其作用機制,如圖1所示,一方面,酸性條件可以直接作用RpoS,誘導RpoS的翻譯、抑制RpoS的降解,從而增加RpoS量的積累;另一方面,酸性條件可以抑制cAMP的表達,活化諸如PhoP/PhoQ、ArcB/RssB等雙組分系統,cAMP的減少將會激活RpoS的表達,活化的PhoP/PhoQ間接調控RpoS的轉錄,活化的ArcB/RssB間接抑制RpoS的降解[23-27]。因此,在酸性條件下RpoS的量將明顯提高并產生一定量的酸休克蛋白(acid shock proteins,ASPs),ASPs的作用是保護和修復大分子,能提高細胞膜的穩定性[28-29]。RpoS是葡萄糖-阻礙耐酸系統不可缺少的調節因子,而且在其他耐酸機制中也起著一定的調控作用。研究表明,大腸桿菌在高滲、pH 5.0的條件下或進入穩定期,RpoS直接或間接調控其大約500 個基因的表達,占E. coli基因組的10%[25,28-32]。
2 氨基酸依賴型耐酸系統
2.1 谷氨酸依賴型耐酸系統(AR2)
谷氨酸依賴型耐酸系統(AR2)是在谷氨酸存在的情況下,依賴于兩個谷氨酸脫羧酶(GadA和GadB)的異構體和谷氨酸-γ-氨基丁酸(γ-aminobutyric acid,GABA)反轉運體(GadC)共同發揮耐酸作用[19-20,31]。如圖2所示,AR2的作用機制是大腸桿菌利用谷氨酸脫羧酶使谷氨酸在脫羧過程中生成GABA并消耗細胞內的H+,達到升高細胞內pH值的目的;轉運蛋白GadC將GABA轉運到細胞外并交換新的底物(谷氨酸)。脫羧和轉運的作用就是將酸性環境下進入細胞內的質子消耗,再將產物輸出細胞,并交換新的底物,如此循環,能夠阻止細胞內的pH值降低,以防止細胞致死。
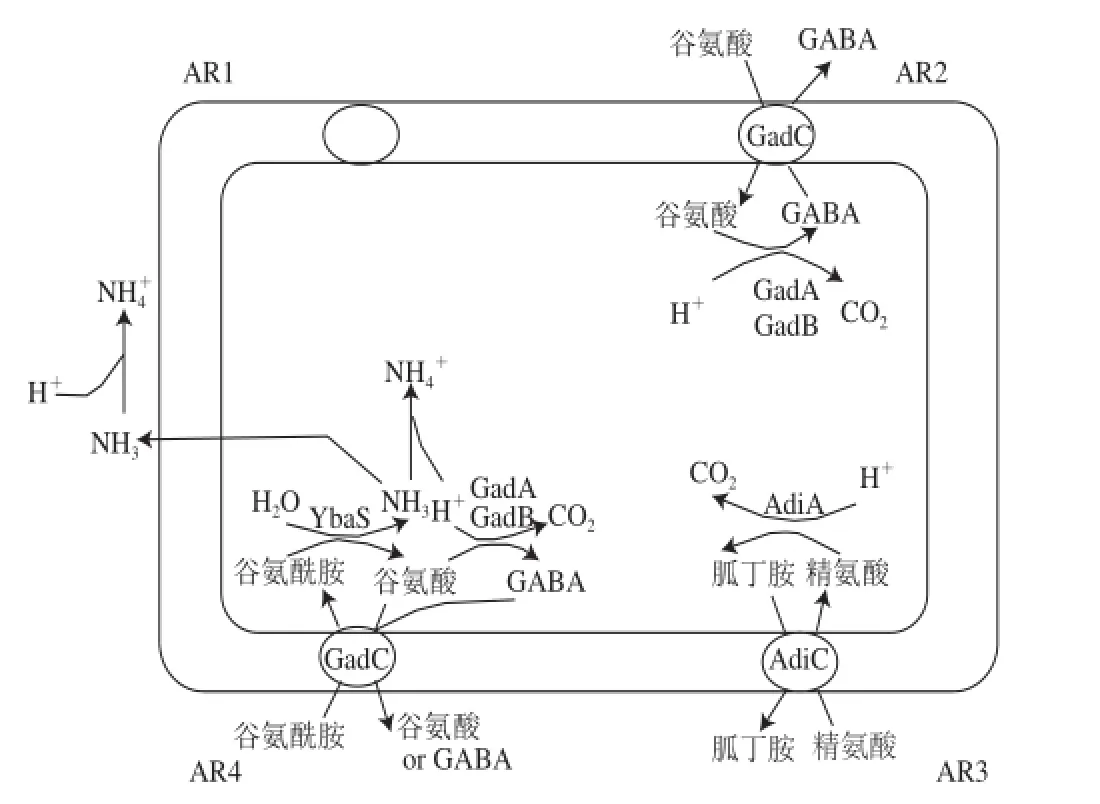
圖2 大腸桿菌主要的耐酸系統[13,19-20]Fig.2 Main acid resistance in E. coli[13,19-20]
谷氨酸依賴型耐酸系統是大腸桿菌最有效的耐酸系統。同功酶GadA、GadB和氨基酸轉運蛋白GadC共同作用發揮著消耗入侵細胞內質子的作用,從而緩解因為環境低pH值而導致細胞內pH值降低的脅迫。研究發現,3 個關鍵基因gadA、gadB、gadC的缺失都會顯著影響細菌在pH 2~3的存活率。同時還發現,pH 2.5時,GadA和GadB任何一種脫羧酶的存在都能保證AR2發揮耐酸作用,但是當pH 3.0時,2 種脫羧酶同時存在才能保證AR2的有效性[21]。研究還發現,在pH 5.5的EG培養基和在pH 7.0的EG培養基大腸桿菌生長到對數后期,其gadA、gadB的表達量有顯著差異,gadA和gadB在pH 5.5時的表達量顯著多于在pH 7.0時的表達量[30-34]。可見,酸性條件能夠誘導著幾個基因的表達,反過來其高表達又能很好的增強大腸桿菌的耐酸能力。
谷氨酸依賴型耐酸系統的耐酸能力除了與這3 個關鍵蛋白有直接關系外,其還受到另外11 個調節基因的影響,如圖3所示。這個系統是處于一個復雜的調節網絡之中。GadE是關鍵調節基因,位于gadA和gadB、gadC的上游,由gad盒子和GadE激活子組成[35-36]。
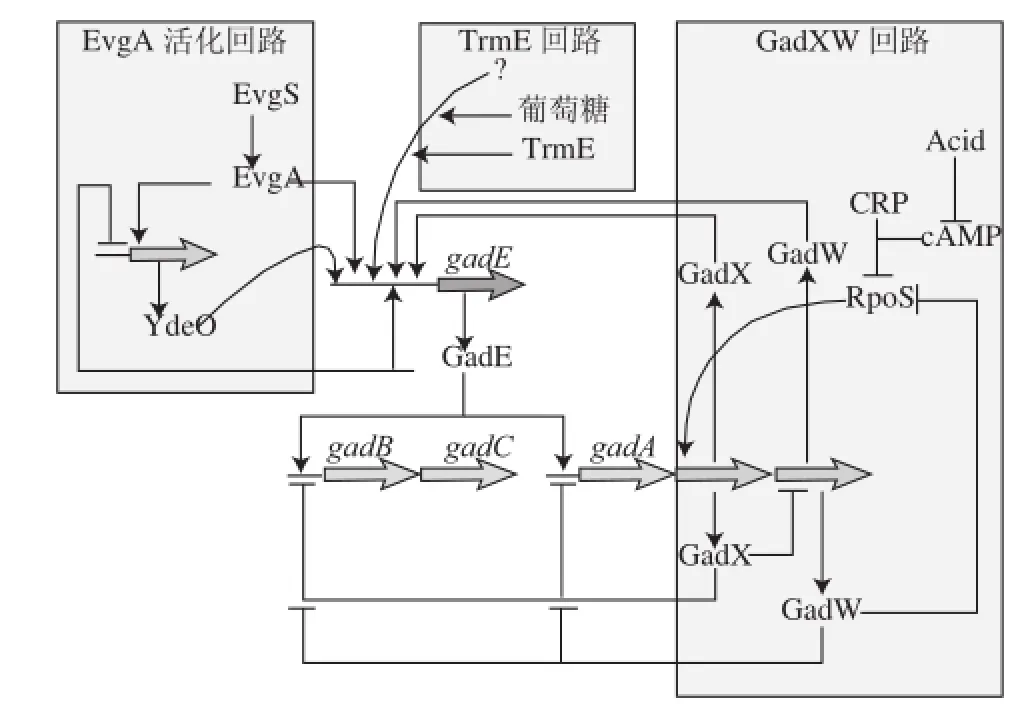
圖3 谷氨酸依賴型耐酸系統的激活與調節網絡[11]Fig.3 Activation and accessory circuits controlling glutamatedependent acid resistance[11]
研究證明無論在何種成分的培養基(LB、LBG、BHI)還是在不同的生長時期下,GadE對gadA和gadB、gadC的表達都起到關鍵的調控作用[7]。GadE除了自我調節表達外,還存在3 條調節途徑。第一條途徑需要傳感激酶EvgS、調節因子EvgA以及YdeO的參與,YdeO能夠直接或間接地激活GadE的轉錄;第二條途徑需要CRP和RpoS兩個調節因子GadX、GadW的參與,這條環路對細胞的耐酸性起到至關重要的作用,酸性環境會抑制cAMP的表達,但是cAMP的減少將會激活RpoS的表達,進而促進GadX的表達或GadW的降解;第三條途徑稱為TrmE環路,TrmE在細胞內的功能并不完全明確,只知道它會誘導tRNA的改變[7,37-39]。
2.2 精氨酸依賴型耐酸系統(AR3)
精氨酸依賴型耐酸系統(AR3)與AR2作用機制相同,只不過需要外源精氨酸。AR3在低pH值厭氧條件下被誘導,由精氨酸脫羧酶(AdiA)和反轉運體(AdiC)組成[7,38,40]。在富含精氨酸的酸性培養條件下,酸誘導AdiA和AdiC的表達,大腸桿菌利用精氨酸脫羧酶使精氨酸在脫羧過程中生成胍丁胺(agmatine)并消耗細胞內的H+,達到升高細胞內pH值的目的;脫羧產物胍丁胺被轉運蛋白AdiC轉運到細胞外并交換新的精氨酸,如圖2。脫羧消耗細胞內的質子,轉運交換新的底物,如此循環,雖然質子不斷地滲透到細胞質中,但細胞質中pH值仍然保持在pH 4.7±0.1,在此范圍內,不會引起大腸桿菌死亡[40]。
研究發現,adiC(yjdE)基因位于相鄰的調控基因adiY和adiA基因的上游,這一點與AR2中的gadC和gadB基因的位置是一致的(圖4)。gadB基因編碼谷氨酸的脫羧酶GadB,它們上游基因gadC編碼的GadC蛋白是谷氨酸和GABA的反向轉運蛋白。而恰好AdiA又是精氨酸的脫羧酶,adiC編碼的AdiC蛋白與GadC一樣,是一種膜反向轉運蛋白[39-41]。

圖4 AR2(a)、AR3(b)基因排布圖[40]Fig.4 Distribution of genes in AR2 (a) and AR3 (b)[40]
2.3 谷氨酰胺依賴型耐酸系統(AR4)
谷氨酰胺依賴型耐酸系統是2013年清華大學施一公教授等[13]發現的一個新型大腸桿菌氨基酸依賴型耐酸系統。證實其在谷氨酰胺(Gln)存在的條件下,依賴于谷氨酰胺酶(YbaS)和氨基酸反向轉運蛋白(GadC)共同發揮對酸的抵抗能力[13,30,42],見圖2。YbaS和GadC可被酸性pH值激活,且只在pH值小于或等于6.0時才能適當發揮功能。通過吸收L-谷氨酰胺(Gln),大腸桿菌利用YbaS將之轉化為L-谷氨酸(Glu)并釋放氣態氨。游離氨中和質子,維持大腸桿菌細胞體的pH值穩定。GadC則負責細胞外Gln與細胞內Glu交換。通過這一耐酸系統,確保了大腸桿菌在含有豐富的谷氨酰胺的極酸性食品中生存。
大腸桿菌有2 個谷氨酰胺酶基因ybaS和yneH,誘導它們表達谷氨酰胺酶的條件是不一樣的。研究者分別構建了ybaS和yneH基因的缺陷菌株,發現YneH在接近中性條件發揮作用,而在pH≤6.0時,YbaS對AR4起無可替代的作用[13]。另外,酶促反應的產物谷氨酸能夠在同功酶GadA、GadB的作用下脫羧,形成谷氨酸脫羧作用耐酸系統。谷氨酰胺酶促反應結合谷氨酸脫羧反應能消耗2 份質子,發揮更強大的耐酸能力,有效保障大腸桿菌的在酸性環境的生存。
2.4 其他氨基酸依賴型耐酸系統
大腸桿菌除了上述3 種重要的氨基酸依賴型耐酸系統外,其他氨基酸,如賴氨酸、鳥氨酸也能夠發生脫羧作用,消耗細胞內的質子,其作用機制和上述脫羧作用一致[42]。但是賴氨酸脫羧酶、鳥氨酸脫羧酶需要較高的pH值(幾乎不能在pH 2.5條件下發揮作用)。最近的研究表明賴氨酸脫羧作用耐酸系統確實存在于大腸桿菌中,但是耐酸能力很低[7,40]。
3 伴侶蛋白發揮抗酸作用的耐酸系統
分子伴侶是細胞中一大類蛋白質,是由不相關的蛋白質組成的一個家系,它們介導其他蛋白質的正確折疊與裝配,但自己不成為最后功能結構中的組分。最新的研究發現,在大腸桿菌的周質空間中存在著酸性條件下能夠幫助周質蛋白復性的分子伴侶HdeA和HdeB[14-16,43]。HdeA具有α-螺旋結構和兩親性的特點,能被DNA結合蛋白H-NS(histone-like nucleoidstructuring protein)抑制[44-47]。在pH<3.0的酸性環境中,HdeA能夠阻止周質蛋白的酸誘導聚集對細胞起到毒害作用[47-53]。在中性pH值條件下,HdeA以折疊態沒有伴侶活性的二聚體形式出現,不能和蛋白質底物結合。當pH<3.0時,HdeA迅速解離成單體,單體結構部分展開具有伴侶活性 并且暴露出疏水性的表面,然后和底物蛋白結合阻止其酸誘導聚集[52-54]。有趣的是,HdeA和底物結合時,其能量來源于外部pH值的變化,而不需要消耗細菌本身的能量。
HdeB是HdeA的類似物,與HdeA擁有類似的結構和功能[41,55]。它們的區別在于:HdeA在pH 2.0左右的時候發揮重要的抗周質蛋白聚集的作用,在pH 3.0左右時二者都發揮抗周質蛋白聚集的作用,但HdeB比HdeA更加有效[46]。HdeA和HdeB抗酸性存在差異的原因是HdeB二聚體完全解離是在pH 3.0左右時,HdeA卻是在更低的pH值情況下。此外,HdeB在pH值為2.0時暴露出的疏水性表面要比HdeA暴露的程度低[14]。HdeA和HdeB在抗酸方面存在著協同作用,實驗證明hdeA、hdeB單基因的缺失都會降低細菌在酸性條件下的存活率。
4 膜成分改變及膜電荷的穩定
細胞膜是食源性病原菌抵抗環境脅迫的第一道防御屏障。食源性病原菌通過改變其膜成分來應答環境壓力,使膜的流動性與其生命活動相協調[56-57]。膜上環丙烷脂肪酸(cyclopropane fatty acids,CFA)含量的變化對于大腸桿菌的耐酸性起著重要的作用[57-58]。研究證明,環丙烷脂肪酸的增加提高了膜的穩定性,限制了酰基鏈整體的移動,最終減弱了膜的流動性[56,59]。
大腸桿菌不僅通過改變其膜成分來適應酸壓力,而且能在一定程度上保持細胞膜電荷的穩定,避免了細胞的超極化現象(正常情況下,大腸桿菌的膜電勢為負)[11,60]。大腸桿菌細胞膜上的氫/氯離子轉運蛋白(CLC H+/Cl-)對氨基酸依賴型耐酸系統起著重要的輔助作用,其作用的機制是:一方面,脫羧反應和酶促反應能夠消耗細胞膜內的質子,降低電荷;另一方面,氫/氯離子轉運蛋白能夠將細胞內的氫離子轉運出去,并將細胞外與氯離子類似的陰離子轉運進入細胞內,中和電荷,最終使細胞內的電荷恢復到正常的負電荷[60-63]。
5 交叉保護
在一種壓力下可以產生抵抗其他壓力的能力,稱為交叉保護,大腸桿菌存在多種交叉保護的現象(表1)。經過酸適應的大腸桿菌,可以增強抵抗其他逆境的能力[64-65];同樣地,經過諸如熱、饑餓、滲透壓應激的大腸桿菌,可以增強抵抗酸的能力[66-69]。Arnold等[67]研究證明,25 ℃饑餓培養的大腸桿菌O157:H7的抗酸能力得到提高,饑餓條件下產生的饑餓休克蛋白(staration proteins)能修復因酸而變性的大分子物質。大多數細菌之所以能發生交叉保護,原因在于細菌響應一種脅迫時會產生多種保護蛋白,保護蛋白能修復因不同物理、化學因子而變性的大分子物質[70]。

表1 大腸桿菌的交叉保護Table 1 Cross protection of E. coli
利用交叉保護這一特性,大腸桿菌能夠適應多種環境的壓力,而使食品防腐劑(食品防腐劑就是人為制造一種脅迫因子,而使微生物不能正常生存)失去應有的作用,增加食品中毒的現象。因此,研究不同壓力之間的交叉保護,對于生產新型食品防腐劑具有重要的指導意義。
6 結 語
大腸桿菌在適應各種環境壓力下,進化出了多種應激響應機制來回應各種壓力信號。其中研究最多的是大腸桿菌在酸性環境的應答,它使大腸桿菌具有很強的耐受酸性脅迫能力和獨特的生理功能。在過去幾十年里,國內外學者潛心地研究大腸桿菌的耐酸分子機制,已經發現多種耐酸系統及其影響因素,還發現一些耐酸基因,如rpoS、gadE、gadX、phoQ等。這些基因可能作為新型的抗菌治療靶點或者為發展新型疫苗提供依據。
隨著對大腸桿菌耐酸作用機制的深入了解,也引出很多沒有解決的問題,比如,AR1作用機制是什么,一切還在推測階段;大腸桿菌的這些耐酸系統存在于其他細菌嗎;環路TrmE作用途徑是怎樣的,TrmE為什么對gadA/BC的表達起著雙重作用;對應答過程表達的一些酶類和蛋白質還沒有準確的定義、其結構完全不了解;對大腸桿菌的耐酸機制的描述還在實驗室階段,然而大腸桿菌在低pH值食品中的應答機制更加復雜;還有哪些基因參與了大腸桿菌對酸信號的應答。這些問題都需要進一步的探究。但是,隨著現代技術的進步,相信在接下來的幾十年里,人們將在大腸桿菌耐酸方面有更進一步的發現和突破。
[1] 史賢明, 施春雷, 索標, 等. 食品加工過程中致病菌控制的關鍵科學問題[J]. 中國食品學報, 2011, 11(9): 194-208.
[2] 山珊, 賴衛華, 陳明慧, 等. 農產品中大腸桿菌O157:H7的來源及分布研究進展[J]. 食品科學, 2014, 35(1): 289-293. doi: 10.7506/ spkx1002-6630-201401057.
[3] RAFFAELLIR M, PALADINI M, HANSON H, et al. Child careassociated outbreak of Escherichia coli O157:H7 and hemolytic uremic syndrome[J]. The Pediatric Infectious Disease Journal, 2007, 26(10): 951-953.
[4] HERMOS C R, JANINEH M, HAN L L, et al. Shiga toxin-producing Escherichia coli in children: diagnosis and clinical manifestations of O157:H7 and non-O157:H7 infection[J]. Journal of Clinical Microbiology, 2011, 49(3): 955-959.
[5] 王金玲, 王芳, 周志江, 等. 出血性大腸桿菌O157:H7國內分離株耐酸性的研究[J]. 食品科學, 2005, 26(2): 101-104.
[6] SLONCZEWSKI L, ROSEN B P, ALGER J R, et al. pH homeostasis in Escherichia coli: measurement by31P nuclear magnetic resonance of methylphosphonate and phosphate[J]. Proceedings of the National Academy of Science of the United States of America, 1981, 78(10): 6271-6275.
[7] ZILBERSREIN D, AGMON V, SCHULDINER S, et al. Escherichia coli intracellular pH, membrane potential, and cell growth[J]. Journal of Bacteriology, 1984, 158(1): 246-252.
[8] MILLER L G. Escherichia coli O157:H7 acid tolerance and survival in apple cider[J]. Journal of Food Protection, 1994, 57(6): 460-464.
[9] DICKSON J R, SIRAGUSA G R. Survival of Salmonella typhimurium, Escherichia coli O157:H7 and Listeria monocytogenes during storage on beef sanitized with organic acids[J]. Journal of Food Safety, 1994, 14(4): 313-327.
[10] SMALL P, BLANKENHORN D, WELTY D, et al. Acid and base resistance in Escherichia coli and Shigella flexneri: role of rpoS and growth pH[J]. The Journal of Bacteriology, 1994, 176(6): 1729-1737.
[11] FOSTER J W. Escherichia coli acid resistance: tales of an amateur acidophile[J]. Nature Reviews Microbiology, 2004, 2(11): 898-907.
[12] AUDIA J P, WEBB C C, FOSTER J W. Breaking through the acid barrier: an orchestrated response to proton stress by enteric bacteria[J]. International Journal of Medical Microbiology, 2001, 291(2): 97-106.
[13] LU Peilong, MA Dan, SHI Yigong , et al. L-glutamine provides acid resistance for Escherichia coli through enzymatic release of ammonia[J]. Cell Research, 2013, 23(5): 635-644.
[14] 于延慶, 于志超, 李艷妮. 分子伴侶HdeA與HdeB的作用機制[J]. 中國生物化學與分子生物學報, 2014, 30(5): 441-446.
[15] KERN R, MALKI A, ABDALLAH J, et al. Escherichia coli HdeB is an acid stress chaperone[J]. Journal of Bacteriology, 2007, 189(2): 603-610.
[16] VALDERAS M W, ALCANTARA R B, BAUMGARTNER J E, et al. Role of HdeA in acid resistance and virulence in Brucellaabortus 2308[J]. Veterinary Microbiology, 2005, 107(3/4): 307-312.
[17] LIN J, LEE I S, FREY J, et al. Comparative analysis of extreme acid survival in Samonella typhimurium, Shigella flexneri, and Escherichia coli[J]. The Journal of Bacteriology, 1995, 177(14): 4097-4104.
[18] LIN J, SMITH M P, CHAPIN K C, et al. Mechanisms of acid resistance in resistance enterohemorrhagic Escherichia coli[J]. Applied and Environmental Microbiology, 1996, 62(9): 3094-3100.
[19] CASTANIE-CORNET M P, FOSTER J W. Escherichia coli acid resistance: cAMP recepor protein and a 20 bp cis-acting sequence Control pH and stationary phase expression of the gadA and gadBC glutamate decarboxylase genes[J]. Microbiology, 2001, 147(3): 709-715.
[20] MA D, LU P, YAN C, et al. Structure and mechanism of a glutamate-GABA antiporter[J]. Nature, 2012, 483: 632-636.
[21] CASTANIE-CORNET M P, PENFOUND T A, SMITH D, et al. Control of acid resistance in Escherichia coli[J]. Journal of Bacteriology, 1999, 181(11): 3525-3535.
[22] RICHARD H T, FOSTER J W. Acid resistance in Escherichia coli[J]. Advances in Applied Microbiology, 2003, 52: 167-186.
[23] TU Xuanlin, LATIFI T, BOUGDOUR A, et al. The PhoP/PhoQ twocomponent system stabilizes the alternative sigma factor RpoS in Salmonella enterica[J]. Proceedings of the National Academy of Sciences, 2006, 103(36): 13503-13508.
[24] UTSUMI R. Bacterial signal transduction: networks and drug targets[M]. New York: Springer, 2008: 40-45.
[25] MERRELL D S, CAMILLI A. Acid tolerance of gastriantestinal pathogens[J]. Current Opinion in Microbiology, 2002, 5(1): 51-55.
[26] WESCHE A M, GURTLER J B, MARKS B P, et al. Stress, sublethal injury, resuscitation, and virulence of bacterial foodborne pathogens[J]. Journal of Food Protection, 2009, 72(5): 1121-1138.
[27] BEARSON S, BEARSON B, FOSTER J W. Acid stress responses in enterobacteria[J]. FEMS Microbiology Letter, 1997, 147: 173-180.
[28] RICHARD H, FOSTER J W. Escherichia coli glutamate- and arginine-dependent acid resistance systems increase internal pH and reverse transmembrane potential[J].The Journal of Bacteriology, 2004, 186(18): 6032-6041.
[29] LACOUR S, LANDINI D. σs-dependent gene expression at the onset of stationary phase in Escherichia coli: function of σs-dependent genes and identification of their promoter sequences[J]. Journal of Bacteriology, 2004, 186(21): 7186-7195.
[30] PATTEN C L, KIRCHHHOF M G, SCHERRZBERG M R, et al. Microarray analysis of RpoS mediated gene expression in Escherichia coli K-12[J]. Molecular Genetics and Genomics, 2004, 272(5): 580-591.
[31] THOMPSON K M, GOTTESMAN S. The miaA tRNA modification enzyme is necessary for robust RpoS expression in Escherichia coli[J]. Journal of Bacteriology, 2014, 196(4): 754-761.
[32] 吳晨紫, 楊志偉. 細菌對脅迫應答因子RpoS的調控[J]. 生物技術通報, 2010(12): 50-55; 63.
[33] WEBER H, POLEN T, HEUVELING J, et al. Genome-wide anlysis of the general stress response network in Escherichia coli: σsdependent genes, promoters and sigma factor selectivity[J]. Journal of Bacteriology, 2005, 187(5): 1591-1603.
[34] HERSH B M, FAROOQ F T, BARSTAD D N, et al. A glutamatedependent acid resistance gene in Escherichia coli[J]. Journal of Bacteriology, 1996, 178(13): 3978-3981.
[35] MA Z, GONG S, RICHARD H, et al. GadE (YhiE) activates glutamate decarboxylase-dependent acid resistance in Escherichia coli K-12[J]. Molecular Microbiology, 2003, 49(5): 1309-1320.
[36] RICHARD H, FOSTER J W. Sodium regulates Escherichia coli acid resistance, and influences GadX- and GadW-dependent activation of gadE[J]. Microbiology, 2007, 153(9): 3154-3161.
[37] CALDON C E,YOONG P, MARCH P E. Evolution of a molecular switch: universal bacterial GTPases regulate ribosome function[J]. Molecular Microbiology, 2001, 41(2): 289-297.
[38] YIM L, MARTíNEZ-VICENTE M, VILLARROYA M, et al. The GTPase activity and C-terminal cysteine of the Escherichia coli MnmE protein are essential for its tRNA modifying function[J]. Journal of Biological Chemistry, 2003, 278(31): 28378-28387.
[39] GONG S, MA Z, FOSTER J W. The Era-like GTPase TrmE conditionally activates gadE and glutamate-dependent acid resistance in Escherichia coli[J]. Molecular Microbiology, 2004, 54(4): 948-961. [40] LYER R, WILLIAMS C, MILLER C. Arginine-agmatine antiporter in extreme acid resistance in Escherichia coli[J]. Journal of Bacteriology, 2003, 185(22): 6556-6561.
[41] AUGER E A, REDDING K E, PLUMB T, et al. Construction of lac fusions to the inducible arginine and lysine- decarboxylase genes of Escherichia coli K-12[J]. Molecular Microbiology, 1989, 3(5): 609-620.
[42] KOWALCZYK L, RATERA M, PALADINO A, et al. Molecular basis of substrate-induced permeation by an amino acid antiporter[J]. Proceedings of the National Academy of Science of the United States of America, 2011, 108(10): 3935-3940.
[43] ALVAREZ-ORDONEZ A, FERNANDEZ A, BERNARDO A, et al. Arginine and lysine decarboxylases and the acid tolerance response of Salmonella Typhimurium[J]. International Journal of Food Microbiology, 2010, 136(3): 278-282.
[44] HONG Weizhe, WU Ye, FU Xinmiao, et al. Chaperone-dependent mechanisms for acid resistance in enteric bacteria[J]. Trends in Microbiology, 2012, 20(7): 328-335.
[45] HOMMAIS F, KRIN E, LAURENT-WINTER C, et al. Largescale monitoring of pleiotropic regulation of gene expression by the prokaryotic nucleoid associated protein H-NS[J]. Molecular Microbiology, 2001, 40(1): 20-36.
[46] TUCKER D L, TUCKER N, CONWAY T. Gene expression profiling of the pH response in Escherichia coli[J]. Journal of Bacteriology, 2002, 184(23): 6551-6558.
[47] TRAMONTI A, VISCA P, de CANIO M, et al. Functional characterization and regluation of gadX, a gene encoding an AraC/ XylS-like transcriptional activator of the Echerichia coli glutamic acid decarboxylase system[J]. Journal of Bacteriology, 2002, 184(34): 2603-2613.
[48] WU Y, HONG W Z, LIU C, et al. Conserved amphiphilic feature is essential for periplasmic chaperone HdeA to support acid resistance in enteric bacteria[J]. The Biochemical Journal, 2008, 412(2): 389-397.
[49] GONG S, RICHARD H, FOSTER J W. YjdE (AdiC) is the arginine: agmatine antiporter essential for arginine-dependent acid resistance in Escherichia coli[J]. Journal of Bacteriology, 2003, 185(12): 4402-4409.
[50] GAJIWALA K S, BURLEY S K. HDEA, a periplasmic protein that supports acid resistance in pathogenic enteric bacteria[J]. Journal of Molecular Biology, 2000, 295(3): 605-612.
[51] STAUFFER L T, STAUFFER G V. Antagonistic Roles for GcvA and GcvB in hdeAB expression in Escherichia coli[J]. ISRN Microbiology, 2012, 697308. http://dx.doi.org/10.5402/2012/697308.
[52] MASUDA N, CHURCH G M. Regulatory network of acid resistance genes in Escherichia coli[J]. Molecular Microbiology, 2003, 48(3): 699-712.
[53] HONG W Z, JIAO W W, HU J C, et al. Periplasmic protein HdeA exhibits chaperone-like activity exclusively within stomach pH range by transforming into disordered conformation[J]. The Journal of Biological Chemistry, 2005, 280(29): 27029-27034.
[54] GARRISON M A, CROWHURST K A. NMR-monitored titration of acid-stress bacterial chaperone HdeA reveals that Asp and Glu chargeneutralization produces a loosened dimer structure in preparation for protein unfolding and chaperone activation[J]. Protein Science, 2014, 23(2): 167-178.
[55] TAPLEY T L, KOERNER J L, BARGE M T, et al. Structural plasticity of an acid-activated chaperone allows promiscuous substrate binding[J]. Proceedings of the National Academy of Sciences, 2009, 106(14): 5557-5562.
[56] WANG W J, RASMUSSEN T, HARDING A J, et al. Salt bridges regulate both dimer formation and monomeric flexibility in HdeB and may have a role in periplasmic chaperone function[J]. Journal of Molecular Biology, 2012, 415(3): 538-546.
[57] 任潔, 趙明文, 姚玉峰. 沙門菌對酸壓力的應答及其與毒力的關系[J].微生物學報, 2014, 54(4): 367-375.
[58] BROWN J L, ROSS T, MCMEEKIN T A, et al. Acid habituation of Escherichia coli and the potential role of cyclopropane fatty acids in low pH tolerance[J]. International Journal of Food Microbiology, 1997, 37(2/3): 163-173.
[59] CHANG Y Y, CRONAN J E. Membrane cyclopropane fatty acid content is a major factor in acid resistance of Escherichia coli[J]. Molecular Microbiology, 1999, 33(2): 249-259.
[60] DUFOURC E J, SMITH I C P, JARRELL H C. The role of cyclopropane moieties in the lipid properties of biological membranes: a deuterium NMR structural and dynamical approach[J]. Biochemistry, 1984, 23: 2300-2309.
[61] IYER R, IVERSON T M, ACCARDI A, et al. A biological role for prokaryotic ClC chloride channels[J]. Nature, 2002, 419: 715-718.
[62] IYER R, MILLER C. Acid resistance: a biological role for prokaryotic ClC chloride channels[J]. Biophysical Journal, 2002, 82(1): 12-13.
[63] ACCARDI A, MILLER C. Secondary active transport mediated by a prokaryotic homologue of ClC Cl-channels[J]. Nature, 2004, 427: 803-807.
[64] JENKINS D F, SCHULTZ J E, MATIN A. Starvation-in-duced cross protection against heat or H2O2challenge in Escherichia coli[J]. Journal of Bacteriology, 1988, 170: 3910-3914.
[65] MAZZOTTA A S. Thermal inactivation of stationary-phase and acid-adapted Escherichia coli O157:H7,Salmonella, and Listeria monocytogenes in fruit[J]. Journal of Food Protection, 2001, 64(3): 315-320.
[66] WANG G, DOYLE M P. Heat shock response enhances acid tolerance of Escherichia coli O157:H7[J]. Letters in Applied Microbiology Applied Microbiology, 1998, 26(1): 31-41.
[67] ARNOLD K W, KASPAR C W. Starvation- and stationary-phaseinduced acid tolerance in Escherichia coli O157:H7[J]. Applied and Environmental Microbiology, 1995, 61(5): 2037-2039.
[68] ELHANAFI D, LEENANON B, BANG W, et al. Impact of cold and cold-acid stress on post-stress tolerance and virulence factor expression of Escherichia coli O157:H7[J]. Journal of Food Protection, 2004, 67: 19-26.
[69] CAMPBELL J, BANG W, ISONHOOD J, et al. Effects of salt, acid, and MSG on cold storage survival and subsequent acid tolerance of Eschrichia coli O157:H7[J]. Food Microbiology, 2004, 21(6): 727-735.
[70] ABEE T, WOUTERS J A. Microbial stress response in minimal processing[J]. International Journal of Food Microbiology, 1999, 50(1/2): 65-91.
Recent Progress in Molecular Mechanism of Acid Resistance in Escherichia coli
CHEN Zhuozhu, KAN Jianquan, SHI Hui*
(Laboratory of Quality and Safety Risk Assessment for Agro-products on Storage and Preservations (Chongqing), Ministry of Agriculture, Chongqing Key Laboratory of Produce Processing and Storage, College of Food Science, Southwest University, Chongqing 400715, China)
Some strains of Escherichia coli are resistant to strong acid and can survive in acidic conditions, mainly because they have a variety of acid resistance mechanisms, including a glucose-repressed system, amino-acid-dependent system, chaperone proteins and systems for stabilizing membrane charge. Understanding the molecular mechanisms of acid resistance in E. coli can provide new insight into controlling contamination in the food processing industry, and play a positive role in clinical prevention and treatment of foodborne pathogens. In this paper, the molecular mechanisms of acid resistance in E. coli are reviewed.
Escherichia coli; glucose-repressed; amino-acid-dependent; chaperone proteins; membrane charge; crossprotection
TS201.3
A
1002-6630(2015)21-0273-06
10.7506/spkx1002-6630-201521051
2015-03-26
國家自然科學基金青年科學基金項目(31401567);中央高校基本科研業務費專項資金項目(XDJK2014B020);
西南大學博士啟動資金項目(SWU113041)
陳卓逐(1990—),男,碩士研究生,研究方向為食品質量與安全。E-mail:chen_zhuo_zhu@163.com
*通信作者:石慧(1986—),女,講師,博士,研究方向為食品質量與安全。E-mail:shi_hui_1986@163.com

