HGF/c—met傳導通路在子宮內膜癌發生發展中的作用及意義
王江芬 王月玲

[摘要] 目的 檢測HGF/c-met傳導通路對Survivin、XIAP表達的影響,探討HGF/c-met通路在子宮內膜癌發生發展中的作用機制。 方法 培養ER表達水平不同的子宮內膜癌細胞系HEC-1B(ER低表達)和Ishikawa(ER高表達),通過MTT法檢測不同濃度HGF對兩種細胞增殖率的影響;AnnexinV-FITC法檢測不同濃度HGF對細胞凋亡率的影響。Western Blot檢測Survivin及XIAP蛋白的表達水平。 結果 HGF可促進子宮內膜癌細胞的增殖,在80 ng/mL內具有劑量依賴性,在72 h內具有時間依賴性(P<0.05);當HGF濃度為40 ng/mL時,HEC-1B細胞24 h增值率達到(87.0±0.02)%,為最適誘導濃度。Survivin、XIAP mRNA及蛋白的表達隨著HGF濃度的增高而上調,上調作用具有劑量效應關系。HGF在ER低表達的HEC-1B細胞中作用明顯高于Ishikawa細胞,差異具有統計學意義(P<0.05)。 結論 HGF/c-met傳導通路的激活可促進子宮內膜細胞增殖,抑制細胞凋亡,HGF/c-met可能是調控子宮內膜癌發生發展的分子靶點。
[關鍵詞] 子宮內膜癌;HGF/c-met傳導通路;Survivin;XIAP
[中圖分類號] R737.33 [文獻標識碼] A [文章編號] 1673-9701(2015)32-0001-07
[Abstract] Objective To detect the influence of HGF/c-met pathway on expression of survivin and XIAP and to discuss the action mechanism of HGF/c-met pathway in occurrence and ddevelopment of endometrial cancer. Methods Cell lines of endometrial cancer with different ER expression level were cultivated: HEC-1B(ER low expression) and Ishikawa (ER high expression). The effects of HGF in various concentrations on cell proliferation rate of both cell lines were detected by MTT method, and effects on cell apoptosis rate were detected by AnnexinV-FITC method. The expression levels of survivin and XIAP were measured by western blot. Results HGF facilitated the proliferation of endometrial cells, which was dose-dependent within 80 ng/mL, and time-dependent within 72 h(P<0.05); When HCF=40 ng/mL, the 24 h proliferation rate of HEC-1B cells reached (87.0±0.02)%, and 40 ng/mL was the optimum inducing concentration. The mRNA and protein expressions of surviving and XIAP were up regulated by the rising HGF concentration, which had a dose-effect relationship. The effect of HGF on ER low expression HEC-1B cells was evidently higher than that on Ishikawa cells, the difference was statistically significant(P<0.05). Conclusion The activation of HGF/c-met pathway can facilitate the proliferation and inhibit the apoptosis of endometrial cells. HGF/c-met is probably the molecular target regulating the occurrence and development of endometrial cancer.
[Key words] Endometrial cancer; HGF/c-met pathway; Survivin; XIAP
子宮內膜癌是女性生殖系統三大惡性腫瘤之一。近年來,其發病率在世界范圍內呈上升趨勢[1]。子宮內膜癌發生發展的分子機制目前尚未完全明白。近年來,研究發現,腫瘤分子傳導通路與腫瘤的發生發展密切相關[2,3]。c-met原癌基因編碼肝細胞生長因子(hepatocyte growth factor,HGF)受體,HGF與c-met結合,激活c-met受體發生磷酸化,通過c-met信號通路發揮多種生物學效應[4]。文獻報道,HGF/c-met傳導通路在多種惡性腫瘤組織中過度激活,不僅c-met的表達水平上調,血清HGF濃度也增高,與腫瘤細胞的增殖,凋亡和侵襲能力有關[5]。本研究成員在前續實驗中證實c-met在子宮內膜癌組織中表達上調,其上調程度與臨床分期、組織學分級及淋巴轉移相關[6]。
細胞增殖及凋亡受癌基因及抑癌基因調控,如Bcl-2家族,IAP家族等,IAP家族通過細胞色素c和細胞凋亡活化因子1抑制其下游因子caspase-9的活化,從而抑制細胞凋亡[7]。研究發現,HGF/c-met 傳導通路通過AKT通路影響其下游因子Survivin、XIAP的表達進而影響大腸癌的增值和凋亡[8]。本實驗通過體外HGF激活c-met傳導通路,研究c-met在子宮內膜癌細胞系中的表達并進一步分析其下游因子Survivin、XIAP的表達,探討其在子宮內膜癌發生發展中的作用,為進一步研究子宮內膜癌發生發展的分子機制提供理論基礎。
1 資料與方法
1.1 細胞選擇及來源
本實驗所選擇Ishikawa細胞為一種高分化的子宮內膜癌細胞,其雌激素受體表達為陽性。而低分化子宮內膜癌來源的HEC-1B細胞,其雌激素受體表達水平極低,國內學者大部分將其視為ER陰性的子宮內膜癌細胞[9]。本實驗時間為2013~2015年。
1.2 主要試劑
RPMI1640培養基為GIBCO公司生產,胰酶為北京索萊寶科技有限公司生產(Solarbio),血清為蘭州民海生物工程有限公司生產的優級新生牛血清。RNA提取試劑:RNAisoTMPlus寶生物工程有限公司,反轉錄試劑盒:PrimeScriptTMRT reagent Kit寶生物工程有限公司。HGF購自PeproTech公司,Survivin兔抗人多克隆抗體購自美國Sant Cruz 公司,XIAP兔抗人多克隆抗體購自bioworld公司,β-actin兔抗人多克隆抗體購自北京博奧森生物技術有限公司,羊抗兔二抗購自Pioneer Biotechnolgy。
1.3 實驗方法
1.3.1 細胞培養 子宮內膜癌Ishikawa 和HEC-1B 細胞分別常規培養置于含10%胎牛血清(經56℃水浴30 min滅活)的RPMI 1640 培養基中,于37℃、5% CO2培養箱中培養,3~4 d傳代一次。取對數生長期細胞為實驗對象。
1.3.2 MTT法檢測HGF對細胞增殖活性的影響 將生長良好的細胞接種于96孔板中,3×103個細胞/孔,分別加入不同濃度(0、10、20、40、80 ng/mL)HGF和PBS繼續培養24 h后,加入MTT(5 mg/mL)20 μL/孔繼續培養4 h,吸盡各孔中的培養液,加入DMSO 150 μL/孔,振蕩10 min,使結晶物充分溶解后在酶聯免疫檢測儀上測定各孔在波長為490 nm處的吸光度(D)值。每組設5個復孔,實驗重復3次。細胞增殖率=處理組吸光度值/對照組吸光度值-1。
1.3.3 AnnexinV-FITC法檢測不同濃度HGF對細胞凋亡率的影響 不同濃度HGF(10、20、40 ng/mL)及PBS處理,細胞繼續培養24 h后冰預冷PBS洗滌細胞兩次,1000 rpm離心2 min,收集細胞,以106細胞/mL的濃度重懸于結合緩沖液中。取100 μL細胞懸液(105個細胞)加入離心管中,分別加入5 μL Annexin V-FITC和10 μL PI;輕輕震蕩混勻,室溫暗室孵育15 min。每管加入400 μL PBS,混勻,立即進行流式細胞儀分析。
1.3.4 RT-PCR半定量c-met、Survivin、XIAP mRNA 當細胞生長至80%融合時,分別加入不同濃度HGF(10、20、40 ng/mL)和PBS繼續培養24 h,取細胞約106個,提取細胞總RNA,以0.5 μg總RNA為模板反轉錄合成第一鏈cDNA,反轉錄反應條件為85℃ 15 min、60℃ 5 s。所有引物均合成自華大基因公司,引物序列見表1。按照PCR反應試劑盒的說明設置反應條件如下,94℃熱啟動5 min,94℃變性30 s,退火30 s,72℃延伸30 s,擴增c-met、Survivin、XIAP、GAPDH片段,擴增反應的退火溫度分別為55℃、58℃、55℃、55℃,反應循環均為30次。配置0.5×TBE buffer,制備2%瓊脂糖凝膠,加樣孔加樣5 μL,50 V電壓電泳30~40 min后凝膠成像分析,在適宜曝光速度下拍照,分析目標條帶和內參照條帶的熒光定量值。
1.3.5 Western blot檢測細胞中Survivin、XIAP的蛋白表達 當細胞生長至80%融合時,分別加入不同濃度HGF(0、20、40 ng/mL)和PBS繼續培養24 h,收獲細胞后配置RIPA裂解液提取細胞總蛋白,并用BCA蛋白質定量試劑盒測定蛋白濃度。取50 μg總蛋白進行12% SDS-PAGE電泳,將電泳產物轉移到NC膜上,在含5%脫脂奶粉的TBST中室溫搖床封閉兩小時,加入抗Survivin(1∶1000)、抗XIAP(1:500)單抗和抗β-actin單抗(1∶500 ),4°C孵育過夜。TBST洗膜3次,加入1∶5000稀釋的辣根過氧化物酶標記的二抗,室溫搖床培育1.5 h,按照ECL發光試劑盒說明書進行增強的化學發光顯色。Bandscan凝膠圖像分析軟件進行光密度分析。
1.4 統計學分析
采用SPSS 13.0統計學軟件進行分析。計量資料以均數±標準差(x±s)表示,以F檢驗檢測數據方差齊性,采用方差分析并采用LSD-t檢驗進行組間比較。所有結果均以α=0.05做為檢驗水準,判定結果。
2 結果
2.1 MTT法檢測HGF/c-met傳導通路的激活對細胞增殖的影響
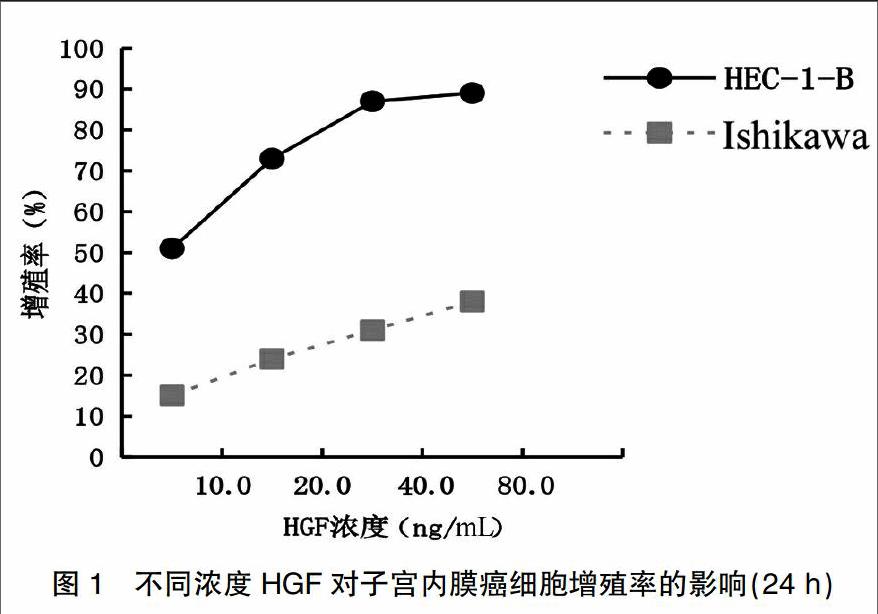
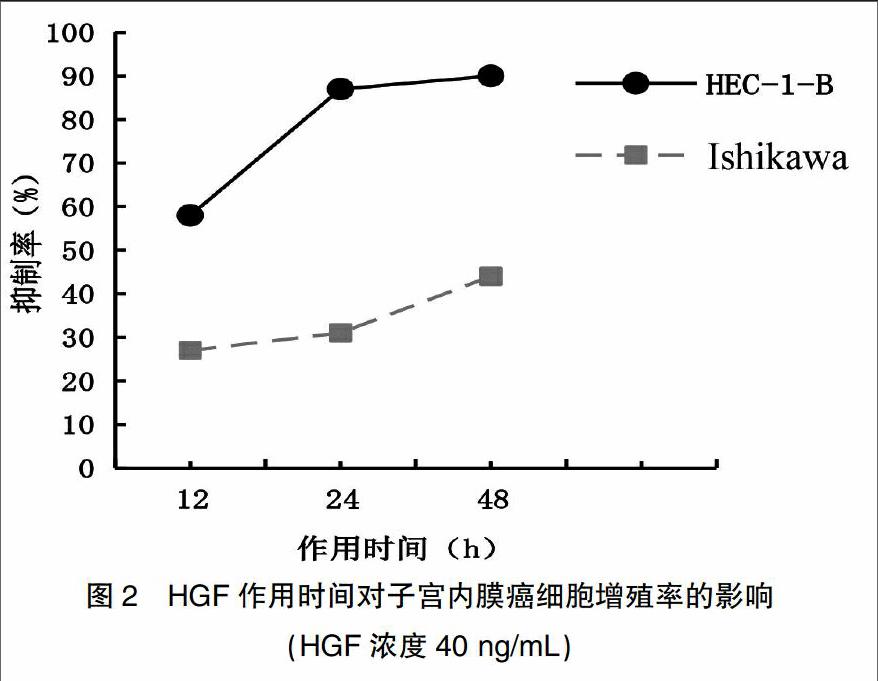
不同濃度HGF作用于子宮內膜癌細胞HEC-1B、Ishikawa 12、24、48 h后,各實驗組增殖率較對照組均明顯增高,且其增殖率呈HGF濃度及時間依賴性。在ER低表達的HEC-1B細胞中增殖作用明顯高于ER高表達的Ishikawa細胞,差異具有統計學意義(P<0.05)。在HEC-1B細胞中,HGF濃度由40 ng/mL增高為80 ng/mL時,其增殖率差異無統計學意義,故40 ng/mL為最適誘導濃度;HGF(40 ng/mL)作用24 h增殖率為(87.0±0.02)%,差異具有統計學意義(P<0.05),故24 h為最適作用時間。見表2、圖1、2。
2.2 Annexin V-FITC法檢測HGF/c-met傳導通路的激活對細胞凋亡的影響
不同濃度HGF作用子宮內膜癌細胞HEC-1B、Ishikawa 24 h后,早期凋亡細胞(右下象限)及中晚期凋亡細胞(右上象限)的百分比均減少。總凋亡率隨著HGF濃度的增高而減少,具有劑量效應關系(表3、圖4、5)。HGF對HEC-1B細胞的抗凋亡作用明顯高于ishikawa細胞,差異具有統計學意義(圖3)。
2.3 c-met在HEC-1B和Ishikawa細胞中的基礎表達
通過RT-PCR半定量ER表達水平不同的兩種子宮內膜癌細胞中c-met mRNA的相對水平,結果表明,ER高表達的Ishikawa細胞c-met表達水平較低,而ER低表達的HEC-1B細胞c-met明顯高表達,對條帶積光度進行分析,HEC-1B細胞中c-met mRNA表達量約為Ishikawa中的2.5倍(圖6)。
2.4 HGF對c-met、Survivin、XIAP mRNA表達水平的影響
不同濃度HGF處理HEC-1B及Ishikawa細胞后,RT-PCR法半定量c-met、Survivin、XIAP mRNA,結果顯示:HGF/c-met傳導通路的激活可上調Survivin、XIAP mRNA的表達,且呈HGF劑量效應關系,在HEC-1B細胞中,該上調作用明顯高于Ishikawa細胞,差異具有統計學意義(P<0.05),見圖7、表4、5。
2.5 HGF對Survivin、XIAP 蛋白的表達
不同濃度HGF作用HEC-1B、Ishikawa細胞后,Survivin、XIAP蛋白表達升高,且其表達量呈HGF劑量效應關系。40 ng/mL HGF處理HEC-1B細胞后,Survivin表達水平較對照組上調2.1倍;XIAP較對照組上調2.2倍(圖8、表6、7)。在HEC-1B細胞中,該上調作用明顯高于Ishikawa細胞,差異具有統計學意義(P<0.05)。
3 討論
目前,子宮內膜癌的發病機制仍不清楚,其發生發展涉及多個基因的異常,其中c-met的異常表達及其相關傳導通路的調控近年備受關注。在子宮內膜癌組織中c-met高表達,對應血清HGF濃度也增高,二者構成異常自分泌環,促進腫瘤的發生發展[5]。
c-met是新近發現的一促癌因子,其是由原癌基因c-met編碼的一種酪氨酸激酶受體, 與細胞增殖與存活、細胞遷移、誘導細胞極化、血管形成、損傷修復、組織重建等生物學效應相關[4]。研究表明,人類的許多腫瘤組織中均存在c-met的過表達,如胰腺癌、胃癌、結腸癌、肝細胞癌、肺癌、卵巢癌、乳腺癌和淋巴瘤等[10]。c-met在腫瘤中高表達,促進腫瘤細胞的增殖,侵襲及轉移,并與腫瘤局部組織微血管形成有關,是惡性腫瘤靶向治療的靶點之一[11]。但目前針對c-met基因在子宮內膜癌中的研究尚淺,大部分局限于表達異常,其下游因子及相關傳導通路的研究尚少。本實驗通過RT-PCR半定量ER表達水平不同的兩種子宮內膜癌細胞中c-met mRNA的相對水平,結果表明,ER高表達的Ishikawa細胞c-met表達水平較低,而ER低表達的HEC-1B細胞c-met明顯高表達,且HEC-1B細胞中c-met mRNA表達量約為Ishikawa中的2.5倍,與前續實驗子宮內膜癌組織中c-met表達與ER呈負相關相一致[6]。這一結果從基因水平證實c-met在子宮內膜癌特別是ER低表達的子宮內膜癌發生發展中起重要作用,為我們下一步研究子宮內膜癌中c-met傳導通路及下游分子奠定了基礎。
研究表明,凋亡的抑制與腫瘤的發生密切相關。促進細胞增殖和抑制其凋亡的蛋白表達過多,使子宮內膜細胞逃逸生長調控,這可能是子宮內膜癌發病機制中的關鍵環節[12-14]。細胞的增殖、凋亡在正常情況下受許多信息的調控,腫瘤的形成與細胞增殖凋亡失衡密切相關。c-met作為癌基因,其表達產物促進細胞增殖,抑制細胞凋亡,在腫瘤形成過程中起著不可忽視的作用[5]。HGF作為c-met的配體,與c-met結合,激活c-met受體發生磷酸化,其酪氨酸激酶活性增強,通過c-met信號通路引起其下游多種底物蛋白磷酸化水平增高。c-met信號通路包括表面共存受體和相關下游通路(絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)和Stat3等[15,16]。本實驗通過MTT法檢測HGF/c-met傳導通路的激活對子宮內膜癌細胞增殖的影響,AnnexinV-FITC法檢測其對細胞凋亡的影響,結果表明HGF/c-met信號傳導通路的激活可促進子宮內膜癌細胞增殖,抑制細胞凋亡,且呈明顯的濃度依賴性。該生物學效應在ER低表達的HEC-1B細胞中較ER高表達的Ishikawa更明顯,說明HGF/c-met傳導通路的過度激活參與子宮內膜細胞異常增殖,凋亡受抑,從而導致子宮內膜癌的發生及惡性化,且其在ER低表達的子宮內膜癌發生發展中作用更為明顯,這可能也是ER低表達的子宮內膜癌預后不良的一個可能因素。這一推論為我們提供了子宮內膜癌輔助治療的新方法:阻斷HGF/c-met傳導通路,抑制c-met的激活可能成為子宮內膜癌特別是ER低表達或不表達子宮內膜癌的治療及預防復發的新方法。
凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)家族是一類廣泛存在于酵母、昆蟲及哺乳動物細胞中的進化上高度保守的細胞死亡抑制分子。迄今為止已確定的哺乳動物IAP家族成員有NIAP、c-IAPI、c-IAPZ、XIAP、appollon、Ts-XIAP、livin、Survivin、Bruce等[17-19]。本實驗選取IAP家族中最具代表性的Survivin和XIAP作后續研究。Survivin表達的腫瘤特異性最強,因而受到了廣大研究者的關注,然而Survivin與子宮內膜癌關系的研究目前仍局限于表達異常方面,其作用機制及相關通路調控研究尚少。X染色體連鎖的凋亡抑制基因(X-linked inhibitor of apoptosis protein,XIAP)是凋亡抑制基因家族中重要的成員之一,其編碼的蛋白XIAP通過選擇性的抑制Caspase3、7和9,并參與其它途徑來抑制細胞的凋亡,XIAP是該基因家族中唯一能夠同時抑制起始和效應階段的IAP[20]。子宮內膜癌中,c-met傳導通路所引起的細胞增殖與凋亡抑制是否與IAP家族具有某種聯系呢?國內外未見相關報道。本實驗假定Survivin、XIAP為HGF/c-met傳導通路的下游因子,通過HGF激活c-met傳導通路,通過RT-PCR及western blot對Survivin、XIAP進行mRNA及蛋白的定量[21]。本實驗研究結果顯示,在子宮內膜癌HEC-1B和Ishikawa細胞中,HGF呈濃度依賴性誘導Survivin及XIAP的表達,在c-met高表達的HEC-1B中,該誘導作用更明顯。在HEC-1B細胞中,HGF濃度為40 ng/mL作用24 h,Survivin 較對照組上調2倍,XIAP上調3倍。以上實驗結果表明HGF/c-met傳導通路的激活在轉錄及翻譯水平上調Survivin、XIAP的表達,進而抑制子宮內膜癌細胞凋亡,促進細胞增殖,促進子宮內膜癌的發生發展。同時該結果提示Survivin、XIAP可能是HGF/c-met傳導通路的下游因子,然而,該誘導作用是通過什么途徑發揮的,尚需后續研究。
綜上所述,HGF/c-met傳導通路的激活可上調Survivin、XIAP的表達,促進子宮內膜細胞增殖,抑制細胞凋亡,且在ER低表達的子宮內膜癌中作用更顯著,Survivin、XIAP可能是HGF/c-met傳導通路的下游因子,該傳導通路參與子宮內膜癌的發生發展,阻斷該傳導通路為我們提供了一條子宮內膜癌治療及預防的新思路。子宮內膜癌的發病機制仍需要更為深入地研究。相信隨著研究的不斷深入,我們會更加深刻地了解HGF/c-met信號傳導系統在子宮內膜癌中的功能,揭示其內在的分子機制以及潛在的臨床應用價值。
[參考文獻]
[1] Jonathan S,Berek N. 婦科學[M]. 北京:人民衛生出版社,2008.
[2] Mendes KN,Nicorici D,Cogdell D,et al. Analysis of signaling pathways in 90 cancer cell lines by protein lysate array[J]. Journal of Proteome Research,2007,6(7): 2753-2767.
[3] Su HY,Lai HC,Lin YW,et al. Epigenetic silencing of SFRP5 is related to malignant phenotype and chemoresistance of ovarian cancer through Wnt signaling pathway[J]. International Journal of Cancer,2010,127(3):555-567.
[4] Maulik G,Shrikhande A,Kijima T,et al. Role of the hepatocyte growth factor receptor,c-met,in oncogenesis and potential for therapeutic inhibition[J]. Cytokine & Growth Factor Reviews,2002,13(1):41-59.
[5] Kammula US,Kuntz EJ,Francone TD,et al. Molecular co-expression of the c-met oncogene and hepatocyte growth factor in primary colon cancer predicts tumor stage and clinical outcome[J]. Cancer Letters,2007,248(2):219-228.
[6] Yueling Wang,Weidong Dai,Jiangfen Wang,et al. Expression of estrogen receptor subtypes and c-met proto-oncogene in endometrial carcinoma and their correlation[J]. Academic Journal of Xian Jiaotong University,2010,22(1):54-58.
[7] Hunter AM,LaCasse EC,Korneluk RG. The inhibitors of apoptosis(IAPs)as cancer targets[J]. Apoptosis,2007,12(9):1543-1568.
[8] Takeuchi H,Kim J,Fujimoto A,et al. X-linked inhibitor of apoptosis protein expression level in colorectal cancer is regulated by hepatocyte growth Factor/C-met pathway via Akt signaling[J]. Clinical Cancer Research,2005,11(21):7621-7628.
[9] Guseva NV,Dessus-Babus SC,Whittimore JD,et al. Characterization of estrogen-responsive epithelial cell lines and their infectivity by genital Chlamydia trachomatis[J]. Microbes and Infection,2005,7(15):1469-1481.
[10] Ma PC,Maulik G,Christensen J,et al. c-met:Structure,functions and potential for therapeutic inhibition[J]. Cancer and Metastasis Reviews,2003,22(4):309-325.
[11] Abidoye Oyewale,Murukurthy Nadh,Salgia Ravi. Review of clinic trials:Agents targeting c-Met[J]. Rev Recent Clin Trials,2007,2(2):143-147.
[12] Ai ZH,Yin LH,Zhou XR,et al. Inhibition of survivin reduces cell proliferation and induces apoptosis in human endometrial cancer [J]. Cancer,2006,107(4):746-756.
[13] Nachmias B,Ashhab Y,Ben-Yehuda D. The inhibitor of apoptosis protein family(IAPs):An emerging therapeutic target in cancer[J]. Seminars in Cancer Biology,2004,14(4):231-243.
[14] Eckelman BP,Salvesen GS,Scott FL. Human inhibitor of apoptosis proteins:Why XIAP is the black sheep of the family[J]. Embo Reports,2006,7(10):988-994.
[15] Wang XF,Wu YH,Wang MS,et al. CEA,FP,CA125,CA153 and CA199 in malignant pleural effusions predict the cause[J]. Asian Pacific Journal of Cancer Prevention,2014,3(2):611-620.
[16] 高新萍,趙麗君. 子宮內膜癌患者血清及病理分子標志物與其病理特征關系的研究[J]. 中國婦產科臨床雜志,2014,4(6):45-49.
[17] 趙玉斌. 子宮內膜癌EphB4、ERα和ERβ的表達及意義[J]. 中國婦幼保健,2014,6(28):33-36.
[18] Keam Bhumsuk,Im Seock-Ah,Lee Kyung-Hun,et al.Ki-67 can be used for further classification of triple negative breast cancer into two subtypes with different response and prognosis[J]. Breast cancer research:BCR,2013,21(2):71-82.
[19] Chen Yu-Li,Huang Chia-Yen,Chien Tsai-Yen,et al. Value of pre-operative serum CA125 level for prediction of prognosis in patients with endometrial cancer[J]. The Australian & New Zealand Journal of Obstetrics & Gynaecology,2014,11(3):61-70.
[20] A Ben Arie,O Lavie,M Gdalevich,et al. Temporal pattern of recurrence of stage I endometrial cancer in relation to histological risk factors[J]. European Journal of Surgical Oncology,2012,14(5):98-111.
[21] S Erkanli,F Kayaselcuk,E Kuscu,et al. Expression of survivin,PTEN and p27 in normal,hyperplastic,and carcinomatous endometrium[J]. International Journal of Gynecological Cancer,2012,3(6):11-23.
(收稿日期:2015-08-06)

