輔酶Q10注射液熱原標準的研究
王麗娟 肖中元 周 玲 楊紅濤 陳真文 程永剛(西南藥業股份有限公司,中國 重慶400038)
輔酶Q10注射液廣泛應用于充血性心力衰竭、冠心病、高血壓、心律失常、原發性繼發性醛固酮增多癥、頸部外傷后遺癥、腦血管障礙、失血性休克及肝炎等疾病的輔助治療,但是,國家食品藥品監督管理局明文規定,其成品進入市場前必須按照《中國藥典》2010版二部的相關規定檢查熱原。目前,輔酶Q10注射液熱原測定主要采用家兔法,該方法雖然準確度較高,然而存在操作不變且難以到達快速檢測的目的等缺陷。研究表明,細菌內毒素檢查法又稱鱟試驗法(bacterial endatoxin text,BET)檢測藥品中內毒素含量具有快速、靈敏、經濟、重現性好等優點,并在國內外得到了日益廣泛的應用。基于此,本文旨在研究細菌內毒素法檢測輔酶Q10注射液中細菌內毒素的可行性,以期建立輔酶Q10注射液熱原檢測的替代質量標準。
1 試驗材料及儀器
1.1 輔酶Q10注射液
規格:2ml:輔酶Q10 5mg,
批號:140808,141101,141102,141103,141104,141105,141106。
來源:西南藥業股份有限公司。
1.2 細菌內毒素材料
細菌內毒素工作標準品:10EU/支,批號1309010,購自湛江安度斯生物有限公司。
鱟試劑:①λ為0.25Eu/ml,批號:1301120,購自湛江博康海洋生物制品廠。
②λ為0.25Eu/ml,批號:1302071,購自湛江安度斯生物有限公司。BET水:5ml/支,批號:1209050,購自湛江安度斯生物有限公司。
1.3 儀器
電熱恒溫干燥箱GZX-DH-50×55(上海躍進醫療器械廠);凈化工作臺(重慶利通空調凈化設備公司);電熱恒溫水浴鍋H.S.G 20-4(臨海市東方儀器儀表廠);實驗所用玻璃器皿均進行250℃干燥2h處理。
2 試驗方法
2.1 輔酶Q10注射液細菌內毒素限值
根據細菌內毒素檢查法(《中國藥典》2010年版二部附錄XI E)的規定,按以下公式計算內毒素限值:L=K/M。式中內毒素限值L是以EU/ml、EU/mg或EU/u表示;K為按規定給藥途徑時人體每公斤體重每小時最大可耐受的內毒素劑量,以EU/(kg·h)表示,注射劑規定為:K=5 EU/(kg·h)。一般我國人群平均體重按60kg計算,人體對細菌內毒素的最大耐受量為300EU/h;另我國人體的平均體表面積按1.55m2計算,人體每平方米的最大耐受劑量為(300EU/h)/1.55m2=(193EU/h)/m2。M為人體每公斤體重每小時接受的最大給藥劑量,以ml/(kg·h)、mg/(kg·h)或u/(kg·h)表示。
從輔酶Q10注射液的使用說明書可知,本品用于靜脈滴注,每天用藥量5-10mg輔酶Q10,與100-250ml的氯化鈉注射液配伍需在2h內滴完。根據聯合用藥可知,K總=k1+k2,(k1為氯化鈉注射液的耐受劑量,K2為Q10的耐受劑量。根據2010版中國藥典可知,k1=250*0.5/(60*2)=125/120 EU/(kg·h),K2=5-125/120=475/120 EU/(kg·h),輔 酶Q10注射液的L值為K2/M=475/120/10/120=47.5EU/mg。
2.2 樣品最大有效稀釋倍數
最大有效稀釋倍數(MVD)是指在實驗中供試品溶液被允許稀釋的最大倍數,在不超過此稀釋倍數的濃度下進行內毒素限值的檢測。計算樣品最大有效稀釋倍數,按以下公式計算:MVD=CL/λ,式中L為供試品的細菌內毒素限值;C為供試品溶液的濃度,當L以EU/ml表示時,則C等于1.0ml/ml,當L以EU/mg或EU/U表示時,C的單位需為mg/ml或U/ml;λ為在凝膠法中鱟試劑的標示靈敏度(EU/ml)。
由L值可求得最大有效稀釋倍數。本品的MVD=CL/λ=2.5×47.5/0.25=475.
2.3 鱟試劑靈敏度復核
根據中國藥典2010年版二部附錄XI E項下“鱟試劑靈敏度復核試驗”方法用湛江海洋生物制品廠和湛江安度斯生物有限公司內毒素樣品用于試驗,結果如表1和表2所示。靈敏度復核的測定值λC1(湛江海洋生物制品)為0.25 Eu/ml,λC2(湛江安度斯生物有限公司)為0.2Eu/ml,其結果均約0.5λ~2.0λ之間,可用于試驗。
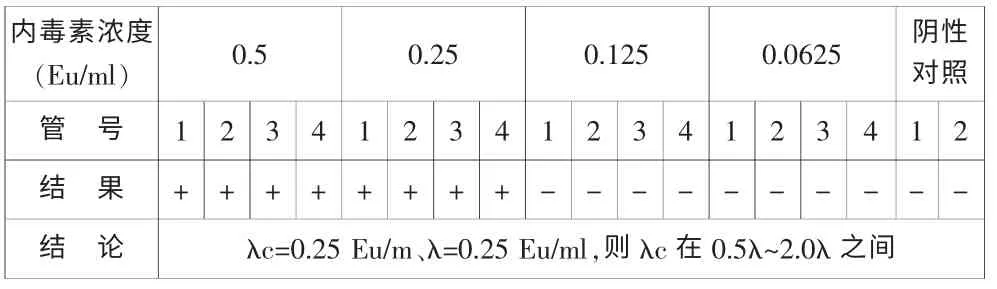
表1 鱟試劑靈敏度復核結果(湛江海洋生物制品廠)

表2 鱟試劑靈敏度復核結果(湛江安度斯生物有限公司)
2.4 干擾試驗
取141101批樣品,分別稀釋50倍、100倍、200倍、400倍、450倍、475倍后,分別用λ為0.25Eu/ml的鱟試劑(購自湛江海洋生物制品廠)和λ為0.25Eu/ml的鱟試劑(購自湛江安度斯生物有限公司)進行干擾試驗。結果如表3和表4。
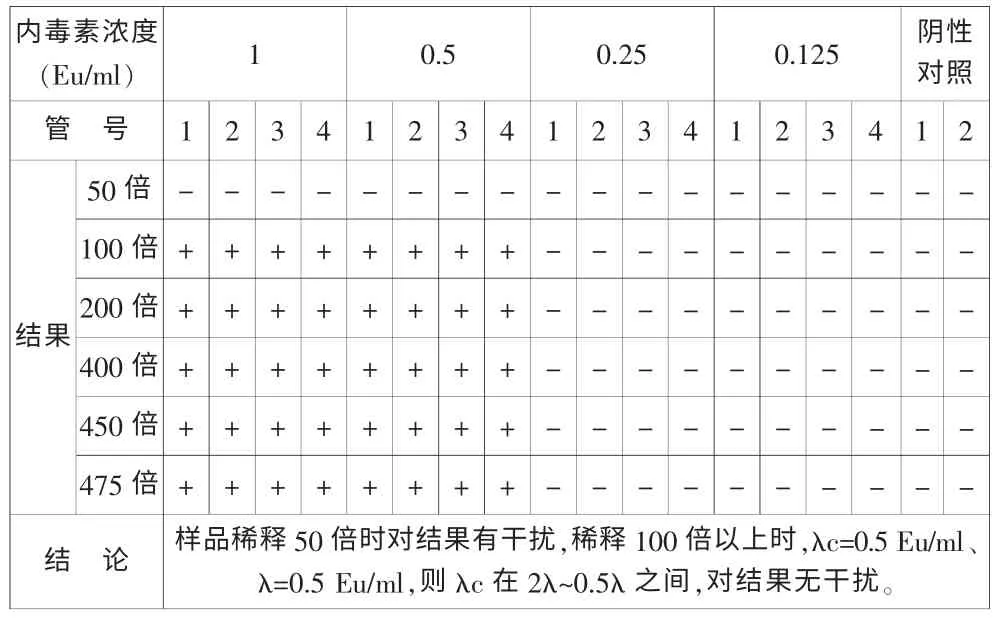
表3 湛江海洋生物制品廠鱟試劑干擾試驗
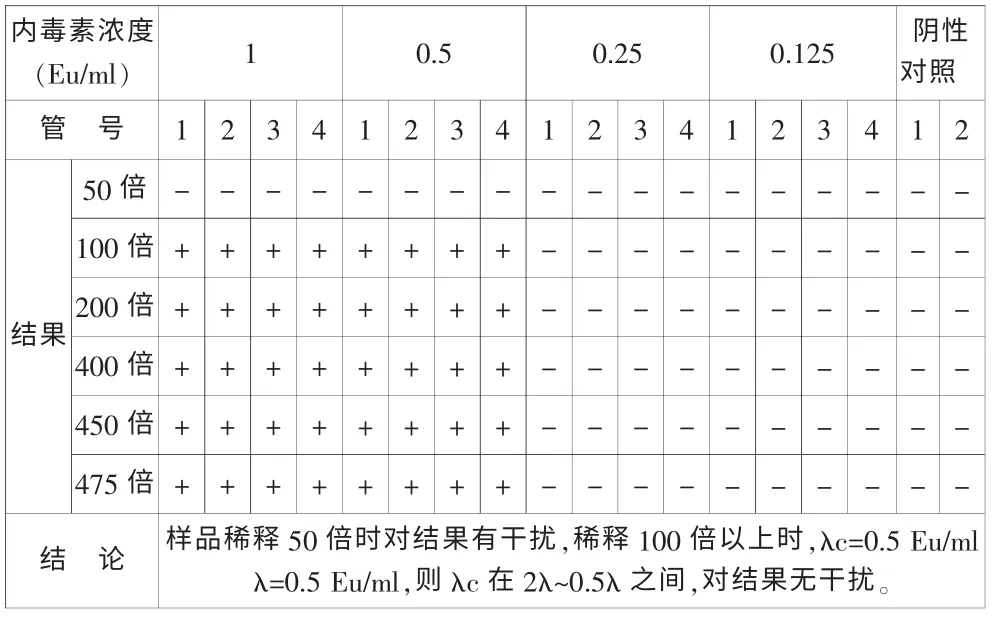
表4 湛江安度斯生物有限公司鱟試劑干擾試驗
從表3和表4可見:用靈敏度為0.25 EU/mL的TAL進行試驗,50倍稀釋液有干擾,100倍稀釋液無干擾。表明本品最小不干擾稀釋倍數為100倍。
2.5 樣品測定
將家兔法檢查合格的141101批樣品分別稀釋100倍、200倍、400倍、475倍后,按《中國藥典》2010版二部附錄測定,結果如表5。將家兔法檢查不合格的140808批樣品分別稀釋100倍、250倍、500倍、800倍和1000倍后,按《中國藥典》2010版二部附錄測定,結果如表6。
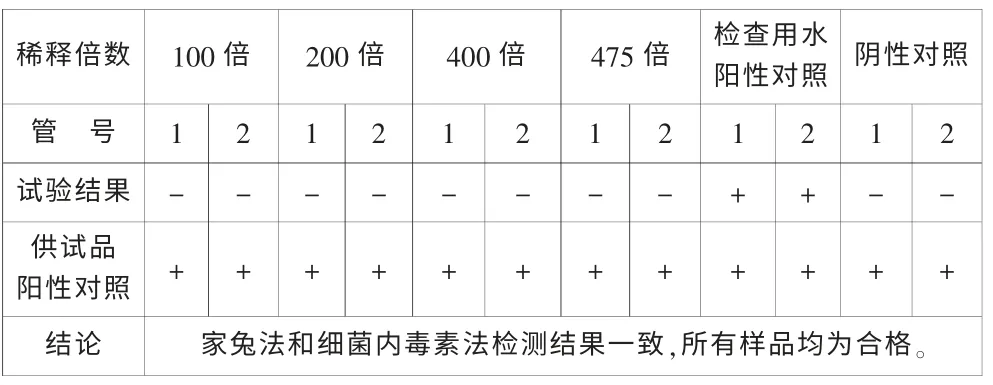
表5 141101批樣品細菌內毒素檢查結果
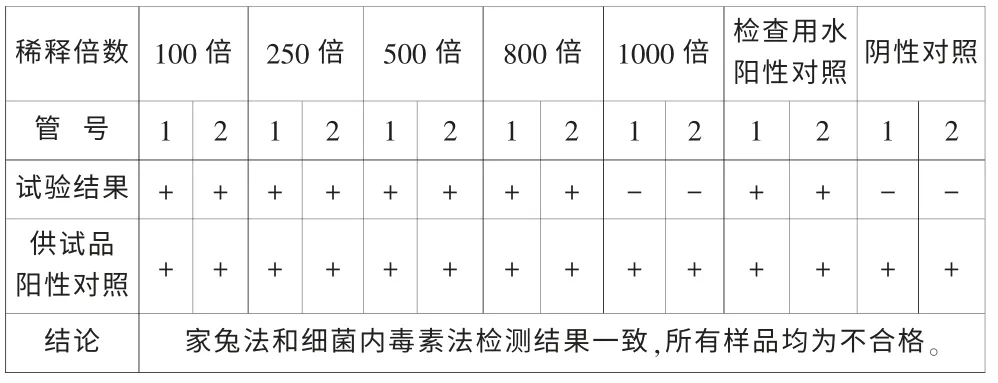
表6 140808批樣品細菌內毒素檢查法測定結果
2.6 質量指標的建立
如上所述,通過鱟試劑靈敏度試驗、干擾試驗及樣品測定,說明細菌內毒素法能夠應用于輔酶Q10注射液的細菌內毒素測定,其檢測結果與家兔法一致,表明該法可以替代熱原法對輔酶Q10注射液的質量控制。
為了保證輔酶Q10注射液產品的安全性,根據細菌內毒素測定的原理,將質量內控指標定為:樣品稀釋400倍后,按《中國藥典》2010版二部細菌內毒素法測定,應符合規定。
2.7 質量監控
對6個批次輔酶Q10注射液生產灌封前樣品采用細菌內毒素法檢測,成品采用家兔法檢測,結果如表7。細菌內毒素法與家兔法的檢測結果一致,說明細菌內毒素法完全適用于對本品的質量控制,且能保證成品質量。

表7 生產樣品測定結果
3 討論
細菌內毒素檢查法是一種體外熱原試驗法,它是通過考察藥品中存在的微量細菌內毒素而建立起來的,具備操作簡單.實驗費用少.結果迅速可得等優點,現已經被各國藥典正式收載。近年來,作為一項新技術、新方法,細菌內毒素檢查法雖然廣泛應用于藥品的熱原檢查,但其是否能夠滿足輔酶Q10注射液生產中成品的質量控制,目前鮮見報道。
本實驗研究發現,細菌內毒素檢查法能夠用于輔酶Q10注射液中細菌內毒素的測定,其檢測結果與家兔法一致,這表明該方法可以替代熱原法對輔酶Q10注射液的質量控制,并由此建立了用細菌內毒素檢查法測定本品的內控指標,即將樣品稀釋400倍后,按《中國藥典》2010版二部細菌內毒素法測定,應符合規定。如將此標準應用于生產,完全能夠滿足輔酶Q10注射液質量控制的要求。
[1]輔酶Q10注射液說明書[Z].西南藥業股份有限公司.
[2]中華人民共和國藥典2010版二部[Z].
[3]吳楊,趙云燕.細菌內毒素檢查法的應用進展[J].安徽醫藥,2004,8(3):226-227.

