活血通腑方含藥血清對大鼠腹膜間皮細胞增殖的作用
·基礎研究·
活血通腑方含藥血清對大鼠腹膜間皮細胞增殖的作用
顏帥曾莉李文林
(南京中醫藥大學,江蘇南京210023)
摘要〔〕目的觀察活血通腑方含藥血清干預體外培養大鼠腹膜間皮細胞增殖的效果,初篩對大鼠腹膜間皮細胞增殖能力有影響的最佳藥物劑量和時間。方法采用腹腔注射胰酶消化的方式建立RPMC細胞模型,運用血清藥理學方法制備不同劑量的活血通腑方含藥血清,細胞培養經鑒定成功后分組(空白組、空白血清組、活血通腑方低劑量組、活血通腑方中劑量組、活血通腑方高劑量組),應用 MTT法檢測活血通腑方含藥血清對大鼠腹膜間皮細胞的作用。結果與空白血清組比較,活血通腑方中劑量組含藥血清可顯著促進RPMC細胞增殖,作用時間在36 h 時最為顯著。結論活血通腑方含藥血清具有誘導大鼠腹膜間皮細胞增殖的作用。
關鍵詞〔〕活血通腑方;腹膜間皮細胞
中圖分類號〔〕R264〔文獻標識碼〕A〔
基金項目:國家自然科學基金面上項目(No.81373843);南京中醫藥大學中醫學一級學科開放課題資助項目(YS2012ZYX111)
通訊作者:曾莉(1962-),女,教授,博士生導師,主要從事術后腹腔粘連防治研究。
第一作者:顏帥(1986-),男,在讀博士,主要從事術后腹腔粘連防治研究。
Influence on proliferation of rat peritoneal mesothelial cells by serum containing of Huoxuetongfu formula
YAN Shuai,ZENG Li,LI Wen-Lin.
The First Medical College of Nanjing University of Chinese Medicine,Nanjing 210023,Jiangsu,China
Abstract【】ObjectiveTo investigate the influence of in vitro proliferation ability of rat peritoneal mesothelial cells(RPMCs) by serum containing of Huoxuetongfu formula and preliminary screen the optimum dose and time.MethodsTrypsin digestion method in vitro was used to establish RPMCs model,and divided into blank,blank serum,Huoxuetongfu formula low dose,Huoxuetongfu formula dose,Huoxuetongfu formula high dose groups.MTT was used to detect the effects of serum containing of Huoxuetongfu formula on RPMCs.ResultsCompared with those of blank serum group,huoxuetongfu formula drug serum improved RPMCs proliferation stimulating effect,and reaction time at 48h was the most significant.ConclusionsHuoxuetongfu formula drug serum has inducing role of RPMCs proliferation.
【Key words】Huoxuetongfu formula;Peritoneal mesothelial cell
腹膜間皮細胞可合成纖溶成分并分泌多種細胞因子,維持腹腔內局部微環境。相關研究顯示腹膜間皮細胞的完整性及功能正常與否是腹腔粘連形成的關鍵因素〔1〕。活血通腑方是曾莉教授依據祖國醫學“六腑以通為用”、“腑病以通為補”的原則,在總結多年臨床防治術后粘連經驗的基礎上形成的驗方。經藥效實驗和處方優化后〔2,3〕,在活血通腑方前期臨床療效觀察基礎上〔4〕,以整體動物為研究對象,發現活血通腑方能降低實驗性腹腔粘連大鼠術后血清白細胞介素(IL)-8、腫瘤壞死因子(TNF)-α水平,下調粘連組織中Col-Ⅰ mRNA的表達水平,防治粘連效果確切〔5〕。本實驗通過觀察活血通腑方的含藥血清對腹膜間皮細胞增殖的影響,獲取活血通腑方含藥血清干預大鼠腹膜間皮細胞的最佳藥物劑量和時間。
1材料與方法
1.1動物雄性清潔級SD 大鼠(原代細胞用),體質量160~180 g,由上海杰思捷實驗動物有限公司提供,許可證號碼:SCXK(滬)2012-0006。
1.2藥物大黃、桃仁、紅花、芒硝、延胡索、萊菔子由南京中醫藥大學附屬醫院提供,均由南京市藥品檢驗所核定。
1.3試劑DMEM/F12 培養基、胎牛血清、0.25% 胰蛋白酶-EDTA、青霉素、鏈霉素抗生素、D-Hank液(Gibco公司);各種免疫組化染色一抗、抗角蛋白(Keratin)抗體、抗波形蛋白(Vitamin)抗體、抗白細胞CD45 抗體、抗第Ⅷ因子抗體及 SABC 試劑盒(武漢博士德公司)。四甲基偶氮唑鹽(MTT,Sigma);二甲基亞砜(DMSO,南京凱基生物科技有限公司);多聚甲醛(天津市科密歐化學試劑有限公司);PBS緩沖液(自配)。
1.4主要儀器CPA224S電子分析天平(北京賽多利斯科學儀器有限公司);電恒水浴鍋、精密鼓風干燥箱(上海一恒科學儀器有限公司);CKX31倒置式生物顯微鏡(日本 OLYMPUS公司);常溫低速離心機(德國 Eppendorf 公司);垂直流超凈工作臺(新加坡藝思高科技有限公司);CO2恒溫培養箱(美國Thermo Scientific公司);Synergy 2全自動酶標儀(美國 Bio-Tek 公司);純水儀(美國Millipore公司)。
1.5藥物制備參照文獻〔5〕,取大黃,桃仁,延胡索,萊菔子各100 g,加飲片總量15倍的70%乙醇,分兩次回流提取,每次2 h,濾過,合并提取液,濾液減壓回收乙醇,濃縮至無醇味。上述藥渣與紅花60 g合并,加飲片總量20倍水,分3次煎煮,每次1 h,濾過,合并水煎液,濾液濃縮至相對密度為1.09~1.11(60℃),冷卻,加乙醇至含醇量50%,攪勻,靜置48 h,取上清液加芒硝100 g,濃縮至相對密度1.12~1.15(60℃),4℃儲存備用。灌胃前用生理鹽水配制成濃度分別為200、600、1 800 g/L的低、中、高劑量給藥樣品液。
1.6含藥血清的制備將大鼠隨機分為不含藥血清組、活血通腑方低、中、高劑量含藥血清組,每組6 只。每日上午給藥前將大鼠禁食12 h,活血通腑方低、中、高劑量含藥血清組分別按200、600、1 800 g/L劑量給大鼠灌胃,每日2次,連續3 d。不含藥血清組僅給予等體積生理鹽水灌胃,在最后一次給藥2 h 后,腹主動脈取血,取血后用頸椎脫臼法處死動物。血液置于10 ml離心管內,室溫放置1 h,待充分凝血后,4℃放置過夜。3 000 r/min離心15 min,分離血清,56℃水浴上放置30 min,在超凈工作臺內用0.22 μm 微孔濾器濾過除菌,無菌分裝,密封后-80℃保存備用。
參考文獻1.7細胞的培養、傳代及鑒定〔6~8〕,在大鼠腹腔內注射 0.25% 胰蛋白酶-0.02% EDTA 消化液,1.5 h后在超凈臺無菌打開腹腔,吸取腹腔液至15 ml 離心管,若肉眼可見紅細胞,則加紅細胞裂解液室溫裂解10 min,1 500 r/min離心10 min,棄上清并用D-Hank液將細胞洗一遍,離心棄上清,以含 15%胎牛血清的DMEM/F12培養基重懸細胞,置于37℃、5%CO2、濕度95%的培養箱中靜置培養。3 d 后細胞完全貼壁后換液,以后每 3 d換液 1 次,約培養6~9 d細胞融合至 90% 以上后可傳代培養。3 d后首次換液,以后根據細胞生長狀態每2~3 d換液1次,取第2代細胞經倒置顯微鏡觀察并采用免疫組化法對大鼠腹膜間皮細胞進行Keratin、Vitamin抗體、抗白細胞CD45 抗體、抗第Ⅷ因子(Factor Ⅷ)等相關抗原鑒定,取第3代細胞用于實驗。
1.8MTT法測定RPMC增殖選取狀態良好的對數生長期腹膜間皮細胞,0.25%胰蛋白酶消化后制成細胞懸液,調整細胞濃度,以每孔2×104/ml密度均勻接種于 96 孔培養板中,每孔加200 μl。每個培養板的周圍邊緣孔用0.01 mol/L PBS 填充。接種后將培養板放入37℃、5%CO2濕度95%的培養箱中靜置培養24 h,24 h后取出96孔板,棄去上清,加入0.5% FBS培養基繼續放入培養箱中培養24 h,24 h后隨機分為以下5組,A 組(空白血清組):5 μl 空白血清+DMEM/F12 單培90 μl;B 組(不含藥大鼠血清組):5 μl 大鼠不含藥血清+ DMEM/F12 單培95 μl;C 組(活血通腑方低劑量組):5 μl 大鼠含藥血清+DMEM/F12 單培95 μl;D 組(活血通腑方中劑量組):5 μl 大鼠含藥血清+ DMEM/F12 單培95 μl;E 組(活血通腑方高劑量組):5 μl 大鼠含藥血清+ DMEM/F12 單培95 μl。另設空白對照組加入PBS,同時以無細胞培養液的孔作為調零孔,每組設6個復孔。作用12、24、36 h后,每空加入50 μl MTT溶液(5 mg/ml),37 ℃繼續孵育4 h,棄除培養板各組孔內上清液,每孔加入 150 μl DMSO,振蕩 10 min 后,用酶標儀在 490 nm 波長處測定各孔光吸光度,并計算OD值。
1.9統計學處理采用 SPSS19.0軟件,多組間比較運用單因素方差分析,兩兩比較采用LSD法檢驗。
2結果
1.1倒置顯微鏡下觀察及免疫組化鑒定大鼠腹膜間皮細胞在倒置顯微鏡下觀察24 h后貼壁的大鼠原代細胞,培養初期呈梭形及橢圓形,1 w后融合成多邊形細胞,外觀如鋪路鵝卵石樣,為典型的腹膜間皮細胞外形(圖1A、圖1B)。光鏡下鑒定的細胞的Keratin和Vitamin染色均呈棕色(圖1C,圖1D),而第Ⅷ因子相關抗原及CD45抗原染色均為陰性(圖1E,圖1F)。
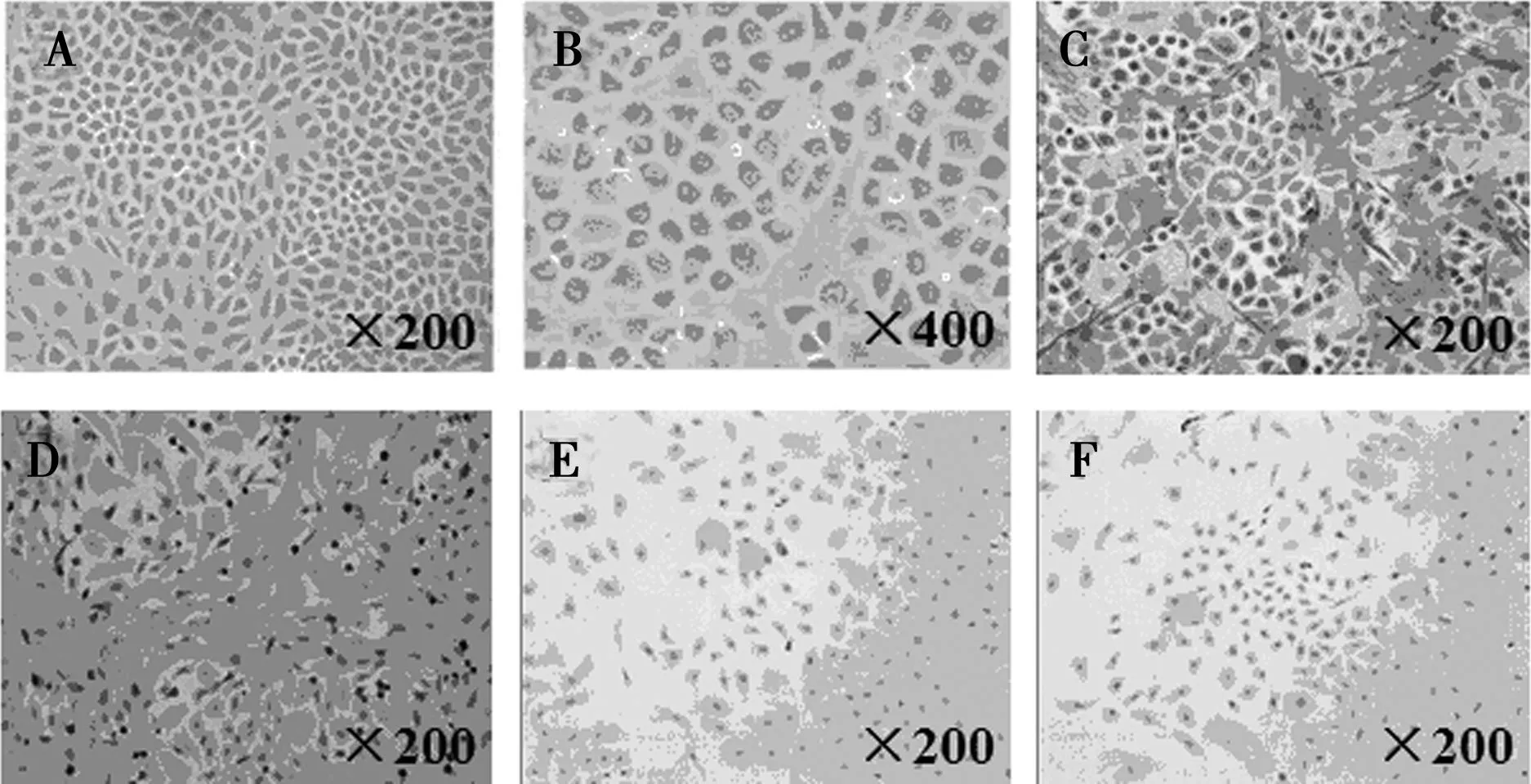
A,B:倒置顯微鏡下腹膜間皮細胞的形態;C:Keratin(+);D:Vitamin(+);E:CD45(-);F:第Ⅷ因子(-) 圖1 原代腹膜間皮細胞培養形態及免疫組化相關鑒定
2.2不同劑量活血通腑方含藥血清作用RPMCs 各時間點 OD 值變化經Mauchly球形檢驗可知,統計量W=0.355,P=0.000,拒絕球形假設,用Epsilon校正,選取Huynh-Feldt一行的結果,P=0.02,表明各組OD值在不同時間點均值不等,提示細胞增殖數量有隨時間變化的趨勢,且時間因素的作用差異隨著分組的不同而改變。組內效應方差分析顯示,時間:F=46.712,P=0.000,不同時間各組的光密度值有統計學意義;時間*組別:F=4.550,P=0.003,分組和時間的交互作用有統計學意義。組間效應方差分析,F=19.775,P=0.000,各組藥物在不同時間總的OD值差異顯著(P<0.05)。培養12 h和24 h 后,各組間OD值差異不明顯(P>0.05),僅有活血通腑方中劑量含藥血清組與空白血清組相比差異顯著(P<0.05),提示活血通腑方含藥血清無毒性。活血通腑方中劑量組在36 h時OD值與其他各組相比差異顯著(P<0.01)。見表1。
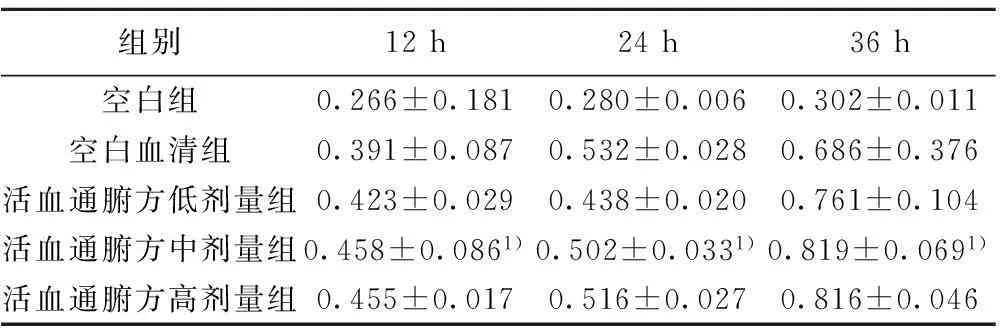
組別12h24h36h空白組0.266±0.1810.280±0.0060.302±0.011空白血清組0.391±0.0870.532±0.0280.686±0.376活血通腑方低劑量組0.423±0.0290.438±0.0200.761±0.104活血通腑方中劑量組0.458±0.0861)0.502±0.0331)0.819±0.0691)活血通腑方高劑量組0.455±0.0170.516±0.0270.816±0.046
與空白血清組相比:1)P<0.01
3討論
術后腹腔粘連發病率較高,可引起諸如慢性疼痛、機械性腸梗阻、女性不孕及增加二次手術風險等并發癥,給患者精神和經濟上帶來雙重負擔〔9〕。研究發現腹膜間皮細胞可以分泌多糖包被,同時亦可合成一系列的細胞因子和生長因子,調節炎癥反應,誘導細胞增殖分化和遷移,介導組織修復〔10〕。
本實驗研究表明不同劑量的活血通腑方含藥血清可不同程度提高RPMC的光密度值和存活能力。活血通腑方中劑量組作用 36 h 后RPMC的活性最強,而活血通腑方高劑量組作用36 h 后,雖然沒有出現對細胞的抑制作用或者毒副作用,但RPMC的存活率相對較低。綜上,活血通腑方能誘導正常腹膜間皮增殖,無毒性,未來可能成為防治腹腔粘連的有效手段。
4參考文獻
1Cheong YC,Laird SM,Li TC,etal.Peritoneal healing and adhesion formation/reformation 〔J〕.Hum Reprod Update,2001;7(6):556-66.
2曾莉,徐慶,夏衛軍,等.活血通腑方治療腹腔粘連處方優化的正交T值法研究〔J〕.中國中醫急癥,2008;17(3):370-1.
3曾莉,翟亞春,夏國守,等.活血通腑方有效劑量篩選實驗研究〔J〕.南京中醫藥大學學報,2004;20(5):309-11.
4曾莉,錢海華,趙群男,等.活血通腑方治療術后粘連性腸梗阻 56 例臨床觀察〔J〕.南京中醫藥大學學報,2010;26(3):178-80.
5顏帥,楊斕,曾莉,等.活血通腑方優化方防治大鼠術后腹腔粘連的最佳有效劑量的實驗研究〔J〕.中國實驗方劑學雜志,2014;20(9):166-70.
6Zou XL,Pei DA,Yan JZ,etal.A20 overexpression inhibits lipopolysaccharide-induced NF-κB activation,TRAF6 and CD40 expression in rat peritoneal mesothelial cells 〔J〕.Int J Mol Sci,2014;15(4):6592-608.
7Liu L,Du L,Chen Y,etal.Down-regulation of Aquaporin1(AQP1) by peptidoglycan via p38 MAPK pathways in primary rat pleural mesothelial cells.Exp Lung Res,2014;40(4):145-53.
8Liu Q,Zhang Y,Mao H,etal.A crosstalk between the Smad and JNK signaling in the TGF-β-induced epithelial-mesenchymal transition in rat peritoneal mesothelial cells 〔J〕.PLoS One,2012;7(2):e32009.
9Ten Broek RP,Wilbers J,van Goor H.Electrocautery causes more ischemic peritoneal tissue damage than ultrasonic dissection 〔J〕.Surg Endosc,2011;25(6):1827-34.
10Yung S,Li FK,Chan TM.Peritoneal mesothelial cell culture and biology 〔J〕.Perit Dial Int,2006;26(2):162-73.
〔2014-09-04修回〕
(編輯郭菁)

