雙熒光mRFP-eGFP-LC3體系在細胞自噬中的作用
雙熒光mRFP-eGFP-LC3體系在細胞自噬中的作用*
**通信作者 E-mail:shaojunliu@yahoo.com
網絡出版時間:2015-09-11網絡出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20150911.2321.062.html
黃楨鈞, 劉彬, 劉本榮, 劉少軍**
(廣州心血管疾病研究所 廣州醫科大學附屬第二醫院 心內科, 廣東 廣州510260)
[摘要]目的: 探討雙熒光mRFP-eGFP-LC3(ptfLC3)體系在細胞自噬中的作用。方法: 采用不同濃度雷帕霉素(50、100、200、500、1 000 nmol/L)處理人胚腎細胞(HEK293),蛋白印跡法檢測不同濃度雷帕霉素組中自噬標記蛋白(LC3蛋白)的表達及LC3-II/LC3-I比值;單熒光GFP-LC3質粒和雙熒光mRFP-eGFP-LC3質粒轉染HEK293細胞,雷帕霉素(200 nmol/L)處理3 h,采用熒光顯微鏡統計,并比較兩種方法轉染后HEK293細胞內LC3亮點的變化。結果: 不同濃度雷帕霉素處理HEK293細胞,LC3-II蛋白和LC3-II/LC3-I比值均增加;轉染GFP-LC3質粒時,雷帕霉素處理HEK293細胞中綠色亮點的數量增加;轉染mRFP-eGFP-LC3質粒時,雷帕霉素處理HEK293細胞中綠色和紅色亮點數量均增加。結論: 雙熒光mRFP-eGFP-LC3體系優于單熒光GFP-LC3體系,更能全面完整地反映細胞自噬水平,能夠反映細胞內自噬流的變化,是自噬定量分析的可靠方法。
[關鍵詞]雷帕霉素; 自噬; 人胚腎細胞; LC3; 單熒光GFP-LC3質粒; 雙熒光mRFP-eGFP-LC3
[基金項目]*國家自然科學基金青年項目(81300151)
[中圖分類號]R34-33
Evaluating the Effect of Dual-Fluorescence mRFP-eGFP-LC3 in Autophagy
HUANG Zhenjun, LIU Bin, LIU Benrong, LIU Shaojun
(DepartmentofCardiology,GuangzhouInstituteofCardiovascularDisease,theSecondAffiliatedHospital
ofGuangzhouMedicalUniversity,Guangzhou510260,Guangdong,China)
Abstract[] Objective:To investigate the effect of dual-fluorescence mRFP-eGFP-LC3 (ptfLC3) in autophagy. Methods: HEK293 cells were treated with rapamycin(50, 100, 200, 500, 1 000 nmol/L)for 3h and then adopting Western blot to test the expression of LC3 protein and ratio of LC3-II/LC3-I. Mono-fluorescence GFP-LC3 and dual-fluorescence mRFP-eGFP-LC3 transfected HEK293 cells. 24 h after the transfection, the cells were treated with rapamycin(200 nmol/L)for an additional 3 h, then analyzed by fluorescence microscopy to compare the spot change of LC3 in HEK293 cells. Results: Different concentration of rapamycin increased the ratio of LC3-II/LC3-I in HEK293 cells. After transfected with plasmids, green spot increased in rapamycin treated HEK293 cells; while for mRFP-eGFP-LC3 plasmids transfection, green and red spot increased in rapamycin treated HEK293 cells. Conclusion: Dual-fluorescence mRFP-eGFP-LC3 is superior to mono-fluorescence GFP-LC3, which can comprehensively reflect the level of autophagy and changes of autophagic flux, providing a reliable method for the quantitative analysis of autophagy.
[Key words] rapamycin; autophagy; human embryonic kidney cells; LC3; mono-fluorescence GFP-LC3 plasmid; dual-fluorescence mRFP-eGFP-LC3
自噬(autophagy)即自體吞噬,與異體吞噬相對,是細胞內形成的雙層膜結構包繞自己內部受損傷的蛋白質或細胞器,比如線粒體、內質網或高爾基體碎片等,進而與溶酶體融合將其內容物降解的過程。越來越多的研究發現,自噬與惡性腫瘤、心臟疾病、神經退行性疾病等密切相關[1-2],這使得自噬成為一個非常熱門的研究領域,也建立了一系列與之相適應的自噬檢測方式,如電鏡和熒光顯微鏡的應用,蛋白印跡法檢測自噬相關蛋白LC3和P62,長壽命蛋白的檢測等等。然而,自噬的復雜性和許多未知性決定了聯合應用多種檢測方式的必要性,因為到目前為止還沒有任何一種方法能夠全面反映自噬水平的變化,尤其是定量分析方法還不成熟,存在許多缺點。本研究介紹一種可靠的自噬定量分析方法,即雙熒光mRFP-eGFP-LC3體系,并將其與GFP-LC3和蛋白印跡法相比較,以期解決在應用該方法時面臨的一些實際問題,為自噬活性的檢測、尤其是在自噬定量分析方面提供參考。
1材料和方法
1.1試劑與儀器
DMEM培養液購自Gbico公司,雷帕霉素購自生工生物工程(上海)股份有限公司,GFP-LC3質粒由本實驗室構建。mRFP-eGFP-LC3質粒購自Addgene(plasmid:21074)[3],Lipofactamine 3000轉染試劑盒購自Life Technologies,LC3B兔抗人多克隆抗體購自Sigma公司(#L7543),β-Tubulin鼠抗人單克隆抗體(#M20005)購自Abmart公司,HRP標記羊抗兔、羊抗小鼠IgG購自Cell Signaling公司(#7074,#7076)。儀器和耗材包括Thermo scientific 3110系列II CO2培養箱、AMG EVOS fl熒光顯微鏡、Sonics & Materials超聲波破碎儀、Thermo scientific BCA蛋白測定試劑盒、Biotek Epoch酶標儀以及BIO-RAD電泳儀和轉膜儀。
1.2HEK293細胞培養
HEK293細胞購自中國科學院細胞庫,采用DMEM高糖培養液(含10%胎牛血清、1%青霉素-鏈霉素)培養,在37 ℃、5% CO2、濕化的培養箱中培養,2 d換液1次,隔4~5 d傳代1次,取對數生長期細胞進行實驗。
1.3蛋白印跡法檢測LC3-II/LC3-I表達
采用不同濃度雷帕霉素(50、100、200、500、1 000 nmol/L)處理HEK293細胞3 h后收獲細胞,4 ℃預冷PBS洗2遍,用適量RIPA裂解液冰上裂解5 min,刮下細胞,30%強度超聲1 s×3次。4 ℃ 10 000 r/min離心10 min。BCA法測定蛋白濃度,12% SDS-PAGE200V電泳,100 V轉膜1 h,5%脫脂牛奶室溫封閉1 h,一抗LC3(1∶2 000)和β-Tubulin(1∶5 000)4 ℃孵育過夜。用相應種屬二抗室溫孵育1 h。ECL發光顯影。Image-Pro Plus6.0軟件分析Western blot條帶的灰度值,并計算LC3-II/LC3-I的比值。
1.4單熒光GFP-LC3質粒轉染
采用GFP-LC3質粒瞬時轉染HEK293細胞,24 h后再用雷帕霉素(200 nmol/L)處理3 h,400倍熒光顯微鏡下觀察細胞內GFP-LC3綠色亮點的變化,并在每個實驗組隨機選取300個細胞進行拍照,重復3次,取平均值。
1.5雙熒光mRFP-eGFP-LC3質粒轉染
mRFP-eGFP-LC3質粒轉染HEK293細胞24 h,再以雷帕霉素(200 nmol/L)處理3 h,400倍熒光顯微鏡觀察細胞內紅色和綠色LC3亮點變化,隨機選取300個細胞拍照,包括紅色熒光圖、綠色熒光圖,重復3次,取平均值。
1.6統計學分析
采用SPSS 13.0軟件進行分析,兩組數據之間的比較采用t檢驗,P<0.05表示差異有統計學差異。
2結果
2.1LC3蛋白及LC3-II/LC3-I比值
雷帕霉素處理HEK293細胞后,LC3-II蛋白及LC3-II/LC3-I比值均增加,并呈濃度依賴性,見圖1。

圖1 不同濃度雷帕霉素處理后HEK293 細胞LC3蛋白的表達 Fig.1 The expression of LC3-II/LC3-I in HEK293 cells after treated with different concentration of rapamycin
2.2mRFP-eGFP-LC3質粒圖譜及其蛋白的表達
ptfLC3質粒可表達出mRFP-eGFP-LC3融合蛋白(圖2),該蛋白中mRFP發射紅色熒光,eGFP發射綠色熒光。
2.3雙熒光mRFP-eGFP-LC3體系與單熒光GFP-LC3體系
單熒光法可見GFP-LC3亮點增加,表明細胞內自噬體增加;雙熒光法可見紅色和綠色亮點均增加,在紅、綠色合成圖像中黃色亮點(自噬體)和紅色亮點(自噬溶酶體)均增加(圖3)。
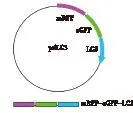
圖2 mRFP-eGFP-LC3質粒圖譜及蛋白表達 Fig.2 Plasmid map of mRFP-eGFP-LC3 and the protein expression
3討論
目前,研究自噬的定量分析方法多使用GFP-LC3法,即通過轉染可表達GFP-LC3融合蛋白的質粒,使LC3攜帶有綠色熒光,從而可通過熒光顯微鏡觀察細胞內LC3的定位和轉化。LC3-I在細胞質內散在分布,熒光顯微鏡下呈彌散分布的綠色熒光,而LC3-II則聚集在自噬囊泡的內外膜上,包括自噬前體、自噬體、自噬溶酶體,使得這些自噬結構呈綠色亮點(LC3亮點)。因此我們可以用LC3亮點來反映細胞內自噬囊泡的數量。但由于綠色熒光在自噬體與溶酶體融合成自噬溶酶體后的酸性環境下易淬滅,GFP-LC3法用于自噬定量分析的準確性欠佳。
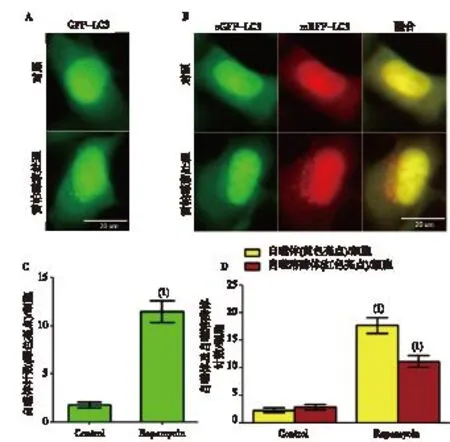
注:A、B為LC3熒光亮點的典型圖像,C為平均每個細胞含有的自噬體(GFP-LC3亮點),D為平均每個細胞含有的 自噬體(合成圖像中的黃色亮點)和自噬溶酶體(合成圖像中的紅色亮點); (1)與對照組比較,P<0.05 圖3 雙熒光mRFP-eGFP-LC3體系與單熒光GFP-LC3體系比較 Fig.3 Comparison of dual-fluorescence mRFP-eGFP-LC3 and mono-fluorescence GFP-LC3 in HEK293 cell
雙熒光mRFP-eGFP-LC3體系是比GFP-LC3更可靠的自噬定量分析方法。該體系最大的優點是可以同時直觀地判斷細胞自噬活性和自噬流(自噬通量)的變化,而不需要外加其它藥物干預。根據RFP紅色熒光不易在溶酶體酸性環境下降解的特點[3-4],本研究采用mRFP-eGFP-LC3轉染細胞。由于LC3攜帶有mRFP的紅色熒光和eGFP的綠色熒光,并可大量聚集在自噬前體和自噬體膜上, 使它們在熒光顯微鏡的紅綠合成圖像中呈黃色亮點;但LC3攜帶的eGFP綠色熒光在自噬體與溶酶體融合形成自噬溶酶體的酸性條件下發生淬滅,而mRFP紅色熒光耐受降解,使自噬溶酶體呈紅色亮點。因此mRFP紅色熒光可全程標記和追蹤LC3,而eGFP的減弱可以指示自噬體和溶酶體的融合。當自噬被誘導時,黃色亮點(主要是自噬體)和紅色亮點(自噬溶酶體)都增加;當自噬被抑制引起自噬體生成減少時,黃色亮點和紅色亮點都減少;當自噬被抑制引起自噬體降解障礙時,黃色亮點增加,紅色亮點減少或者不變。據此我們還可以根據黃色和紅色的相互對比監測自噬體到自噬溶酶體的轉化,因為自噬過程是否順暢影響細胞的生理狀態。本研究以雷帕霉素處理HEK293細胞,蛋白印跡法檢測LC3-II及LC3-II/LC3-I均增加,這說明雷帕霉素可誘導HEK293細胞自噬,建立雷帕霉素誘導的HEK293細胞自噬模型;并以該細胞模型為基礎雙熒光mRFP-eGFP-LC3體系與單熒光GFP-LC3體系進行比較,結果顯示mRFP-eGFP-LC3體系具有更大的優越性,它可以同時反映自噬體和自噬溶酶體的變化,監測細胞內自噬流的變化,因而可以取代GFP-LC3用于自噬定量分析。
在應用雙熒光法時需要注意幾個問題。(1)許多細胞尤其是腫瘤細胞保持著一定水平的基礎自噬,轉染mRFP-eGFP-LC3后即可觀察到一定數量的LC3亮點,需要設立嚴格的實驗對照。(2)串聯mRFP-eGFP-LC3的表達和轉染試劑本身可能對細胞有一定的毒性,使本底LC3亮點增加,mRFP-eGFP-LC3蛋白表達過多也會使背景太亮難以準確計數亮點,因此必須優化轉染條件。本研究使用毒性更小的Lipo3000,根據細胞狀況確定質粒DNA與轉染試劑的最佳比例,并在轉染后等待24~48 h再處理細胞,大大減少了背景水平,方便計數。(3)最好使用超過一個時間點觀察早期自噬體的增加和隨后晚期自噬體的增加,作為自噬流維持的一個額外保證[5]。(4)確立一套合理的計數標準非常重要,否則很容易引起誤差導致統計結果不準確,因為目前還沒有統一的標準來明確多大、多亮的斑點才納入統計。在某些情況下自噬體會發生相互融合,形成更大的亮點,而亮點的大小與自噬水平的還不明確;而當LC3亮點大量增加時也會使計算十分困難。(5)本研究分別統計了平均每個細胞含有的黃色和紅色LC3亮點數目,是比較可靠合理的方法[6],也可以統計含有LC3亮點的細胞占所有細胞的百分比。(6)目前已經有人嘗試使用特殊的圖像識別系統應用于自噬結構的定量分析[7-8]。
另外在應用雙熒光結構體系時使用Cellomics顯微鏡對黃色亮點和紅色亮點進行自動化定量分析,可以在許多隨機的視野內評估大量的細胞(1 000個以上),這會比手動評估一些挑出來的細胞更準確、更可靠[9]。
總之,根據雙熒光結構能夠發出不同熒光信號及其對酸性PH的敏感性不同,為監測許多細胞類型的自噬流提供了一個方便的方法。目前,雙熒光mRFP-eGFP-LC3已經逐漸得到許多學者的認可,相信會在自噬的研究領域得到越來越廣泛的應用。
4參考文獻
[1] Lucin KM,Wyss-coray T. Targeting autophagy for disease therapy[J]. Nature Biotechnology, 2013(4):322-323.
[2] Nixon RA. The role of autophagy in neurodegenerative disease[J]. Nature Medicine, 2013(8):983-997.
[3] Kimura S,Noda T,Yoshimori T. Dissection of the Autophagosome Maturation Process by a Novel Reporter Protein,Tandem Fluorescent-Tagged LC3[J]. Autophagy, 2007(3):5,452-460.
[4] Shanware NP,Bray K,Eng CH,et al. Glutamine deprivation stimulates mTOR-JNK-dependent chemokine secretion[J]. Nature Communications, 2014(5):4900.
[5] Cherra SJ,Kulich SM,Uechi G,et al. Regulation of the autophagy protein LC3 by phosphorylation[J]. J Cell Biol, 2010(190):533-539.
[6] Hariharan N,Maejima Y,Nakae J,et al. Deacetylation of FoxO by Sirt1 Plays an Essential Role in Mediating Starvation-Induced Autophagy in Cardiac Myocytes[J]. Circ Res, 2010(107):1470-1482.
[7] Nyfeler B,Bergman P,Triantafellow E,et al. Relieving autophagy and 4EBP1 from rapamycin resistance[J]. Mol Cell Biol, 2011(31):2867-2876.
[8] Nyfeler B. Molecular biology;study results from novartis animal health update understanding of molecular biology[J]. Life Science Weekly, 2012:5220.
[9] Sarkar S,Korolchuk VI,Renna M,et al. Complex inhibitory effects of nitric oxide on autophagy[J]. Mol Cell, 2011(43):19-32.
(2015-05-22收稿,2015-08-16修回)
中文編輯: 文箐潁; 英文編輯: 趙毅

