水通道蛋白與脊髓水腫的研究進展
王東旭,許衛兵
水通道蛋白與脊髓水腫的研究進展
王東旭,許衛兵
水孔蛋白脂類;脊髓損傷;水腫;綜述文獻
水通道蛋白(Aquaporin,AQP)最早由約翰霍普金斯大學醫學院的美國科學家PeterAgre于1988年在研究人類紅細胞時發現。最初被命名為類通道整合膜蛋白(channel-likeintegralmembraneprotein,CHIP28),1991年10月Carbrey等[1]第一次證明了CHIP28為AQP,確認了其通透水分子的功能,從此AQP的研究正式拉開序幕。目前哺乳動物體內AQP已經發現有13種(AQP-0~AQP-12),而廣泛存在于人類中樞神經系統的是AQP-1、AQP-4和AQP9。有研究證明AQP在腦水腫[2]、脊髓水腫[3]等領域發揮著重要作用。通過研究AQP,給脊髓損傷的臨床治療提供幫助。
1 AQP的結構
AQP是一類高度保守的蛋白,作為一個蛋白質家族,各種亞型之間具有非常相似的蛋白序列及三維結構。哺乳動物水通道蛋白的分子大小為26× 106~34×106,氨基酸序列同源性為19%~52%[4]。
目前對AQP-1的研究最多,對AQP的結構研究也以AQP-1為模型。AQP的三維結構,目前被廣泛接受的是“沙漏模型”(hourglassmodel)[5]。AQP分子的三級結構可概括為“一鏈兩列五環六區”[5](見圖1)。一鏈:AQP由1條6次跨膜的膚鏈構成,其C'端和N'端均位于胞內,AQP-1的膚鏈含有269個氨基酸殘基,而AQP-4的膚鏈則由301個氨基酸殘基構成[6]。六區:膚鏈跨膜是由6個疏水跨膜區完成的,6個疏水跨膜區是以α螺旋的形式往返折疊跨膜。五環:6個疏水跨膜區由A、B、C、D、E,5條攆環依次連接,其中A、C、E環位于胞外,B、D環位于胞內。兩列:B、E2環各含有1個高度保守的天冬酞胺—脯氨酸—丙氨酸(Asn-Pro-Ala,NPA)序列,這是大部分水通道蛋白中構成孔道中心的序列。這個特異的序列在三維結構上位于通道的核心,因此B、E環的任何變化都會影響到AQP的活性(見圖2)。但也有例外,AQP-11、AQP-12中僅含有1個NPA序列,通道的另一側則分別由天冬酞胺—脯氨酸—半朧氨酸(Asn-Pro-Cys,NPC)和天冬酞胺—脯氨酸—蘇氨酸(Asn-Pro-Thr,NPT)的氨基酸序列組成[7]。
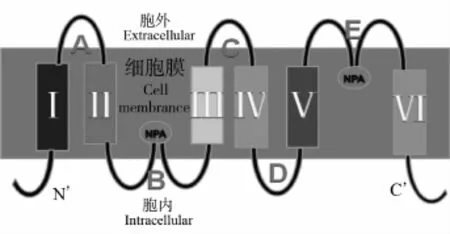
圖1 AQP結構示意圖Fig.1 SchematicdiagramofAQPstructure
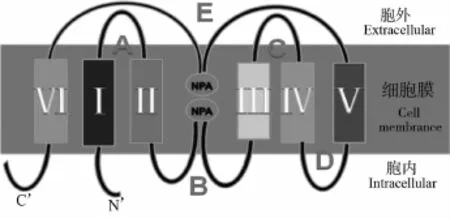
圖2 AQP沙漏模型示意圖Fig.2 SchematicdiagramofAQPhourglassmodel
在體內AQP主要以同源四聚體的形式存在,與一般的離子通道不同,這4個亞單位并非環繞形成水通透的孔道,而是每個亞單位均獨立構成孔道結構,并且可以完成水通透等生理功能[8]。
2 AQP的分類與分布
根據AQPs家族成員一級結構及轉運功能可將其分為3類[1,7,9]:單純AQP(water-selectiveAQPs)、水甘油通道蛋白(aquaglyceroporin)[1]和超水通道蛋白 (S-aquaporin/super-aquaporin)[9]。AQP-0、AQP-1、AQP-2、AQP-4、AQP-5、AQP-6屬于第一類,每個基因都含有4個外顯子,它們的外顯子與內含子的連接部位相同,該組成員只對水有通透性。AQP-3、AQP-7、AQP-9、AQP-10屬于第二類,每個基因都含有6個外顯子,其外顯子與內含子的連接部位和第一類水通道不同,該組成員對水和甘油皆有通透。AQP-8基因同樣含有6個外顯子,但外顯子和內含子的大小和連接部位與前兩類均不同[10],Carbrey等[1]在文獻中也并未將AQP-8劃入前兩類。第三類包括AQP-11、AQP-12,由于其發現較晚,目前對其功能和結構尚未完全了解。
而根據AQP功能能否被汞所抑制,其又可分為汞敏感性蛋白和汞不敏感性蛋白(mercury insensitivewaterchannel,MIWC)。目前已知,AQP-4 和AQP-7為MIWC,這是因為其他AQP的第189位氨基酸殘基是半朧氨酸,可與汞結合從而堵塞水通道,而AQP-4和AQP-7在該位置無半朧氨酸,故對汞制劑不敏感[8]。
在中樞神經系統內存在著廣泛的AQP分布(見表1)[4,11]。通過免疫熒光技術可以證實,在中樞神經系統的組織中AQP-1主要在脈絡叢腦脊液側上皮細胞內表達,與基底側的碳酸醉酶和鈉泵共同參與腦脊液的形成[2]。AQP-4有2個主要表達區域:①位于形成膠質界膜的致密星形膠質細胞足突上,參與形成與腦脊液接觸的軟腦膜和室管膜表面屏障。②位于包繞血管周圍的星形膠質細胞足突上,并在與血管直接接觸的足突上呈極性分布[12]。AQP-9主要表達于腦和脊髓白質部分的星形膠質細胞,最近發現神經元中也存在AQP-9。已有研究證明增加AQP-9可能有助于創傷性腦損傷早期過量的水和乳酸清除,而廣泛AQP-9陣性的星形膠質細胞可能有助于乳酸進入神經元,在創傷性腦損傷的后期導致細胞性腦水腫。AQP-9陣性神經元提示AQP-9在腦外傷后能量平衡方面具有作用[11]。
3 中樞神經系統內AQP的生物學特性
AQP依靠錨定蛋白α-synirophin錨定在神經膠質細胞膜上,錨定在胞膜上的AQP對水分子具有高度的選擇性。其具體機制表現在:①在AQP的中心孔道,B環和E環上NPA相互作用形成狹口,最窄處僅由4個氨基酸殘基(親水的His180、Arg195、Cys189和疏水的Phe56)構成,大小約2.8×10-10m。②阻斷通過“Grotthus”效應傳遞的質子運輸[13]。水可以以連續不斷的方式通過膜上的開放孔,這種水分子排列成1條直線,質子由一個水分子傳遞到另一個水分子,并伴隨著氫鍵的斷裂和重建的過程被研究者稱為“Grotthus”效應。但是,在AQP的中心位置NPA序列上的Asn76和Asn192的氨基向通道最窄處延伸,位于此處的水分子與其鄰近的水分子之間的氫鍵發生斷裂,此時這一對偶極子與氧原子形成氫鍵,使水的分子軌道發生重排,中心處水分子的2個氫原子無法與周圍鄰近的水分子形成氫鍵,從而對水分子起著定向作用。③從理論上講水合化的離子直徑為7.6×10-10m,而去水合化的離子的直徑只有1.9×10-10m,是可以通過最窄處為2.8× 10-10m的中心通道的。中心孔道中的淡基氧的結構雖然足以分離體相水中的水分子,但是只能使水合離子部分去水合化,而后者則因直徑仍大于狹口直徑而無法通過水通道[8]。
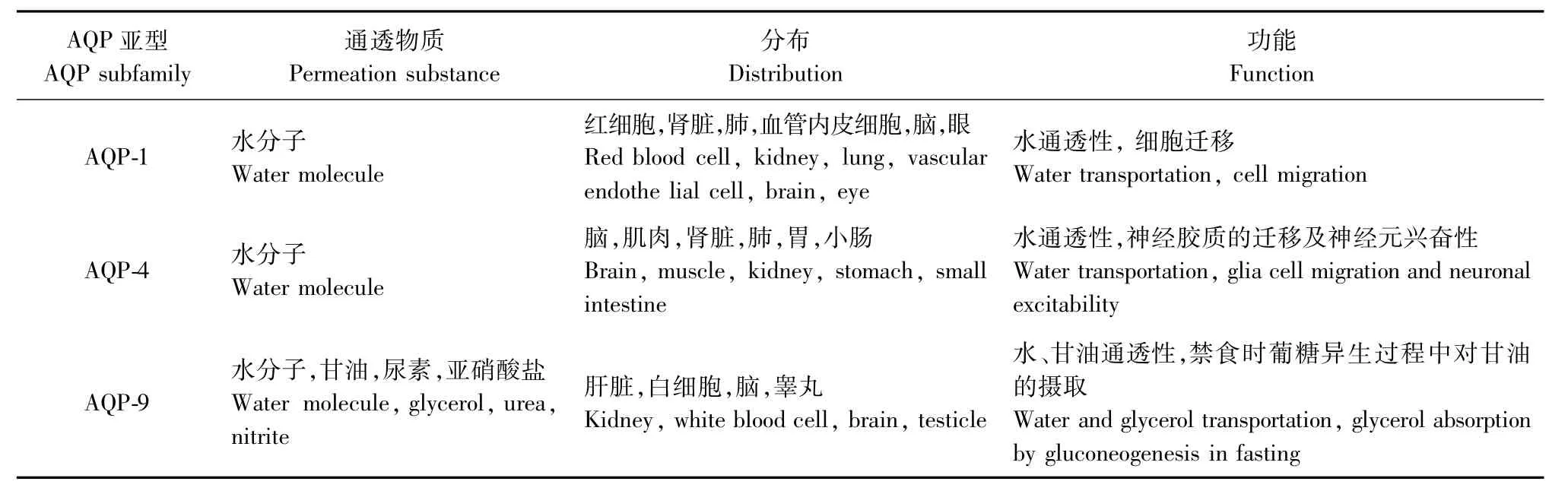
表1 AQP的組織分布以及可通透的物質Tab.1 DistributionandFunctionofAQPs
4 中樞神經系統內AQP的功能
4.1 參與腦脊液的形成
以往認為腦脊液的生成主要是與AQP-1有關,AQP-1主要表達在產生腦脊液的脈絡叢上皮細胞上,AQP-1敲除使脈絡叢滲透性降低,并使腦脊液產率下降,表明AQP-1參與調節腦脊液的形成[2]。但是最近關于腦脊液平衡的研究強調毛細血管周圍間水通量對腦脊液產生和重吸收的重要性(Oreskovic andKlarica假說),這一假說已經向經典的腦脊液循環理論發起挑戰。Igarashi等[14]分別敲除小鼠腦內AQP-1和AQP-4基因,并利用水分子MRI等技術在動物實驗上表明,水進入腦脊液是受AQP-4調控,而不是AQP-1。
4.2 參與腦與脊髓水腫的形成與發展
AQP參與中樞神經系統水腫已經有較多的研究報道:①細胞毒性腦水腫。將小鼠的AQP-4基因敲除后研究發現,AQP-4缺乏可減輕腦細胞水腫,可以改善由水中毒和局限性腦缺血帶來的后果[15,16]。②血管源性水腫。在凍傷、腦腫瘤等模型中,由于AQP-4的缺乏,細胞外液不能及時被轉運出腦組織,加劇了腦水腫的發展[15-16]。③間質性腦水腫。在梗阻性腦積水的動物模型中,AQP-4基因敲除小鼠與野生型小鼠相比較發現,其腦室擴大明顯加快[17]。
4.3 參與易化星形膠質細胞的遷移
表達AQP-1或者AQP-4的細胞能夠更迅速的遷移。大腦受到損傷后,中樞神經系統中的活性星形膠質細胞在AQP-4的協助下向受損的部位遷移并形成膠質癱痕。對于脊髓損傷目前前沿的療法是采用干細胞移植進行治療,如何將干細胞引導到所需部位是移植的關鍵問題。有證據表明,脊髓損傷后在病變部位周圍的反應性星形膠質細胞AQP-1表達顯著增加,而遠離病變部位的反應性星形膠質細胞表達AQP-1明顯要低[18]。
5 AQP的調節
5.1 磷酸化調節
AQP-4上具有大量蛋白激酶A(proteinkinase A,PKA)、鈣/鈣調素依賴蛋白激酶Ⅱ(calcium/ calmodulindependentproteinkinaseⅡ,CaMKⅡ)、蛋白激酶C(proteinkinaseC,PKC)、酪蛋白激酶Ⅱ(caseinkinaseⅡ,CKⅡ)磷酸化位點。以PKA為例,在某些因素作用下腺昔酸環化酶被激活后使細胞cAMP增加,從而激活PKA,PKA催化水通道蛋白上的特定的絲氨酸殘基(Ser111)磷酸化,從而使AQP的活性上升,增加膜對水的通透性[19]。用PKC激動劑12-O-十四烷酞佛波醇-13-醋酸酯處理星形膠質細胞,可以使AQP-4和AQP-9的表達減少。但這種作用可以被PKC抑制劑所抑制,提示PKC發揮作用的信號轉導途徑在AQP-4和AQP-9表達的轉錄水平而不涉及蛋白質的從頭合成[20]。
5.2 pH對AQP的調節
pH是哺乳動物體內調控蛋白活性的一種普遍方式。水通道蛋白的A和C環外部的組氨酸決定其pH值的依賴性。不同AQP中組氨酸的位置可以調節其對酸堿的敏感性[21]。
5.3 缺氧對AQP的調節
低氧誘導因子(hpoxiainducingfactor,HIF)在AQP-1基因的啟動區有結合位點。Higashida等[22]的動物實驗表明低氧會下調小鼠腦內AQP-1的mRNA和蛋白表達,再次給氧后,AQP-1水平迅速恢復。并且在周圍神經系統內HIF-1α參與AQP-1基因缺氧誘導的表達也被研究者所證實[23]。
5.4 滲透壓對AQP的調節
Lanaspa等[24]通過向培養基中添加NaCl達到高滲,可以使腎髓質細胞的AQP-1表達大幅上提,表明滲透壓調節AQP-1是發生在轉錄和翻譯水平。并且他們發現在AQP-1外顯子上游811bp處有一保守的滲透壓元件結合蛋白(TonEBP)結合位點。
5.5 其他
應用高劑量激素治療腹膜透析患者AQP-1的表達上調,但是關于糖皮質激素對AQP表達調節的機制尚不十分清楚。汞可抑制AQP-1和AQP-9的水通透性,但對AQP-4無效;鉛可增加AQP-4的水通透性。泛醒可調節AQP-1的表達。
6 AQP在脊髓水腫中的作用
雖然在嚙齒類動物神經系統內有AQP-1、AQP-4和AQP-93種水通道蛋白,但是在人的脊髓內目前僅發現AQP-4,因此目前對影響脊髓缺血再灌注損傷的AQP的研究集中在AQP-4上。在脊髓中AQP-4僅由星形膠質細胞表達,然而它不僅像在中樞神經系統的其他器官那樣集中在血管周圍的終足膜,而且它也沿著神經纖維網的突起廣泛分布[25]。已有研究發現AQP-4在脊髓損傷過程中呈現高表達情況,損傷早期AQP-4迅速升高,造成脊髓急性水腫,影響脊髓的正常功能[26]。脊髓損傷后會發生不同程度的血管源性水腫,研究發現脊髓損傷后1d,AQP-4及其mRNA表達開始增加,脊髓損傷后3d達高峰,對應的病理改變為細胞內水腫的形成[27]。水腫的程度和持續的時間與繼發性脊髓損傷的發生發展密切相關。因此,通過研究影響水腫的AQP,可以更好地揭露繼發性脊髓損傷的機制,從而找到減輕脊髓缺血再灌注損傷的方法。
盡管脊髓AQP功能障礙可能加重脊髓損傷后的水、離子嚴重失衡,但是AQP在脊髓損傷方面的具體作用依然了解甚少。Nesic等[28]利用GFAP標記AQP-4陰性星形膠質細胞和AQP-4過表達星形膠質細胞發現,AQP-4陰性星形膠質細胞可能產生在脊髓損傷引起的膠質細胞缺失后的代償過程,并且數量隨著時間變化。漸漸的,AQP-4陰性星形膠質細胞會被代替或者轉變為AQP-4過表達星形膠質細胞,這主要發生在慢性繼發性損傷階段。盡管AQP-4過表達意味著細胞毒性水腫給神經元或者軸突興奮性帶來負面影響,但是脊髓損傷大鼠更好的運動功能恢復不與AQP-4低水平相關。因此推斷,抑制AQP-4對輕度脊髓損傷會有所幫助,但對中、重度脊髓損傷意義不大[27]。
7 展望
AQP的發現至今已有20余年的歷史,對其結構與生物學功能的研究已取得了一定進展。目前研究者正在嘗試以AQP為靶目標,通過基因敲除干擾轉基因和開發AQP抑制或激活藥物,從而達到治療神經系統疾病的目的。是否能夠在脊髓水腫急性期時抑制AQP-4介導水流的內流,而在脊髓水腫形成后加速AQP-4介導水流的外流,從而減輕脊髓水腫,這也是目前實驗的一個研究方向。總之,AQP作為脊髓損傷治療的新型藥物作用靶點具有潛在的研究價值并可能成為脊柱骨折等所致脊髓損傷治療的新策略。
[1]CarbreyJM,AgreP.Discoveryoftheaquaporinsanddevelopment ofthefield[J].HandbExpPharmacol,2009(190):3-28.
[2]OshioK,WatanabeH,SongY,etal.Reducedcerebrospinalfluid productionandintracranialpressureinmicelackingchoroidplexus waterchannelAquaporin-1[J].FASEBJ,2005,19(1):76-78.
[3]HuAM,LiJJ,SunW,etal.Myelotomyreducesspinalcord edemaandinhibitsaquaporin-4andaquaporin-9expressioninrats withspinalcordinjury[J].SpinalCord,2015,53(2):98-102.
[4]PortincasaP,PalascianoG,SveltoM,etal.Aquaporinsinthe hepatobiliarytract.Which,whereandwhattheydoinhealthand disease[J].EurJClinInvest,2008,38(1):1-10.
[5]JungJS,PrestonGM,SmithBL,etal.Molecularstructureofthe waterchannelthroughaquaporinCHIP.Thehourglassmodel[J].JBiolChem,1994,269(20):14648-14654.
[6]ChakrabartiN,TajkhorshidE,RouxB,etal.Molecularbasisof protonblockageinaquaporins[J].Structure,2004,12(1):65-74.
[7]IkedaM,AndooA,ShimonoM,etal.TheNPCmotifof aquaporin-11,unliketheNPAmotifofknownaquaporins,is essentialforfullexpressionofmolecularfunction[J].JBiol Chem,2011,286(5):3342-3350.
[8]AgreP,KingLS,YasuiM,etal.Aquaporinwaterchannels— fromatomicstructuretoclinicalmedicine[J].JPhysiol,2002,542(Pt1):3-16.
[9]BengaG.Onthedefinition,nomenclatureandclassificationof waterchannelproteins(aquaporinsandrelatives)[J].Mol AspectsMed,2012,33(5-6):514-517.
[10]羅玉玉,張文成.水通道蛋白與脊髓損傷[J].武警醫學院報,2008,17(10):915-917.
[11]LiuH,YangM,QiuGP,etal.Aquaporin9inratbrainafter severetraumaticbraininjury[J].ArqNeuropsiquiatr,2012,70(3):214-220.
[12]YasuiM.Aquaporinfrombasictoclinicalmedicine:rolesinbrain edema[J].NoToHattatsu,2011,43(3):191-194.
[13]TajkhorshidE,NollertP,JensenM?,etal.Controlofthe selectivityoftheaquaporinwaterchannelfamilybyglobal orientationaltuning[J].Science,2002,296(5567):525-530.
[14]IgarashiH,TsujitaM,KweeIL,etal.Waterinfluxinto cerebrospinalfluidisprimarilycontrolledbyaquaporin-4,notby aquaporin-1:17OJJVCPEMRIstudyinknockoutmice[J].Neuroreport,2014,25(1):39-43.
[15]VellaJ,ZammitC,DiGiovanniG,etal.Thecentralroleof aquaporinsinthepathophysiologyofischemicstroke[J].Front CellNeurosci,2015,9:108.
[16]ZengXN,XieLL,LiangR,etal.AQP4knockoutaggravates ischemia/reperfusioninjuryinmice[J].CNSNeurosciTher,2012,18(5):388-394.
[17]BlochO,AugusteKI,ManleyGT,etal.Acceleratedprogression ofkaolin-inducedhydrocephalusinaquaporin-4-deficientmice [J].JCerebBloodFlowMetab,2006,26(12):1527-1537.
[18]AlbertiniR,BianchiR.Aquaporinsandglia[J].Curr Neuropharmacol,2010,8(2):84-91.
[19]ConnerMT,ConnerAC,BlandCE,etal.Rapidaquaporin translocationregulatescellularwaterflow:mechanismof hypotonicity-inducedsubcellularlocalizationofaquaporin1water channel[J].JBiolChem,2012,287(14):11516-11525.
[20]YamamotoN,SobueK,MiyachiT,etal.Differentialregulation ofaquaporinexpressioninastrocytesbyproteinkinaseC[J].BrainResMolBrainRes,2001,95(1-2):110-116.
[21]Németh-CahalanKL,KalmanK,HallJE.MolecularbasisofpH andCa2+regulationofaquaporinwaterpermeability[J].JGen Physiol,2004,123(5):573-580.
[22]Abreu-RodríguezI,SánchezSilvaR,MartinsAP,etal.Functionalandtranscriptionalinductionofaquaporin-1geneby hypoxia;analysisofpromoterandroleofHif-1α[J].PLoSOne,2011,6(12):e28385.
[23]ZhangJ,XiongY,LuLX,etal.AQP1expressionalterations affectmorphologyandwatertransportinSchwanncellsand hypoxia-inducedup-regulationofAQP1occursinaHIF-1αdependentmanner[J].Neuroscience,2013,252:68-79.
[24]LanaspaMA,Andres-HernandoA,LiN,etal.Theexpressionof aquaporin-1inthemedullaofthekidneyisdependentonthe transcriptionfactorassociatedwithhypertonicity,TonEBP[J].J BiolChem,2010,285(41):31694-31703.
[25]Vitellaro-ZuccarelloL,MazzettiS,BosisioP,etal.Distribution ofAquaporin4inrodentspinalcord:relationshipwithastrocyte markersandchondroitinsulfateproteoglycans[J].Glia,2005,51(2):148-159.
[26]SaadounS,PapadopoulosMC.Aquaporin-4inbrainandspinal cordoedema[J].Neuroscience,2010,168(4):1036-1046.
[27]武云濤,李煒,朱慶三,等.水通道蛋白4在急性實驗性脊髓損傷中的表達[J].中國老年學雜志,2009,29(12):1487-1489.
[28]NesicO,GuestJD,ZivadinovicD,etal.Aquaporinsinspinal cordinjury:thejanusfaceofaquaporin4[J].Neuroscience,2010,168(4):1019-1035.
R651.21
A
1672-2957(2015)04-0250-04
】
10.3969/j.issn.1672-2957.2015.04.014
2014-05-06)
(本文編輯 張建芬)
國家自然科學基金面上項目(81271394)
王東旭(1988—),碩士在讀
116033 遼寧,大連醫科大學附屬大連市中心醫院脊柱外科
許衛兵 xuweibingsmmu@163.com

