大豆皮天冬氨酸蛋白酶的提取、純化與鑒定
劉 春 程芬芬 馬洪雨 王金梅 侯俊杰 楊曉泉
大豆皮天冬氨酸蛋白酶的提取、純化與鑒定
劉 春1程芬芬1馬洪雨2王金梅1侯俊杰1楊曉泉1
(華南理工大學輕工與食品學院食物蛋白工程研究中心,淀粉與植物蛋白深加工教育部工程研究中心1,廣州 510641)
(南京農業大學植物保護學院2,南京 210095)
從大豆加工副產物——大豆皮的高值化利用出發,以大豆皮為原料,在纖維素酶輔助提取大豆皮蛋白質的基礎上,利用CM-Sepharose柱離子交換層析純化大豆皮蛋白粗提物,用SDS-PAGE分辨大豆皮蛋白粗提物和純化后的蛋白質,對電泳凝膠分辨出來的蛋白條帶用基質輔助激光解析電離飛行時間二級質譜(MALDI-TOF-TOF MS)進行鑒定,并測定了其在pH 2~6范圍內的酶活性,結果表明首次從大豆皮中純化鑒定出類豬籠草蛋白酶I大豆天冬氨酸蛋白酶,得率為233 mg/kg,純化后的類豬籠草蛋白酶I大豆天冬氨酸蛋白酶在pH 3時對血紅蛋白的比活力最高,為62.1 U/mg。
類豬籠草蛋白酶I大豆皮天冬氨酸蛋白酶 提取 純化 鑒定 基質輔助激光解析電離飛行時間質譜
天冬氨酸蛋白酶(aspartic proteases,EC 3.4.23)是一類在酸性pH下有活性的蛋白水解酶,廣泛分布于真核生物以及微生物中[1]。根據MEROPS數據庫(http://www.merops.ac.uk)數據[2],目前基于氨基酸序列同源性天冬氨酸蛋白酶被分為14個不同的家族,基于其進化關系和三級結構進而組合成6個不同的大類。大多數植物天冬氨酸蛋白酶屬于A1家族。該家族蛋白酶擁有較高的序列相似性和以C2為對稱軸的2個雙葉型三級結構。典型的天冬氨酸肽鏈內切酶在其活性中心包含2個天冬氨酸殘基,該催化殘基位于保守區Asp -Thr/Ser-Gly(DT/SG)基序內并形成酶活性位點[3]。天冬氨酸蛋白酶的主要功能是降解蛋白、抗原和促進其他酶的活化等[1]。
一些天冬氨酸蛋白酶在植物的各種組織中均可表達,如水稻[4]、擬南芥[5];有些天冬氨酸蛋白酶具有組織表達特異性,有的只在干種子和豆莢中表達,有的只在花和豆莢中表達,不同組織的特異性表達可能與其生理功能不同有關[3]。2004年,大豆天冬氨酸蛋白酶soyAP1和soyAP2的cDNA被克隆,Northern分析表明,soyAP2在除種子以外的根、莖、葉、花等各種組織中均可表達,而soyAP1只在種子中特異性表達[6],暗示其啟動子很可能是種子特異性啟動子。
大豆皮約占整個大豆種子質量的8%[7]。近年來,隨著大豆脫皮制油和脫皮生產大豆分離蛋白工藝的普遍應用,產生了大量的副產物大豆皮。目前,大豆皮主要用做飼料,綜合利用度低。為提高大豆皮的綜合利用度,人們已經開展了從大豆皮中提取膳食纖維和有效成分的研究,大豆皮約含9.56%的蛋白質[8],從1969 年Buzzll等[9]發現大豆皮過氧化物酶開始,迄今已從大豆皮中提取純化到過氧化物酶[10],Bowman - Birk 型蛋白酶抑制劑[11]和幾丁質酶I[12]等生物活性蛋白質,其中大豆皮過氧化物酶在食品添加劑[13]、生物傳感器[14]和環保方面[15]已有比較廣泛的應用。
雖然已有植物天冬氨酸蛋白酶及其可能功能的相關報道,但對于大豆天冬氨酸蛋白酶人們知之甚少,而大豆是人們一種重要的食品蛋白質資源。據報道大豆天冬氨酸蛋白酶在胚軸和子葉中均有存在[16],但迄今鮮見其分子實體和功能的相關信息。因此,本研究從大豆加工副產物——大豆皮高值化利用的角度出發,在纖維素酶輔助提取大豆皮蛋白質的基礎上,通過離子交換層析純化大豆皮蛋白粗提物,用基質輔助激光解析電離飛行時間質譜(MALDI-TOF-MS)進行鑒定,并測定了其在各種pH下的酶活性。以期為醫藥保健和食品加工提供原料天然,來源廣泛、成本低廉、工藝易于規模化放大的目標產品。
1 材料與方法
1.1 材料與儀器
大豆皮粉:山東香馳控股集團;Viscozyme L復合植物水解酶:丹麥Novozymes公司;標準分子質量蛋白、血紅蛋白:北京鼎國昌盛生物技術有限責任公司;測序級改性胰蛋白酶:美國Promega公司;其他化學試劑均為分析純。
Labor Pilot 2000/4膠體磨:德國IKA公司;F-70薄膜閃蒸儀:日本Tokyo Rikakikai公司;AKTA純化系統:美國GE公司;DELTA 1-24 LSC冷凍干燥機:德國Christ公司;KjelFlex K-360凱氏定氮儀:瑞士Buchi公司;PROTEAN Tetra電泳系統:美國BIORAD公司;4800 Plus MALDI-TOF-TOFTM分析儀:美國Applied Biosystems公司;GENESYS 10S UVVis分光光度計:美國Thermo公司;Millipore純水系統:法國Millipore公司。
1.2 試驗方法
1.2.1 大豆皮天冬氨酸蛋白酶的提取
100 g大豆皮粉加40倍體積0.2 mol/L CaCl2溶液,用膠體磨剪切30 min,在溫度40℃,pH=4.5條件下按3.02 FBG/g加入Viscozyme L復合植物水解酶,提取6 h后,以8 000 r/min的速度離心10 min除去沉淀,上清液在40℃下用F-70薄膜閃蒸儀濃縮,濃縮液加100% 三氯乙酸(TCA)至終濃度10%,在4℃下放置30 min;然后以8 000 r/min的速度離心30 min,去掉上清,將沉淀再懸浮于適量的0.1 mol/L NaOH溶液中,渦旋混勻后的蛋白提取物溶液對Millipore純水(15 MΩ)透析3 d,然后用Alphal-4冷凍干燥機干燥。
1.2.2 蛋白質含量分析
微量凱氏定氮法(N×6.25)。
1.2.3 CM-Sepharose柱層析
經透析的濃度約1 mg/mL的粗蛋白液20 mL上CM-Sepharose柱,CM-Sepharose柱首先用25 mmol/L Tris-HCl(pH =8.0)緩沖液平衡。洗脫程序:首先用100 mL 25 mmol/L 的Tris- HCl(pH =8.0)緩沖液洗脫未交換上的蛋白質;然后用200 mL pH 8.0的Tris-HCl緩沖液與等體積含0.4 mol/L NaCl的Tris-HCl緩沖液進行梯度洗脫結合上的蛋白質;最后用1 mol/L的NaOH溶液進行洗脫。洗脫流速30 mL/h,每5 mL(10 min)收集1 管。測定每管洗脫液的A280nm值。對有吸光值的洗脫液以血紅蛋白為底物進行酶活力測定。合并有酶活性的洗脫液,對超純水(18.2 MΩ)透析1 d,濃縮,冷凍干燥。
1.2.4 SDS-PAGE
按Laemmli[17]的方法。采用不連續垂直板狀凝膠電泳,凝膠厚度1 mm,濃縮膠濃度為5%,電流15 mA,分離膠濃度為12%,電流30 mA。用考馬斯亮藍R -250(0.05%,m/V)染色2 h,用蒸餾水漂洗2 ~3次,再用甲醇、冰醋酸溶液(甲醇∶冰醋酸∶水=1∶1∶8,V/V/V)在脫色搖床上脫色,直至各亞基條帶清晰。電泳凝膠用Bio-Rad公司的Quantity-one軟件分析。
1.2.5 MALDI-TOF-TOF MS
通過膠內酶解和基質輔助激光解析電離飛行時間二級質譜(MALDI-TOF-TOF MS)鑒定蛋白質。從聚丙烯電泳凝膠中手動切取蛋白條帶,用Millipore純水洗3次,在含50 mmol/L NH4HCO350%的乙腈中對考馬斯亮藍染色的蛋白條帶脫色2次,在含10 mmol/L DTT 的50 mmol/L NH4HCO3溶液中進行還原,在含40 mmol/L 碘乙酰胺的50 mmol/L NH4HCO3溶液中烷基化,用100%乙腈干燥2次,然后在37℃下在含測序級改性胰蛋白酶的50 mmol/L NH4HCO3溶液中消化過夜。消化后的多肽用含0.1%三氟乙酸(TFA)的50%的乙腈提取2次。合并提取液并凍干。得到的胰蛋白酶酶解的多肽凍干粉溶解含0.1%TFA和50% 乙腈的5 mg/mL CHCA基質中。用4800 Plus MALDI-TOF-TOFTM分析儀進行MALDI-TOF-TOF MS分析。
利用在線MASCOT 程序(http://www.matrixscience.com)對所有蛋白質質譜數據在NCBInr數據庫中進行搜索。搜索參數:允許最大的肽質量誤差為0.15 u,允許最大的TOF-TOF片段質量誤差為0.25 u,允許最大的未被酶切位點數為1,固定修飾為脲甲基半胱氨酸[Carbamidomethyl(C)],可變修飾為氧化甲硫氨酸[(Oxidation(M)]。只有被MASCOT概率分析定義為顯著的hits(P<0.05)才被接受。
1.2.6 大豆皮天冬氨酸蛋白酶活力的測定
按Barret等[18]方法測定不同pH值下的酶活力:取溶于各種pH值緩沖液中的1%(m/V)血紅蛋白溶液200μL與溶于相同pH值緩沖液中的50μL酶液混合,37 ℃孵育30 min。加入250 μL 10%(m/V)冰三氯乙酸(TCA)溶液終止反應。反應混合物靜置20 min 后以10 000 r/min 離心10 min,用GENESYS10S UV-Vis分光光度計在280 nm檢測上清中的多肽。酶活力單位采用國際單位(IU,又稱U),1個國際單位為在特定條件下(如37℃,pH=3),1 min內轉化1μmol底物,或者底物中1μmol有關基團所需的酶量。
2 結果與討論
2.1 大豆皮蛋白粗提物和純化后樣品的得率與酶活力
大豆皮蛋白粗提物和純化后樣品的得率與酶活力見表1。用本方法提取到的大豆皮蛋白粗品得率約為1.21%,利用凱氏定氮法測得粗提物中蛋白質含量為55.19%,因此粗提物中總蛋白量為667.8 mg,因大豆皮原料的質量為100 g,因此,粗提物中蛋白質的得率為0.67%。過CM-Sepharose層析柱純化后,將有酶活性的洗脫部分凍干后得到23.3 mg的樣品,純化后的蛋白質得率約為0.02%,即233 mg/kg。雖然大豆皮約含9.56%的蛋白質,但大部分是與纖維素、半纖維素和果膠等細胞壁成分共價結合的結構蛋白,如伸展蛋白、富甘氨酸蛋白等,這些共價結合的結構蛋白在成熟的次生細胞壁中是不能夠被提取的,而像細胞質中的天冬氨酸蛋白酶這一類生物活性蛋白質本身含量很少,因此,這些活性蛋白的得率很低。對粗提物和純化后的蛋白按Barret和Heath的方法測定酶的活力,粗提物對血紅蛋白的比活性為3.45 U/mg,純化后的樣品比活性為62.1 U/mg。這些比活力結果分別與Athauda等[19]報道的豬籠草天冬氨酸蛋白酶1在原液中和DEAE-52柱層析純化后的比活力相近。

表1 大豆皮蛋白粗提物和純化后樣品的得率和比活力
2.2 大豆皮蛋白粗提物和純化后蛋白的SDSPAGE
大豆皮蛋白粗提物和純化后蛋白的SDS-PAGE見圖2。大豆皮蛋白粗提物在分子質量約50 ku處有一細蛋白條帶(圖1蛋白條帶A),在分子質量為18 ku附近有一粗條帶,在分子質量為10 ku附近有一些弱的條帶。經Bio-Rad凝膠分析軟件Quantityone分析表明,蛋白條帶A占整個泳道光密度值的5%,大豆皮蛋白粗提物經CM-Sepharose層析柱純化后,有酶活性的洗脫部分的電泳圖譜如圖1泳道2,該泳道只在分子質量約50 ku處有1條清晰的蛋白條帶(圖1蛋白條帶B)。
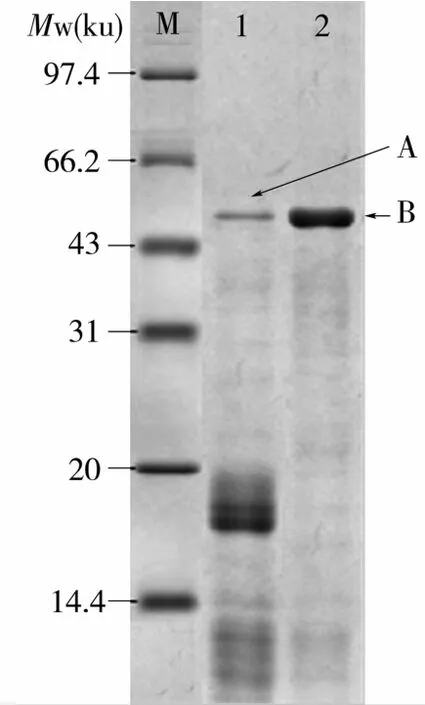
圖1 大豆皮蛋白粗提物和純化后蛋白的SDS-PAGE圖譜
2.3 大豆皮天冬氨酸蛋白酶的鑒定
對大豆皮蛋白粗提物和純化后蛋白的SDSPAGE凝膠中的蛋白條帶進行了切膠鑒定。經膠內酶解、MALDI-TOF-MS分析獲得其肽質量指紋譜(peptide mass fingerprinting,PMF)如圖2,從圖1 蛋白條帶A中鑒定出4個達顯著值(P<0.05)的肽段(表2),從圖1蛋白條帶B中鑒定出5個達顯著值(P<0.05)的肽段(表3),然后對PMF進行二級質譜分析(表2~表3)。由于純化后的蛋白樣品(圖1蛋白條帶B)的純度提高,所以蛋白質鑒定的Mowse得分比粗提物中該蛋白的得分高(表4),且2個蛋白條帶(圖1蛋白條帶A和B)的Mowse得分均顯著高于可接受得分閾值(55分)。因此,這2個蛋白條帶均被鑒定為類豬籠草蛋白酶1大豆天冬氨酸蛋白酶(aspartic proteinase nepenthesin -1 -like[Glycine max])。從而確定試驗分離純化到的蛋白質是類豬籠草蛋白酶1大豆天冬氨酸蛋白酶。而大豆皮蛋白粗提物SDS-PAGE電泳凝膠的三條蛋白條帶中,只有蛋白條帶A(圖1)被鑒定為類豬籠草蛋白酶1大豆天冬氨酸蛋白酶,而在分子質量為18 ku附近的粗條帶和在分子質量為10 ku附近的弱條帶均無可接受的質譜鑒定結果(數據未列出)。
豬籠草蛋白酶(Nepenthesin),又稱豬籠草酸性蛋白酶(Nepenthacin)、豬籠草天冬氨酸蛋白酶(Nepenthasin),它是豬籠草(Nepenthessp.)捕蟲籠及盾葉毛膏菜(Drosera peltata)分泌的天冬氨酸蛋白酶。其與胃蛋白酶類似,但其也能酶切兩側的天冬氨酸殘基及賴氨酸和精氨酸。其對pH值及溫度的穩定性高于豬胃蛋白酶A[20]。在豬籠草屬中已確定了2個同工酶[19,21]:豬籠草蛋白酶1(nepenthesin - 1)和豬籠草蛋白酶2(nepenthesin-2)。這2個同工酶富含半胱氨酸殘基(12個半胱氨酸殘基/分子),分子建模表明這12個半胱氨酸殘基可形成6個分子內二硫鍵,這也是豬籠草蛋白酶具有非凡穩定性的原因。被鑒定出的類豬籠草蛋白酶1大豆天冬氨酸蛋白酶前體有451個氨基酸殘基,這一鑒定結果是根據質譜數據從大豆基因組序列(NW_003722732.1)自動計算分析獲得的,該基因組數據由Gnomon基因預測方法注釋并受mRNA和EST數據的支持。因此,本研究首次從大豆皮中獲得了該基因序列編碼的蛋白質分子實體。通過在線信號肽預測軟件SignalP-4.1[22](http://www.cbs.dtu.dk/services/SignalP/)分析(數據未列出),其N端起始的前34個氨基酸殘基為信號肽,成熟分子含有13個半胱氨酸殘基,與豬籠草蛋白酶1等植物天冬氨酸蛋白酶和豬胃蛋白酶等動物天冬氨酸蛋白酶均具有序列同源性。
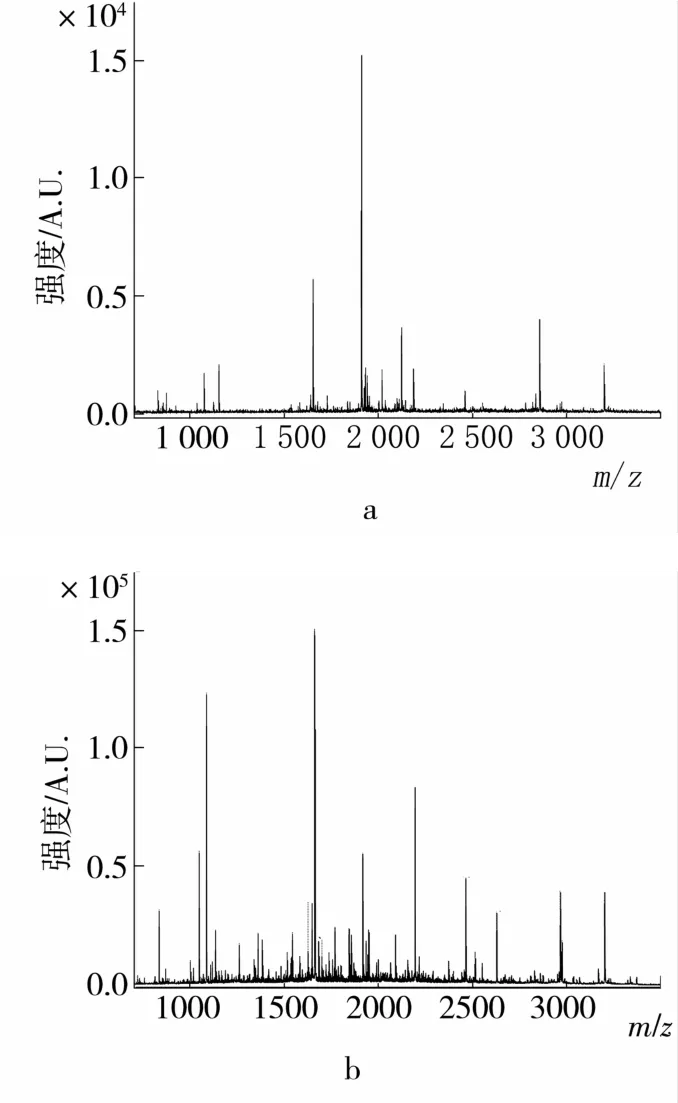
圖2 圖1中蛋白條帶A(a)和B(b)的肽質量指紋譜
2.4 大豆皮天冬氨酸蛋白酶的酶活力測定
大豆皮天冬氨酸蛋白酶在不同pH值下的相對活力見圖3。以血紅蛋白為底物的最佳酶活力出現在pH3(比活力為62.1 U/mg),將此比活力值定為1,其他pH值下的比活力與pH3下的比活力相比得到相對活力。從圖3看出,當pH值從3增加到3.5時,其相對活力迅速下降到46%,當pH值繼續增加時,其相對活力繼續下降,當pH值為6時,其相對活力下降到只有8%。而當pH值從3下降時,相對活力下降較緩,當pH值為2時,其相對活性仍有57%。這說明類豬籠草蛋白酶1大豆天冬氨酸蛋白酶具有天冬氨酸蛋白酶家族在酸性pH下有活性的典型特征。

表2 通過二級質譜從圖1蛋白條帶A中鑒定出的肽段

表3 通過二級質譜從圖1蛋白條帶B中鑒定出的肽段

表4 圖1中蛋白條帶A和B的二級質譜鑒定結果
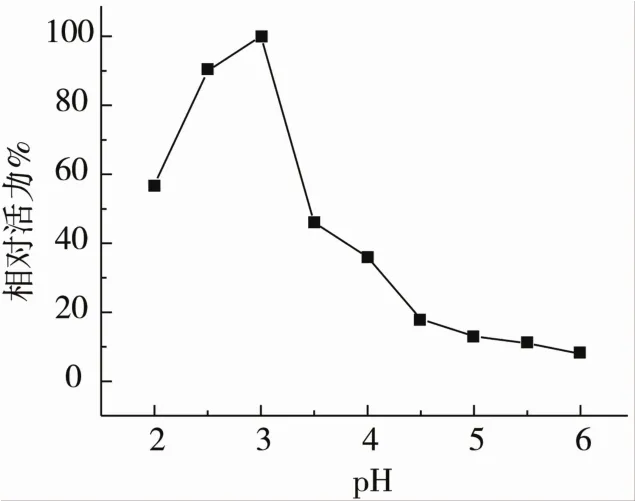
圖3 類豬籠草蛋白酶1大豆天冬氨酸蛋白酶在不同pH值下的相對活力
3 結論
從大豆加工副產物——大豆皮中純化獲得類豬籠草蛋白酶1大豆天冬氨酸蛋白酶,并利用基質輔助激光解析電離飛行時間二級質譜(MALDI-TOFTOF MS)進行了鑒定。其得率為233 mg/kg。該酶具有天冬氨酸蛋白酶家族在酸性pH下有活性的典型特征,在最適pH條件——pH 3時,類豬籠草蛋白酶1大豆天冬氨酸蛋白酶對血紅蛋白的比活力為62.1 U/mg。
[1]Davies D R.The structure and function of the aspartic proteinases[J].Annual Review of Biophysics and Biophysical Chemistry,1990,19:189 -215
[2]Rawlings N D,Barrett A J.Merops:the peptidase database[J].Nucleic Acids Research,1999,27:325 -331
[3]Simoes I,Faro C.Structure and function of plant aspartic proteinases[J].European Journal of Biochemistry,2004,271:2067-2075
[4]Asakura T,Watanabe H,Abe K,et al.Rice aspartic proteinase,oryzasin,expressed during seed ripening and germination,has a gene organization distinct from those of animal and microbial aspartic proteinases[J].European Journal of Biochemistry,1995,232:77 -83
[5]Xia Chen,Pfeil J E.The three typical aspartic proteinase genes of Arabidopsis thaliana are differentially expressed[J].European Journal of Biochemistry,2002,269:4675 -4684
[6]Terauchi K,Asakura T,Nishizawa N K,et al.Characterization of the genes for two soybean aspartic proteinases and analysis of their different tissue - dependent expression[J].Planta,2004,218:947 -957
[7]Gnanasambandam R,Proctor A.Preparation of soy hull pectin[J].Food Chemistry,1999,65:461 -467
[8]Rackis J J,Anderson R L,Sasame H A,et al.Amino acids in soybean hulls and oil meal fractions[J].Journal of Agriculture and Food Chemistry,1961,9:409 -412
[9]Buzzell R I,Buttery B R.Inheritance of peroxidase activity in soybean seed coats[J].Crop Science,1969,9:387 -388
[10]Gillikin J W,Graham J S.Purification and developmental analysis of the major anionic peroxidase from the seed coat of Glycine max[J].Plant Physiology,1991,96:214 -220
[11]Sessa D J,Wolf W J.Bowman - Birk inhibitors in soybean seed coats[J].Industrial Crops and Products ,2001,14:73-83
[12]Gijzen M,Kuflu K,Qutob D,et al.A class I chitinase from soybean seed coat[J].Journal of Experimental Botany,2001,52:2283 -2289
[13]Gélinas P,Poitras E,McKinnon CM,et al.Oxido - reductases and lipases as dough - bleaching agents[J].Cereal Chemistry,1998,75:810 -814
[14]Heller A,Vreeke M S.Soybean peroxidase electrochemical sensor:USPatent,5665222[P].1997
[15]Flock C,Bassil A,Gijzen M.Removal of aqueous phenol and 2-chlorophenol with purified soybean peroxidase and raw soybean hulls[J].Journal of Chemical Technology and Biotechnology,1999,74:303 -309
[16]Bond H M,Bowles D J.Characterization of soybean endopeptidase activity using exogenous and endogenous substrates[J].Plant Physiology,1983,72:345 -350
[17]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680 -685
[18]Barret A J,Heat M F.Lysosomal enzyme and lysosomes[M]//Diegle J J.Laboratory Handbook.Holland:Elsevier Science,1977:24
[19]Athauda SB P,Matsumoto K,Rajapakshe S,et al.Enzymic and structural characterization of nepenthesin,a unique member of a novel subfamily of aspartic proteinases[J].Biochemistry Journal,2004,381:295 -306
[20]Jentsch J,Meierkord S,Hammer M.The enzymes from carnivorous plants(Nepenthes):Properties and characterization of the acid protease nepenthacin[J].Planta Medica,1989,55:227
[21]Nakayama S,Amagase S.Acid protease in nepenthes:partial purification and properties of the enzyme[J].Proceedings of the Japan Academy,1968,44:358 -362
[22]Petersen T N,Brunak S,von Heijne G,et al.SignalP 4.0:discriminating signal peptides from transmembrane regions[J].Nature Methods,2011,8:785 -786.
Extraction,Purification and Identification of Aspartic Proteinase from Soy Hulls
Liu Chun1Cheng Fenfen1Ma Hongyu2Wang Jinmei1Hou Junjie1Yang Xiaoquan1
(Research and Development Center of Food Proteins,College of Light Industry and Food Sciences,South China University of Technology,Engineering Research Center of Starch and Vegetable Protein Processing Ministry of Education1,Guangzhou 510641)
(College of Plant Protection,Nanjing Agricultural University2,Nanjing 210095)
Soy hull,a co - product of soybean processing,was investigated as a source of aspartic proteinase.Crude soy hull proteins were isolated from soy hulls by a cellulase-assisted extraction method,further purified via ion exchange chromatography with CM-Sepharose Fast Flow column.The crude protein and purified protein were identified by SDS-PAGE.The separated protein bands in SDS-PAGE were cut and identified using matrix-assisted laser desorption /ionization time-of-flight/time-of-flight mass spectrometry(MALDI-TOF-TOF MS),the enzymatic activity of the identified protein was determined in the range of pH 2~6.The results indicated that we firstly purified a soybean aspartic proteinase nepenthesin-1 -like from soy hulls,the yield of purified aspartic proteinase was 233 mg/kg,and the specific activity of soybean aspartic proteinase nepenthesin -1 - like reached to the peak value at pH 3,62.1 U/mg.
aspartic proteinase nepenthesin - 1 - like [Glycine max],extraction,purification,identification,MALDI-TOF-MS
TS253.1
A
1003-0174(2016)08-0111-06
863計劃(2013AA102208-3),公益性行業(農業)科研專項(201303071),糧食公益性行業科研專項(201313005)
2014-12-30
劉春,男,1978年出生,博士,蛋白質化學與工程
楊曉泉,男,1965年出生,教授,蛋白質化學與工程

