山杏仁蛋白源α-葡萄糖苷酶抑制肽的分離、純化及鑒定
顧 欣 崔 潔 李 迪 王豐俊 王建中
山杏仁蛋白源α-葡萄糖苷酶抑制肽的分離、純化及鑒定
顧 欣1,2崔 潔1,2李 迪3王豐俊1王建中1
(林業食品加工與安全北京市重點實驗室北京林業大學1,北京 100083)
(北京林業大學自然保護區學院2,北京 100083)
(河北化工醫藥職業技術學院3,石家莊 050026)
針對木本油料山杏的蛋白質高值化利用問題,利用蛋白酶Alcalase酶解山杏仁蛋白,以體外α-葡萄糖苷酶抑制能力作為評價指標,篩選高活性α-葡萄糖苷酶抑制肽。山杏仁蛋白酶解液通過超濾、G-25葡聚糖凝膠柱、分子篩以及反相高效液相色譜的分離純化,最終篩選得到2種高活性的α-葡萄糖苷酶抑制肽,其抑制能力分別為6.6μg/mL和7.0μg/mL。利用質譜和氨基酸測序儀對兩種α-葡萄糖苷酶抑制肽的分子質量以及序列結構進行了研究,確認2種山杏仁蛋白源α-葡萄糖苷酶抑制肽分別為色氨酸-丙氨酸(WA)和蘇氨酸-色氨酸(TW),其α-葡萄糖苷酶抑制能力的IC50值分別為23.97μmol/L和22.93μmol/L。
山杏仁多肽 α-葡萄糖苷酶抑制肽 分離 純化 鑒定
糖尿病是以持續性高血糖為基本生化特征的一種機制復雜的疾病,是一種因體內胰島素絕對或相對分泌不足而引起的糖、脂肪和蛋白質代謝紊亂的慢性全身性疾病[1]。隨著人們生活方式的轉變,糖尿病已成為僅次于腫瘤、心血管、腦血管疾病之后的嚴重威脅人類健康的慢性疾病之一[2]。治療Ⅱ型糖尿病的藥物也有很多種,其中主要有胰島素促泌劑,雙胍類,胰島素分泌模式調節劑以及α-葡萄糖苷酶抑制劑[3]。α-葡萄糖苷酶的活性受到抑制,便能延緩α-糖苷酶將多糖分解為葡萄糖,從而減慢葡萄糖的吸收速度,起到降低餐后血糖水平的作用[4,5]。阿卡波糖這類人工合成的α-葡萄糖苷酶抑制劑在臨床上會伴隨一些副作用的發生,因此開發更多天然的、安全的α-葡萄糖苷酶抑制劑對Ⅱ 型糖尿病的治療有著重大的意義[6]。
山杏是我國著名的木本油料,也是三北防護林的主要樹種,廣布于我國12個省市區。山杏仁營養豐富,富含蛋白質、脂肪、礦物質和維生素,其蛋白質含量、氨基酸總量、必需氨基酸總量高于一般堅果,有很高的經濟價值和藥用價值。山杏仁蛋白還具有抗腫瘤、降血壓、降血糖、降膽固醇等功效[7-9]。研究人員成功從蠶絲蛋白中提取了三肽的α-葡萄糖苷酶抑制劑[10]。研究了山杏仁蛋白源α-葡萄糖苷酶抑制肽的分離篩選,對所得高活性α-葡萄糖苷酶抑制肽進行了結構分析,為II型糖尿病肽類治療劑的開發提供了參考。
1 材料與方法
1.1 材料與儀器
1.1.1 材料與試劑
山杏仁:平泉亞歐杏仁有限公司;α-葡萄糖苷酶(Intestinal acetone powders from rat,10 G)、4 - 硝基苯-α-D-吡喃葡萄糖苷(PNPG,純度>99%)、1,1-二苯基-2-苦肼基(1,1,-dipheny1-2-picry-hydrazy,DPPH):Sigma 公司;Na2HPO4·12H2O、NaH2PO4·2H2O、Na2CO3、鹽酸、無水乙醇:北京化工廠,均為分析純試劑;乙腈、三氟乙酸、甲醇均為色譜純試劑:北京拜爾迪生物技術有限公司;實驗用水為去離子水。
1.1.2 材料與儀器
微孔濾膜(水系0.45μL,有機系0.22μL):北京藍弋化工產品有限公司;高效液相層析色譜分析儀:上海滬西儀器分析廠;PPSQ-31A全自動蛋白/多肽序列儀:日本Shimadzu Corporation;?KTA avant 25系統:日本;反相高效液相色譜:日本島津。
1.2 試驗方法
1.2.1 山杏仁蛋白的提取[11]
稱取10 g脫脂山杏仁粉(過篩60目)溶于140 mL去離子水中,配制成溶液在細胞破碎儀下破碎10 min,使樣品蛋白充分溶出。維持體系溫度為37℃,pH 9.0,提取山杏仁蛋白60 min反應結束后,將浸提液在4 000 r/min條件下離心20 min,得到上清液調pH 至4.1,并在5 000 r/min 下離心15 min,收集沉淀,水洗沉淀調節其pH值至中性,迅速冷凍干燥得到山杏仁蛋白,并且在-20℃ 下貯藏以備用。
1.2.2 山杏仁蛋白酶解物制備
選取蛋白酶Alcalase 2.4 L FG(簡稱Alcalase)水解山杏仁蛋白,具體參數:料液比為50 g/L,加酶量為0.75%(體積比),pH值為9.0,水解溫度為50℃,水解時間為6 h。
1.2.3 α-葡萄糖苷酶抑制活性的測定
樣品對α-葡萄糖苷酶的抑制能力利用分光光度計法[12],通過反應生成PNP的量來確定。一定濃度的樣品中加入50μL 25 mg/mLα-葡萄糖苷酶溶液,50μL 0.913 3 mg/mL PNPG 溶液及120 μL 0.5 mol/L(pH 6.7)磷酸緩沖溶液。混勻后在37℃ 下保溫60 min,加入0.67 mol/L Na2CO3溶液終止反應。空白組用去離子水替代樣品溶液,背景組用磷酸緩沖液代替酶和底物。反應在405 nm下測定吸光值。計算公式:

式中:B為α-葡萄糖苷酶活性抑制率;A空為空白組的吸光度值;A樣為樣品組的吸光度值;A背為背景組的吸光度值。
1.2.4 α-葡萄糖苷酶抑制肽分離純化
α-葡萄糖苷酶抑制肽分離純化基本流程:
山杏仁蛋白Alcalase水解產物→超濾→凝膠層析→反相高效液相色譜→分子篩→第2次反相高效液相色譜→高純度高活性的α-葡萄糖苷酶抑制肽。
1.2.4.1 超濾
山杏仁蛋白Alcalase水解產物在4℃條件下經不同分子質量大小的超濾膜(MWCO 30 000 u、10 000 u、5 000 u)獲得具有不同分子質量的濾液,并測定各部分濾液的體外α-葡萄糖苷酶抑制活性。
1.2.4.2 Sephadex G-25 Medium凝膠層析分離
具有高α-葡萄糖苷酶抑制活性的組分經G-25葡聚糖凝膠色譜進行層析分離。流動相為:10 mmol/L Tris-HCl(pH 7.0)。色譜柱條件:Sephadex G25 Medium 柱(1.6 cm ×60 cm;Pharmacia,USA),流速為1 mL/min,整個設備系統在4℃ 下進行。洗脫峰在280 nm波長處進行檢測并收集。
1.2.4.3 反相高效液相色譜分離
具有高α-葡萄糖苷酶抑制活性的組分經反向高校液相色譜柱分離。色譜柱為Zorbax SB-C18反相高效液相色譜柱(4.6 mm×250 mm,5μm)。流動相A(0.06%三氟乙酸的水溶液)為平衡緩沖液,流動相B(0.05%三氟乙酸的乙腈溶液)為洗脫緩沖液。分離純化的洗脫梯度為流動相B(0%~50%)洗脫26 min,流動相A(50%~100%)洗脫4 min,洗脫峰在280 nm處進行檢測并收集。
1.2.4.4 分子篩分離
分離出的高活性的組分經過?KTA avant 25系統分離。分子篩的柱子SuperdexTM Peptide 10/300 GL(10 mm ×300 mm)。平衡緩沖液為20 mmoL/L PBS 緩沖溶液(pH 7.0),流速0.5 mL/min,進樣量為100μL洗脫梯度為等梯度2個柱體積,洗脫峰在280 nm處檢測并收集。
1.2.4.5 反相高效液相色譜純化
得到的高活性的山杏仁多肽凍干粉用反相高效液相色譜繼續純化,進一步得到高純度高活性的α-葡萄糖苷酶抑制肽。具體的色譜條件及方法與反向色譜分離的操作步驟相同。
1.2.5 α-葡萄糖苷酶抑制肽質譜及氨基酸序列分析
分離純化后的α-糖苷酶抑制肽的分子質量通過基質輔助激光解析電離飛行時間質譜進行檢測,其氨基酸序列通過PPSQ-31A全自動蛋白/多肽序列儀測定。
2 結果與討論
2.1 α-葡萄糖苷酶抑制肽分離純化
蛋白質的水解程度與其生成肽鏈的長短有一定的關系,通常可以認為平均肽鏈長度=1/水解度[13]。短肽容易以完整的形式被吸收進入人體代謝循環中,從而其生物活性較容易保持,本研究最終得到水解度為29.43%的山杏仁蛋白水解度,平均肽鏈長度為3.4,較易被人體吸收。
蛋白酶Alcalase酶解的山杏仁蛋白酶解液經過分子質量截留后,得到30 ku以上,30~10 ku,10~5 ku和5 ku以下4個不同分子質量的酶解液,分別測定其α-葡萄糖苷酶抑制活性。有研究表明蛋白水解物截留分子質量與其生物活性有一定的關系,超濾物的分子質量越小其抑制活性越高[14]。由圖1可知,分子質量0~5 ku的組分α-葡萄糖苷酶抑制能力最強(0.42 mg/mL)。因此選取分子質量為0~5 ku Alcalase山杏仁蛋白酶解液繼續分離質純化。
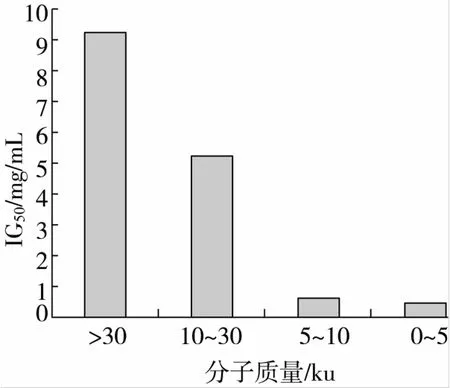
圖1 不同分子質量的酶解液的α-葡萄糖苷酶抑制活性
在分離純化的過程中,利用多種分離手段相結合的方式,更容易將目的產物分離出來[15]。因此選用Sephadex G-25 Medium凝膠柱分離蛋白酶Alcalase酶解液0~5 ku組分,得到3個主要吸收峰:P1、P2和P3,具體結果見圖2,分別測定其α-葡萄糖苷酶抑制活性。各色譜峰的α-葡萄糖苷酶抑制活性的IC50值見圖3,色譜峰P2對α-葡萄糖苷酶抑制抑制能力較高達到0.001 6 mg/mL,對該組分進一步的分離篩選。
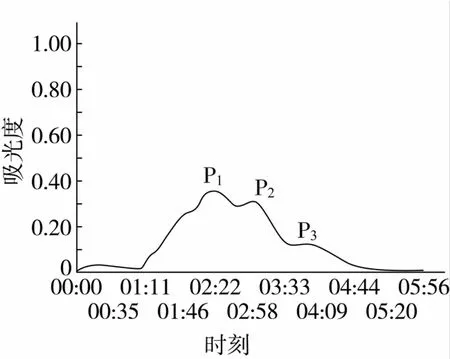
圖2 Alcalase酶解液0~5 ku組分Sephadex G-25凝膠層析色譜圖
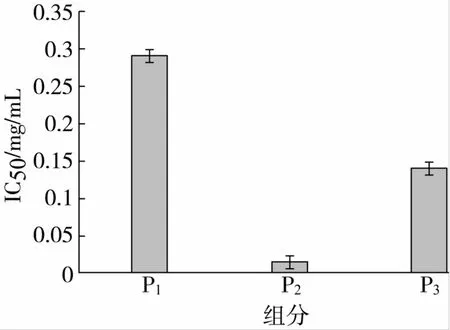
圖3 Alcalase酶解液0~5 ku組分分離峰的α-葡萄糖苷酶抑制活性
蛋白酶Alcalase酶解液分離產物P2組分經反相C18柱分離得到P2P1、P2P2、P2P3、P2P4和P2P5五個主要組分(圖4),分別測定各組分的α-葡萄糖苷酶抑制活性,其中組分P2P1α-葡萄糖苷酶抑制活性的IC50值為0.007 1 mg/mL,組分P2P2α - 葡萄糖苷酶抑制活性的IC50值為0.007 5 mg/mL,與另外3個組分相比有較高的α-葡萄糖苷酶抑制活性(見圖5)。選用分子篩對組分P2P1、P2P2進一步分離純化。
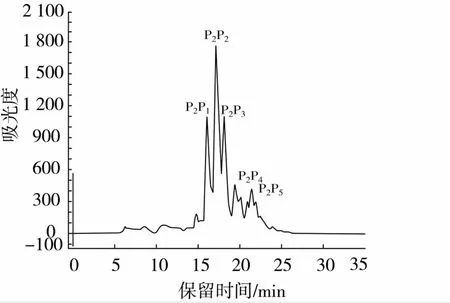
圖4 蛋白酶Alcalase酶解液分離產物P2組分反相高效液相色譜圖
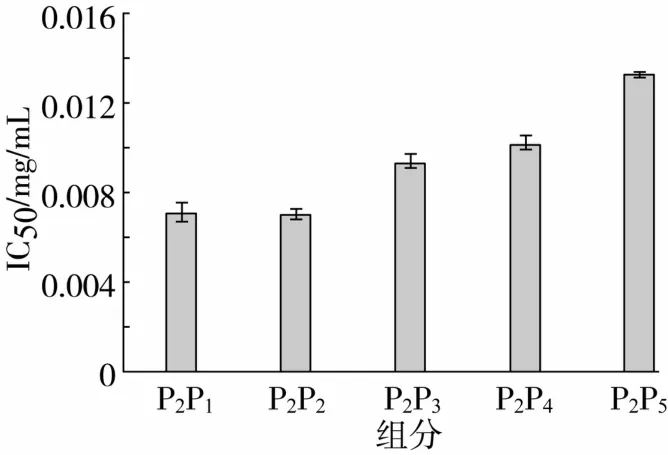
圖5 蛋白酶Alcalase酶解液分離產物P2組分分離峰的α-葡萄糖苷酶抑制活性
產物P2P1組分經過SuperdexTM Peptide 10/300 GL柱分離得到色譜圖見圖6,選取最大吸收峰b用反相高效液相色譜純化高純度組分B(圖7),對B組分進行α-葡萄糖苷酶抑制活性測定,最終得到高純度高活性的α-葡萄糖苷酶抑制肽B(IC50=0.006 6 mg/mL)。
用與組分P2P1相同的分離方法來篩選蛋白酶Alcalase酶解液分離產物P2P2組分得到分子篩色譜圖(圖8),選取主峰d進行純化得到高純度高活性的α-葡萄糖苷酶抑制肽D(圖9),其α-葡萄糖苷酶抑制活性的IC50值為0.007 0 mg/mL。所得2種α-葡萄糖苷酶抑制肽比市售降糖藥拜糖平(IC50為0.010 8 mg/mL)的α -葡萄糖苷酶抑制能力更強[16]。
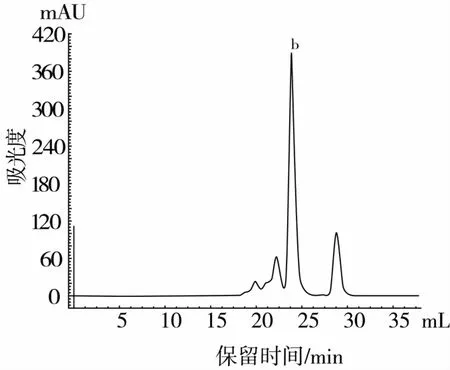
圖6 蛋白酶Alcalase酶解液分離產物P2P1組分分子篩色譜圖
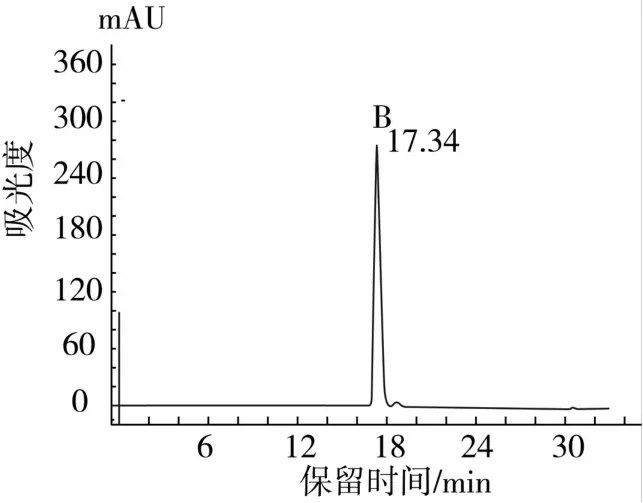
圖7 蛋白酶Alcalase酶解液分離產物b分離峰的高效液相色譜純化色譜圖
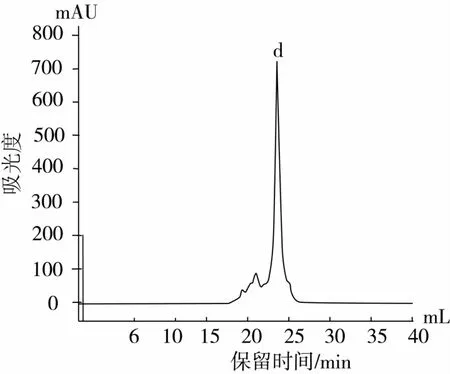
圖8 蛋白酶Alcalase酶解液分離產物P2P2組分分子篩色譜圖
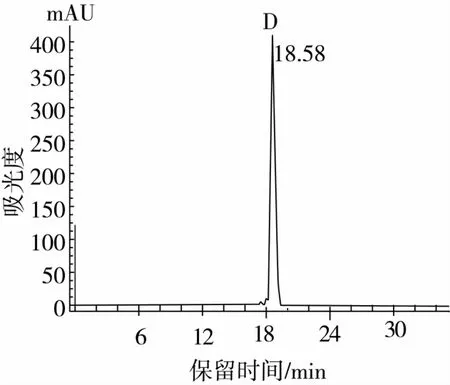
圖9 蛋白酶Alcalase酶解液分離產物d分離峰的高效液相色譜純化色譜圖
2.2 α-葡萄糖苷酶抑制肽結構
2.2.1 α-葡萄糖苷酶抑制肽B
純化后獲得的高活性的山杏仁蛋白源α-葡萄糖苷酶抑制肽B的質譜結果如圖10所示,預測其分子質量為:275.4 g/mol。經過N-端氨基酸序列分析,B的氨基酸序列為色氨酸-丙氨酸(Trp-Ala),實際分子質量為275.31 g/mol。
2.2.2 α-葡萄糖苷酶抑制肽D
純化后獲得的高活性的山杏仁蛋白源α-葡萄糖苷酶抑制肽D的質譜結果如圖11所示,測定其分子質量為306.3 u。經過N-端氨基酸序列分析,D的氨基酸序列為蘇氨酸-色氨酸(Thr-Trp),實際分子質量為305.34 u。
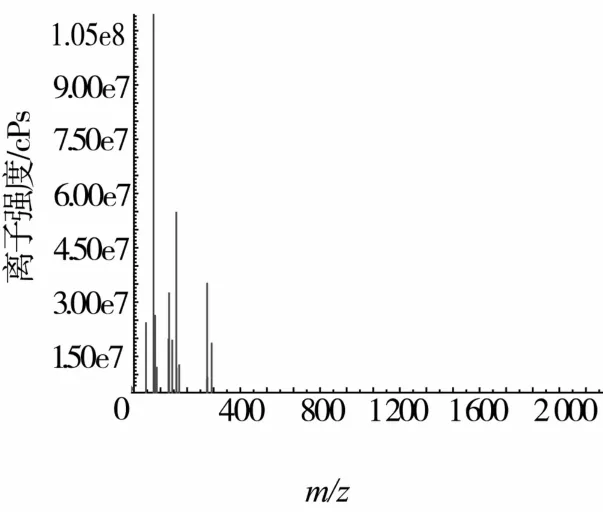
圖10 蛋白酶Alcalase酶解肽(B)質譜分析圖

圖11 蛋白酶Alcalase酶解肽(D)質譜分析圖
3 結論
利用酶解、分子質量截留、分子篩、反相高效液相色譜等技術,對山杏仁蛋白酶解液進行分離純化,得到兩種α-葡萄糖苷酶抑制肽,并對其進行質譜分析和氨基酸序列分析,最終得到的山杏仁蛋白源α-葡萄糖苷酶抑制肽分別為色氨酸-丙氨酸(WA)和蘇氨酸-色氨酸(TW),兩者的α-葡萄糖苷酶抑制能力的IC50值分別為23.97 μmol/L 和22.93 μmol/L,其α-葡萄糖苷酶抑制能力優于市售藥物拜糖平。這不僅為血糖的控制提供了一個良好的植物蛋白來源,而且提高了山杏仁蛋白在產業中的利用價值。對于已知結構的多肽可以利用合成的方法提高其產量,應用于如降糖的動物實驗或者其他生物活性的研究。
[1]Nassar PO,Walker C S,Salvador C S,et al.Lipid profile of people with Diabetes mellitus type 2 and periodontal disease[J].Diabetes research and clinical practice,2012,96(1):35-39
[2]丁長河,韓小存,周林秀.幾種雜糧面條對糖尿病大白鼠餐后血糖的影響[J].中國糧油學報,2013,28(6):40 -43
Ding Changhe,Han Xiaocun,Zhou linxiu.The Effect of Several Miscellaneous Grain noodles on the postprandial blood glucose of diabetic rats[J].Journal of the Chinese Cereals and Oils Association,2013,28(6):40 -43
[3]Zimmet P.The burden of type2 diabetes:are we doing enough[J].Diabetes& Metabolism,2003,29(4):6S9 -6S18
[4]施標,孫志敏,白建江,等.“優糖米”對Ⅱ 型糖尿病人餐后血糖的影響[J].中國糧油學報,2014,29(1):1 -5
Shi Biao,Sun Zhimin,Bai Jianjiang,et al.Effects of‘youtang rice’for type 2 diabetics of postprandial blood glucose[J].Journal of the Chinese Cereals and Oils Association,2014,29(1):1 -5
[5]朱慶亞,喻凱,王明奎.厚樸中α-糖苷酶抑制物的篩選及其對糖分吸收的抑制作用[J].華西藥學雜志,2010,25(3):351 -352
Zhu Qingya,Yu Kai,Wang Mingkui.Screening α - glucosidase inhibitor from Magnolia officinalis and research on its inhibition of sugar absorption[J].West China Journal of Pharmaceutical Sciences,2010,25(3):351 -352
[6]Lordan S,Smyth T J,Soler- Vila A,et al.The α - amylase andα-glucosidase inhibitory effects of Irish seaweed extracts[J].Food chemistry,2013,141(3):2170 -2176
[7]回喬,賴瑩,張雨婷,等.山杏仁蛋白誘導Caco-2人結腸癌細胞死亡[J].食品科技,2014,39(5):203 -206.
Hui Qiao,Lai Ying,Zhang Yuting,et al.Caco - 2 human colon carcinoma cell death induced by apricot kernel protein[J].Food Science and Technology,2014,39(5):203 -206
[8]Kamil A,Chen CY O.Health benefits of almonds beyond cholesterol reduction[J].Journal of agricultural and food chemistry,2012,60(27):6694 -6702
[9]Shahidi F,Zhong Y.Bioactive peptides[J].Journal of AOAC International,2008,91(4):914 -931
[10]Lee H J,Lee H S,Choi J W,et al.Novel tripeptides with α-glucosidase inhibitory activity isolated from silk cocoon hydrolysate[J].Journal of agricultural and food chemistry,2011,59(21):11522 -11525
[11]顧欣,李莉,侯雅坤,等.響應面法優化山杏仁蛋白提取工藝研究[J].河北林果研究,2010,25(2):162 -168
Gu Xin,Li Li,Hou Yakun,et al.Optimization of apricot(Armeniaca sibirica)kernel protein via response surface methodology[J].Hebei Journal of Forestry and Orchard Research,2010,25(2):162 -168
[12]Chapdelaine P,Tremblay R R,Dube J Y.P -Nitrophenol-alpha-D-glucopyranoside as substrate for measurement of maltase activity in human semen[J].Clinical chemistry,1978,24(2):208 -211
[13]Adler- Nissen J.Enzymic hydrolysis of food proteins[M].Elsevier Applied Science Publishers,Lond,1986,7:2210 -2230
[14]Hyun CK,Shin H K.Utilization of bovine blood plasma proteins for the production of angiotensin I converting enzyme inhibitory peptides[J].Process Biochemistry,2000,36(1):65-71
[15]魯軍,任迪峰,王建中.螺旋藻源血管緊張素轉化酶抑制肽的純化和鑒定[J].生物化學與生物物理進展,2010,37(5):568 -574
Lu Jun,Ren Difeng,Wang Jianzhong.Purification and characterization of an angiotensinⅠ-converting enzyme inhibitory peptide derived from spirulina platensis[J].Progress in Biochemistry and Biophysics,2010,37(5):568 -574
[16]郭鳳霞,曾陽,李錦萍,等.沙棘多糖對α-葡萄糖苷酶活性及正常小鼠血糖的影響[J].藥學學報,2013,48(4):604-608
Guo Fengxia,Zeng Yang,Li Jinping,et al.Effects of Hippophae rhamnoides L.subsp.chinensis Rousi polysaccharide on alpha-glucosidase enzyme activity and level of blood glucose[J].Acta Pharmaceutica Sinica,2013,48(4):604 -608.
Separation,Purification,and Identification ofα - Glucosidase Inhibitory Peptides from Apricot Kernel Proteins
Gu Xin1,2Cui Jie1,2Li Di3Wang Fengjun1Wang Jianzhong1
(Beijing Key Laboratory of Forest Processing and Safety Beijing Forestry University1,Beijing 100083)
(School of Natural Preservation Area,Beijing Forestry University2,Beijing 100083)
(Hebei Chemical& Pharmaceutical College3,Shijiazhuang 050026)
Apricot kernel proteins was hydrolyzed by Alcalase to solve the problem of high-value utilization of woody oil apricot kernel,using in vitroα -glucosidase inhibiting ability as the evaluation index to screen high-activityα-glucosidase peptide inhibitors.Two kinds of high-activityα-glucosidase peptide inhibitors were isolated and purified from apricot kernel protein hydrolyzates via ultrafiltration,Sephadex G -25,molecular sieve,and reversed phase high-performance liquid chromatography.The inhibition of the AGA inhibitory peptides was 6.6 μg/mL and 7.0 μg/mL,respectively.The molecular structure and sequences of the AGA inhibitory peptides were identified through mass spectrometry and amino acid sequencing.The AGA inhibitory peptides from the apricot kernel hydrolyzate were identified as WA and TW.The median inhibitory concentration of WA was 23.97 μmol/L and that of TW was 22.93 μmol/L.
apricot kernel polypeptides,AGA inhibitory peptides,separation,purification,identification
TS201.2
A
1003-0174(2016)08-0116-06
林業公益性行業科研專項(201004081)
2014-12-05
顧欣,女,1983年出生,博士,生物資源利用與天然產物開發
王建中,男,1952年出生,教授,生物資源利用與天然產物開發

