miRNA-25對人食管鱗狀細胞癌細胞株TE1增殖的影響
miRNA-25對人食管鱗狀細胞癌細胞株TE1增殖的影響
張偉1,2△,周勇慧3,龐一強4
(內蒙古科技大學包頭醫學院1病理教研室,2第一附屬醫院病理科,3第一附屬醫院普外科二病區, 內蒙古 包頭 014010;4包頭市第四醫院神經外科, 內蒙古 包頭 014030)
[摘要]目的: 探討過表達/沉默微小RNA-25(microRNA-25,miRNA-25)對人食管鱗狀細胞癌細胞株TE1增殖能力的影響及其作用機制。方法: RT-PCR檢測各臨床樣品組織中miRNA-25的表達水平。建立miRNA-25過表達/沉默的TE1細胞株,采用CCK-8法、BrdU實驗和流式細胞術檢測TE1細胞增殖能力的變化及細胞周期狀態;Western blot法和RT-PCR法檢測細胞周期調控因子細胞周期蛋白E1(cyclin E1)和細胞周期蛋白依賴性激酶2(CDK2)的蛋白與mRNA表達水平。結果: miRNA-25在食管黏膜組織中具有特異性表達并在TE1細胞中呈高表達。CCK-8法和BrdU實驗結果顯示過表達miRNA-25的TE1細胞的增殖能力顯著增加(P<0.05),而沉默miRNA-25抑制TE1細胞的增殖;流式細胞術檢測結果顯示過表達miRNA-25可明顯促進TE1細胞從G0/G1期向S期轉換,沉默miRNA-25則抑制其轉換。同時Western blot和RT-PCR實驗結果顯示過表達miRNA-25后,cyclin E1和CDK2的蛋白和mRNA表達水平均顯著增加(P<0.05),沉默miRNA-25后則顯著減少(P<0.05)。結論: miRNA-25能夠促進人食管鱗狀細胞癌細胞株TE1的增殖,其作用機制可能與促進細胞周期轉換及上調cyclin E1和CDK2的表達水平有關,提示miRNA-25可作為治療食管鱗狀細胞癌的一個潛在靶點。
[關鍵詞]微小RNA-25; 人食管鱗狀細胞癌細胞株TE1; 細胞增殖; 細胞周期蛋白E1; 細胞周期蛋白依賴性激酶2
[中圖分類號]R363.1+4[文獻標志碼]A
doi:10.3969/j.issn.1000-4718.2015.11.009
Effects of miRNA-25 on proliferation of human esophageal squamous-cell carcinoma cell line TE1ZHANG Wei1,2, ZHOU Yong-hui3, PANG Yi-qiang4
(1DepartmentofPathophysiology,2DepartmentofPathology,FirstAffiliatedHospital,3WardIIofGeneralSurgeryDepartment,FirstAffiliatedHospital,BaotouMedicalCollege,InnerMongoliaUniversityofTechnology,Baotou014010,China;4DepartmentofNeurosurgery,FourthHospitalofBaotou,Baotou014030,China.E-mail:xbkld@163.com)
ABSTRACT[]AIM: To investigate the effects and mechanisms of microRNA-25 (miRNA-25) on the proliferation of human esophageal squamous-cell carcinoma cell line TE1. METHODS: The abundance of miRNA-25 in different tissues was measured by RT-PCR. After silencing or over-expression of miRNA-25 with mimics or inhibitor in TE1 cells, the cell proliferation, cell cycle distribution and the expression of cyclin E1 and cyclin-dependent kinase 2 (CDK2) at mRNA and protein levels were measured by CCK-8 assay, BrdU detection, flow cytometry, RT-PCR and Western blot, respectively. RESULTS: miRNA-25 was prominent in esophageal mucosal tissue and highly expressed in TE1 cells (P<0.05). Over-expression of miRNA-25 increased TE1 cell proliferation, promoted the cell cycle progression and enhanced the entrance of the cells into S phase (P<0.05). Inverse results were obtained after down-regulation of miRNA-25 (P<0.05). Furthermore, the expression of cyclin E1 and CDK2 at mRNA and protein levels was significantly increased after over-expression of miRNA-25, but decreased after down-regulation of miRNA-25 (P<0.05). CONCLUSION: miRNA-25 enhances cell cycle transition by increasing the expression of cyclin E1 and CDK2, thus accelerating TE1 cell proliferation. This study provides a novel mechanism by which miRNA-25 increases the proliferation of human esophageal squamous-cell carcinoma cell line TE1, suggesting that down-regulation of miRNA-25 may be a potential new therapeutic strategy for treating esophageal squamous-cell carcinoma.
[KEY WORDS]MicroRNA-25; Human esophageal squamous-cell carcinoma cell line TE1; Cell proliferation; Cyclin E1; Cyclin-dependent kinase 2
依據全球惡性腫瘤統計資料顯示,食管癌的5年生存率小于15%[1],死亡率排名第4位,是常見的十大惡性腫瘤之一[2]。其發病率具有顯著的人群種族差異。食管癌主要分為食管腺癌(esophageal adenocarcinoma,EA)和食管鱗狀細胞癌(esophageal squamous-cell carcinoma,ESCC),其中鱗狀細胞癌占食管癌的90%以上。食管鱗狀細胞癌的發生尚無確定病因,可能由多種因素綜合作用,主要有吸煙、酗酒、空氣污染、病毒感染等,且發病率呈現逐年增加的趨勢。目前的治療手段主要有手術、放射治療、化學治療以及手術與放射治療結合[3]。
目前已發現約有一萬多種miRNAs,廣泛存在于動物、植物及病毒等不同的細胞和組織中,表達形式各異[4]。近年研究發現microRNA(miRNA)可能作為一種潛在的腫瘤早期診斷指標以及潛在治療靶點。miRNA-25在多種腫瘤組織中存在異常表達。miRNA-25屬于miRNA-106b-25簇,有研究表明該家族成員在人類腦內呈高表達狀態,并在癌癥的發生發展中起重要作用[5]。本研究建立了過表達/沉默miRNA-25的人食管鱗狀細胞癌細胞株TE1,通過CCK-8法、流式細胞術方法檢查癌細胞周期變化,以及Western blot和RT-PCR檢測TE1細胞的周期調控因子細胞周期蛋白E1(cyclin E1)及細胞周期蛋白依賴性激酶2(cyclin-dependent kinase 2, CDK2)的蛋白與mRNA表達的變化,探討miRNA-25表達的變化對食管鱗狀細胞癌發生發展的潛在影響。
材料和方法
1材料與試劑
胎牛血清、RPMI-1640培養基和Opti-NEM培養基購于Gibco;LipofectamineTMRNAiMAX購于Invitrogen;人食管鱗狀細胞癌細胞株TE1購于中國科學院上海細胞庫;cyclin E1和CDK2抗體購于Santa Cruz;BrdU細胞增殖分析試劑盒購于Chemicon;miRNA-25-mimic/inhibitor由上海吉瑪制藥技術有限公司合成;其余試劑均為國產分析純。
2樣本收集
收集內蒙古科技大學包頭醫學院第一附屬醫院2012年8月~2014年2月食管鱗狀細胞癌患者的腫瘤組織及癌旁組織樣本49例,另取正常食管黏膜組織46例、正常鼻咽黏膜組織40例、正常胃黏膜組織38例、正常腸黏膜組織37例和正常卵巢組織29例,樣本年齡均大于18歲。所有組織樣本存放于-80 ℃液氮中保存。所有活體組織經內蒙古科技大學包頭醫學院第一附屬醫院病理專家診斷證實,臨床標本的獲取經倫理委員會同意,患者簽署知情同意書。
3實驗方法
3.1細胞培養、轉染和分組將TE1細胞置于含10%胎牛血清的RPMI-1640培養基中,在37 ℃、5% CO2恒溫培養箱中培養,每隔1~2 d換液1次。細胞消化并種植于24孔培養板中,待細胞融合至40%~50%左右,將處于對數生長期的細胞置于無血清的培養基中,37 ℃、5% CO2恒溫培養箱中培養24 h,隨后進行下一步處理,組別分為空白對照(control,Con)組;陰性對照組(negative control-mimics,NC-m或negative control-inhibitor,NC-i);轉染組(miRNA25-mimics,25-m或miRNA-25-inhibitor,25-i) 。將以上miRNA分別溶解于Opti-MEM培養基中,加入LipofectamineTMRNAiMAX,輕柔混合,室溫靜置20~30 min,形成復合體。將復合體加入細胞培養板中,室溫孵育4 h,轉換為正常細胞培養基培養48 h。
3.2CCK-8法和BrdU法測定細胞增殖水平將各組的TE1細胞以每孔2×103個細胞,加入96孔培養板中,每孔加入Opti-MEM培養基100 μL,繼續培養,分別在24 h、48 h、72 h和96 h加入10 μL CCK-8溶液,置于37 ℃、5% CO2培養箱中孵育1 h。選擇450 nm波長,用酶聯免疫檢測儀測定各孔吸光度值(A)。另設單孔只加入培養基不加入TE1細胞作為空白對照。
將細胞以每孔1 000個接種至96孔板中,培養24 h后加入BrdU,培養24 h,加入100 μL固定液,放置30 min,洗板3次,5% 胎牛血清封閉30 min。加入甲酰胺100 ℃變性5 min,洗滌,加入抗小鼠BrdU單抗,蘇木素襯染,顯微鏡下計數。
3.3流式細胞術檢測細胞周期將對數期的TE1細胞培養于Opti-MEM培養基24 h,消化處理后,800 r/min離心5 min,用PBS漂洗2次,再次800 r/min離心5 min,PBS重懸,加入70%預冷無水乙醇,4 ℃避光過夜。900 r/min離心8 min,PBS洗去乙醇,加入碘化丙啶,避光孵育30 min,記錄流式細胞儀于激發波長488 nm處的熒光強度,重復3次。
3.4TE1細胞中cyclin E1和CDK2的蛋白表達水平測定提取TE1細胞蛋白定量,調整蛋白量。取等量裂解產物,加入4倍體積上樣緩沖液進行SDS-PAGE電泳。電泳后轉移至PVDF膜上,脫脂牛奶室溫封閉2 h,加入 I 抗4 ℃孵育4 h,TBST洗滌3次,每次10 min;再加入相對應 II 抗室溫孵育1 h,TBST洗滌3次,每次10 min,暗室中進行熒光顯色。
3.5RT-PCR檢測取適量食管癌組織、癌旁組織、正常食管黏膜組織、正常鼻咽黏膜組織、正常胃黏膜組織、正常腸黏膜組織、正常卵巢組織和經過相應處理的TE1細胞,按照TRIzol說明書提取總RNA,測定RNA樣品的A280值并定量。以逆轉錄酶催化合成cDNA,并在聚合酶催化下進行PCR擴增。擴增條件為:95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共30個循環;72 ℃ 10 min。擴增樣品在2.0%瓊脂糖凝膠中電泳,以β-actin為內參照,于凝膠成像系統觀察目的基因條帶并進行定量分析。采用Genetool軟件設計的相應引物序列見表1。

表1 RT-PCR的引物序列
F: forward; R: reverse.
4統計學處理
應用SPSS 13.0統計軟件進行統計分析。實驗結果以均數±標準差(mean±SD)表示,多組數據采用單因素方差分析(one-way ANOVA),并用Bonferroni法進行組間均數的兩兩比較,以P<0.05為差異有統計學意義。
結果
1miRNA-25在不同組織中的表達水平
RT-PCR的結果顯示,miRNA-25在正常食管黏膜組織中呈高表達;在正常胃黏膜組織和卵巢組織中低表達;在正常鼻咽黏膜組織和正常腸黏膜組織中幾乎不表達,見圖1。同時,與正常食管黏膜以及癌旁組織相比,miRNA-25在食管癌組織中表達明顯增加,見圖2。以上結果提示,miRNA-25的高表達與食管癌的發生發展有密切關系。
2RT-PCR法檢測miRNA-25-mimic/inhibitor在TE1細胞中的表達效率
通過脂質體轉染miRNA25-mimic/inhibitor至TE1細胞,采用RT-PCR檢測miRNA-25表達水平的變化,結果顯示轉染了miRNA25-mimic后,TE1細胞的miRNA-25水平顯著升高;而轉染了miRNA-25 inhibitor后,TE1細胞的miRNA-25水平則顯著降低,與空白對照組相比均有顯著差異(P<0.05),見圖3。
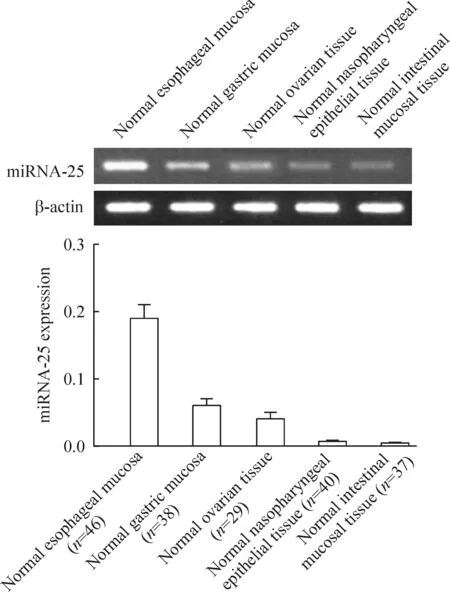
Figure 1.The expression of miRNA-25 in different normal tissues. Mean±SD.
圖1食管、胃、卵巢、鼻和腸道正常粘膜組織中miRNA-25的表達水平
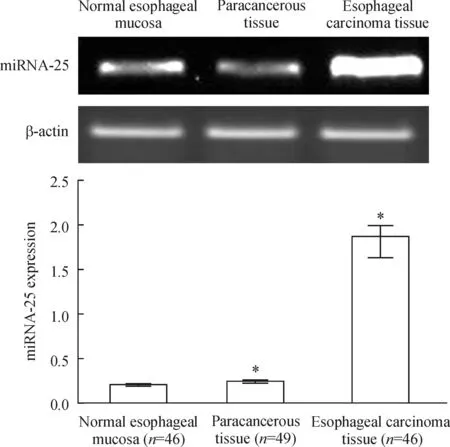
Figure 2.The expression levels of miRNA-25 in normal, paracancerous and cancerous esophageal tissues. Mean±SD.*P<0.05vsnormal esophageal mucosa.
圖2正常食管黏膜組織、癌旁組織和食管癌組織中miRNA-25的表達水平
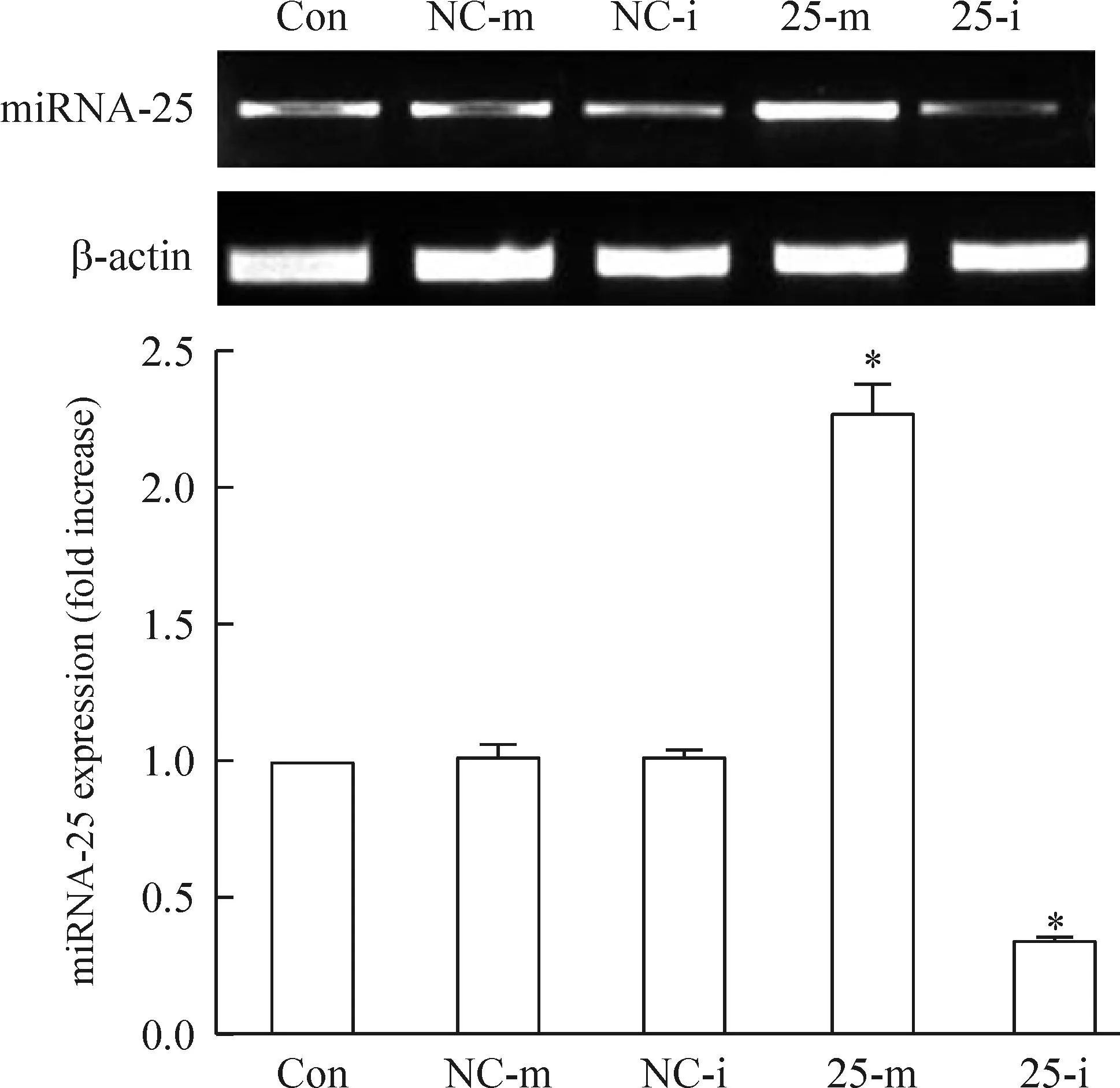
Figure 3.The expression levels of miRNA-25 in the TE1 cell after over-expression/down-regulation of miRNA-25. Mean±SD.n=6.*P<0.05vsCon.
圖3TE1細胞轉染后miRNA-25的表達水平
3CCK-8法和BrdU實驗測定TE1細胞的增殖水平
采用CCK-8法,在miRNA-25-mimic/inhibitor轉染TE1細胞后,分別于24 h、48 h、72 h和96 h時檢測細胞活力,結果發現過表達miRNA-25后,TE1的細胞活力顯著高于空白對照組(P<0.05),而沉默miRNA-25后,TE1的細胞活力顯著低于空白對照組(P<0.05);而NC-m、NC-i與空白對照組間的差異不顯著,見表2。
BrdU實驗結果表明,過表達miRNA-25后,DNA合成顯著高于空白對照組;而沉默miRNA-25后,結果相反;而NC-m、NC-i與空白對照組間的差異不顯著,見圖4。
4流式細胞術檢測細胞周期
應用流式細胞術分析過表達/沉默miRNA-25后TE1細胞周期的變化。結果顯示,過表達miRNA-25后,G0/G1期的細胞數占百分比為減少至(46.52±5.08)%,S期細胞數所占百分比增加至(43.96±4.67)%,而沉默miRNA-25后,G0/G1期的細胞數占百分比為增加至(84.52±4.78)%,S期細胞數所占百分比減少至(6.05±2.64)%,說明過表達miRNA-25促進TE1細胞周期從G0/G1期向S期轉換,而沉默miRNA-25則抑制其轉換,見圖5。
5Cyclin E1和CDK2的蛋白表達水平
收集成功轉染miRNA-25-mimic/inhibitor的TE1細胞,提取蛋白,通過Western blot檢測TE1細胞中cyclin E1 和CDK2的蛋白表達水平。結果顯示,相對于未轉染的TE1細胞,過表達miRNA-25后cyclin E1和CDK2的蛋白表達水平顯著增加(P<0.05),而沉默miRNA-25后,則顯著降低二者的蛋白表達水平(P<0.05),見圖6。
表2miRNA-25對TE1細胞活力的影響
Table 2.The effect of miRNA-25 on the viabiliy of the TE1 cells transfected with miRNA-25-mimic/inhibitor determined by CCK-8 assay (%. Mean±SD.n=6)
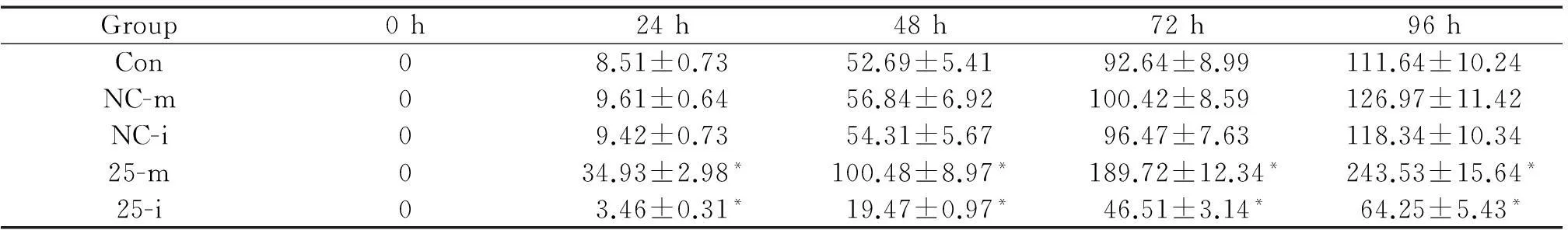
Group0h24h48h72h96hCon08.51±0.7352.69±5.4192.64±8.99111.64±10.24NC-m09.61±0.6456.84±6.92100.42±8.59126.97±11.42NC-i09.42±0.7354.31±5.6796.47±7.63118.34±10.3425-m034.93±2.98*100.48±8.97*189.72±12.34*243.53±15.64*25-i03.46±0.31*19.47±0.97*46.51±3.14*64.25±5.43*
*P<0.05vsCon.
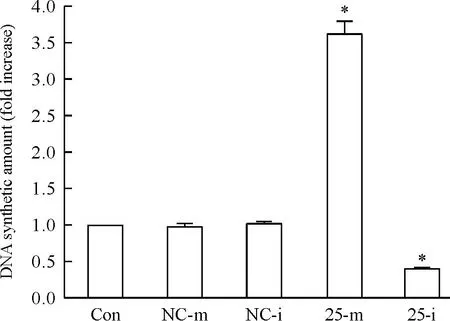
Figure 4.The quantitative analysis of DNA synthesis in the TE1 cells transfected with miRNA-25-mimic/inhibitor determined by BrdU assay. Mean±SD.n=6.*P<0.05vsCon.
圖4各組TE1細胞的DNA合成量比較
6Cyclin E1和CDK2的mRNA表達水平
采用RT-PCR測定TE1細胞轉染miRNA25-mimic/inhibitor后,cyclin E1和CDK2的mRNA表達水平。結果顯示,過表達miRNA-25后,cyclin E1和CDK2的mRNA表達水平顯著增加,而沉默miRNA-25后,兩者的表達降低,兩者與空白對照組相比均具有顯著差異(P<0.05),見圖7。
討論
食管癌是一種人類常見的消化道惡性腫瘤,在我國,食管癌主要表現為食管鱗狀細胞癌。以太行山周邊的河北、河南,以及廣東的部分地區為高發地區[6]。本實驗通過對食管鱗狀細胞癌患者的臨床樣本進行分析,發現癌變組織中miRNA-25的表達水平顯著高于癌旁組織和正常食管黏膜組織,表明miRNA-25在食管鱗狀細胞癌中呈高表達。再者,通過對臨床收集的正常食管黏膜組織、正常鼻咽黏膜組織、正常胃黏膜組織、正常腸黏膜組織、正常卵巢組織樣本檢測發現,正常食管黏膜組織中的miRNA-25的表達高于實驗中的其他組織,正常鼻炎黏膜組織和正常腸黏膜組織中幾乎不表達,提示miRNA-25在食管組織中具有特異性的表達,可作為治療食管鱗狀細胞癌的一個潛在靶點。
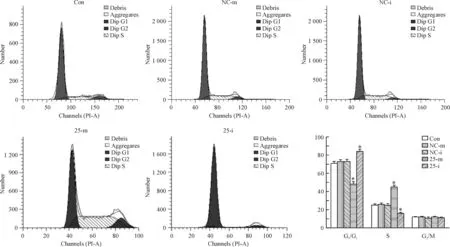
Figure 5.The cell cycle of the TE1 cells transfected with miRNA-25-mimic/inhibitor analyzed by flow cytometry. Mean±SD.n=6.*P<0.05vsCon.
圖5TE1細胞的細胞周期變化
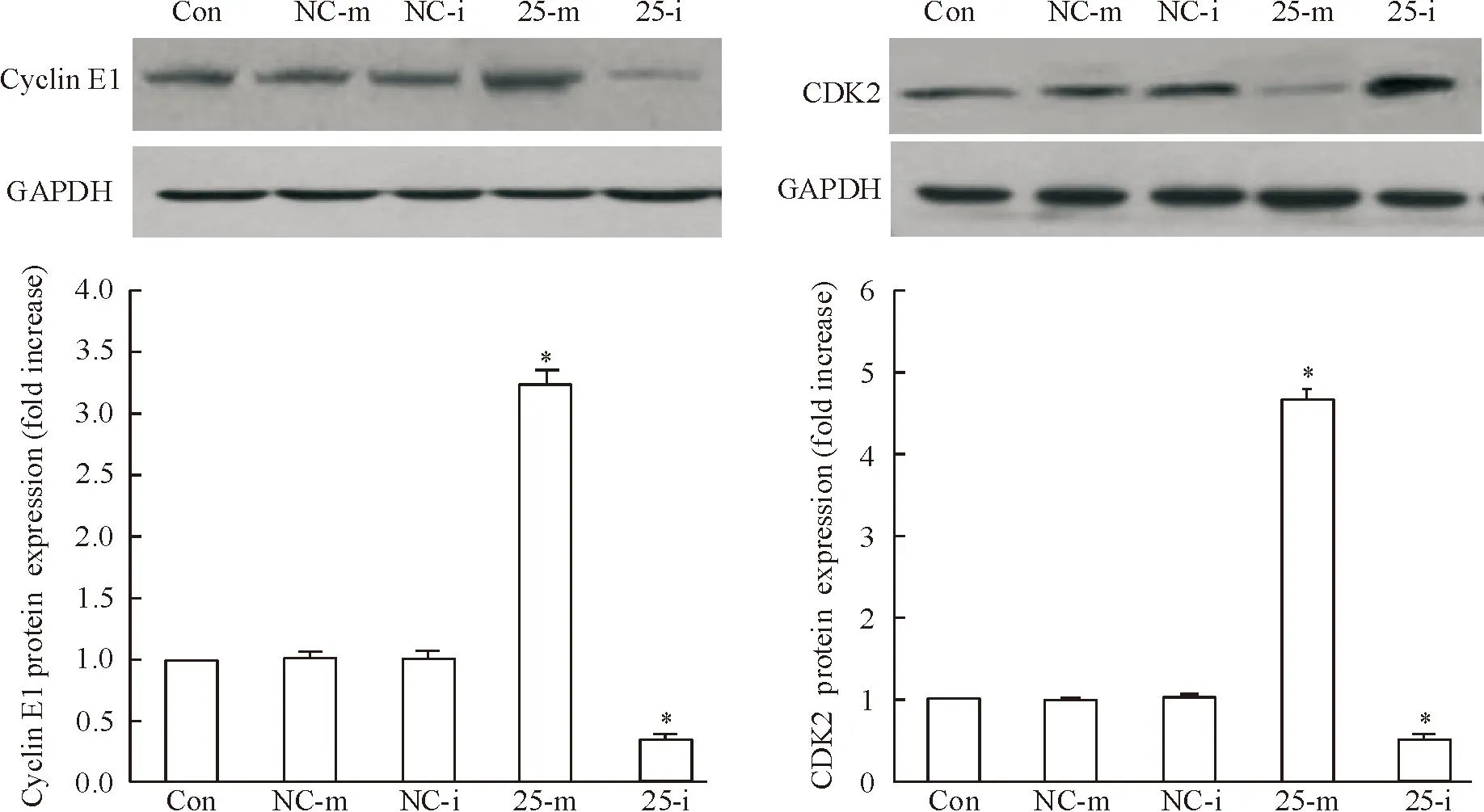
Figure 6.The protein expression of cyclin E1 and CDK2 in the TE1 cells transfected with miRNA-25-mimic/inhibitor. Mean±SD.n=6.*P<0.05vsCon.
圖6Cyclin E1和CDK2的蛋白表達水平
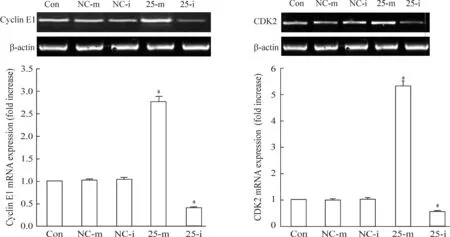
Figure 7.The mRNA expression of cyclin E1 and CDK2 in the TE1 cells transfected with miRNA-25-mimic/inhibitor. Mean±SD.n=6.*P<0.05vsCon.
圖7Cyclin E1和CDK2的mRNA表達水平
miRNA是一類內源性非編碼單鏈小分子RNA,通過與特定的mRNA分子的3’非翻譯區(3’UTR)相作用,從而調節相應蛋白翻譯的過程來調控基因表達。在不同的組織器官中,miRNAs的表達具有明顯差異,提示miRNA可能參與調控基因的轉錄及表達[7-8]。本實驗建立過表達/沉默miRNA-25的人食管鱗狀細胞細胞株TE1,采用CCK-8法和BrdU實驗檢測轉染miRNA-25-mimics/inhibitor后TE1細胞的增殖情況,隨著時間的延長,發現過表達miRNA-25的TE1細胞增殖率隨時間增加而明顯增加,顯著高于空白對照組,沉默miRNA-25的TE1細胞增殖率雖然隨時間增加而增加,但顯著低于空白對照組,表明過表達miRNA-25使得TE1細胞的增殖加快,可能與食管鱗狀細胞癌的發展有一定的相關性。
細胞增殖周期由cyclin、CDK和CDK抑制因子(CDK inhibitor,CKI)共同調節。細胞的分裂與分化主要發生在G1期,cyclin E1在細胞分裂G1期轉換至S期的過程中作為調控因子[9],當細胞受到生長信號刺激時,產生視網膜母細胞瘤基因蛋白(pRb)磷酸化,釋放出核轉錄因子E2F,促使細胞完成DNA復制[10],從而促進細胞增殖[11]。而在國內外多項臨床試驗中也發現在多種腫瘤中長檢測到cyclin E1蛋白過表達以及基因擴增[12-13]。李麗等[14]研究在食管上皮癌變過程中細胞周期調控因子的表達時,發現cyclin E1和CDK2的蛋白和mRNA陽性表達率逐漸上升。本實驗采用免疫印跡法和RT-PCR檢測轉染miRNA-25-mimics/inhibitor TE1細胞后,細胞周期調控因子cyclin E1和CDK2的蛋白和mRNA表達水平,并采用流式細胞術檢測轉染后TE1細胞的細胞周期,結果顯示,過表達miRNA-25后,TE1細胞中cyclin E1和CDK2的蛋白和mRNA表達水平均顯著增加,G0/G1期細胞數所占百分比明顯減少,S期細胞數所占百分比明顯增加,提示過表達miRNA-25可加快TE1細胞的增殖;而沉默miRNA-25后,TE1細胞中cyclin E1和CDK2的蛋白和mRNA表達水平均顯著降低;G0/G1期細胞數所占百分比明顯增加,S期細胞數所占百分比明顯減少,提示沉默miRNA-25可減緩TE1細胞的增殖。TE1細胞增殖的加速,可引起食管鱗狀細胞癌的迅速惡化,擴散和轉移,提示miRNA-25的高表達可能與食管鱗狀細胞癌的發生有關,可能促進腫瘤細胞的過度增殖,最終產生惡化遷移。但其確切機制還需進一步深入的研究。
[參考文獻]
[1]赫捷,邵康. 中國食管癌流行病學現狀、診療現狀及未來對策[J]. 中國癌癥雜志, 2011, 21(7):501-504.
[2]Wani S, Sharma P. Challenges with endoscopic therapy for Barrett’s esophagus [J]. Gastroenterol Clin North Am, 2015, 44(2):355-372.
[3]鄭嬌嬌,吳清明,陳建華,等. P162對食管癌細胞株Eca109的放射增敏作用及其對p75NTR表達的影響[J]. 中國病理生理雜志,2013, 29(1):103-107.
[4]Fitzpatrick JM, Anderson RC, McDermott KW. MicroRNA: key regulators of oligodendrocyte development and pathobiology[J]. Int J Biochem Cell Biol, 2015, 65: 134-138.
[5]Ventura A, Young AG, Winslow MM, et al. Targeted deletion reveals essential and overlapping functions of the miR-17~92 family of miRNA clusters[J]. Cell, 2008, 132(5):875-886.
[6]Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69-90.
[7]Chen S, Zhang Y, Kuzel TM, et al. Regulating tumor myeloid-derived suppressor cells by microRNAs[J]. Cancer Cell Microenviron, 2015, 2: e637.
[8]Rigoutsos I. New tricks for animal microRNAs: targeting of amino acid coding regions at conserved and nonconser-ved sites[J].Cancer Res, 2009, 69(8):3245-3248.
[9]張彩蘋,杜永成,許建英,等.細胞周期蛋白E在哮喘大鼠肺組織中的表達及其與氣道重塑的關系[J].中國病理生理雜志,2010, 26(5):853-837.
[10]Rosenberg E, Demopoulos RI, Zeleniuch-Jacquotte A, et al. Expression of cell cycle regulators p57KIP2, cyclin D1, and cyclin E in epithelial ovarian tumors and survival[J]. Hum Pathol, 2001,32(8):808-813.
[11]Martinsson HS, Starborg M, Erlandsson F, et al. Single cell analysis of G1check points: the relationship between the restriction point and phosphorylation of pRb[J]. Exp Cell Res, 2005, 305(2):383-391.
[12]Zhao LW, Zhong XH, Yang SY, et al. Inotodiol inhibits proliferation and induces apoptosis through modulating expression of cyclinE, p27, bcl-2, and bax in human cervical cancer HeLa cells[J]. Asian Pac J Cancer Prev,2014, 15(7):3195-3199.
[13]Dai L, Liu Y, Liu J, et al. A novel cyclinE/cyclinA-CDK inhibitor targets p27Kip1degradation, cell cycle progression and cell survival: implications in cancer therapy[J]. Cancer Lett, 2013, 333(1):103-112.
[14]李麗,齊鳳英,左連富,等. Cyclin E、CDK2和p21WAF1在食管上皮癌變過程中的表達及意義[J].腫瘤,2005, 25(2):158-162.
(責任編輯:盧萍, 羅森)


