惡性卵巢上皮性腫瘤組織中miR-181a、TGF-β1、TGF-βR1的表達變化及意義
惡性卵巢上皮性腫瘤組織中miR-181a、TGF-β1、TGF-βR1的表達變化及意義
李紅雨,韓會會,朱海,郭歡歡,曹蒙,劉星爍,張敏
(鄭州大學第三附屬醫院,鄭州450052)
摘要:目的觀察惡性卵巢上皮性腫瘤組織中miR-181a、TGF-β1、TGF-βR1的表達變化,并探討其意義。方法良性卵巢上皮性腫瘤26例(良性組)、惡性卵巢上皮性腫瘤59例(惡性組)及子宮良性腫瘤28例(對照組)。用qRT-PCR 法檢測各組卵巢組織中的miR-181a、TGF-β1 mRNA、TGF-βR1 mRNA;用免疫組化SP法檢測各組卵巢組織中的TGF-β1蛋白和TGF-βR1蛋白。結果惡性組的miR-181a、TGF-β1 mRNA、TGF-βR1 mRNA相對表達量與良性組、對照組相比,P均<0.05。惡性組TGF-β1蛋白、TGF-βR1蛋白的陽性表達率與良性組及對照組相比,P均<0.05。miR-181a、TGF-β1 mRNA、TGF-βR1 mRNA相對表達量及TGF-β1蛋白、TGF-βR1蛋白表達與惡性卵巢上皮性腫瘤的臨床分期、組織學分級、淋巴結轉移有關(P均<0.05)。惡性組miR-181a與TGF-β1 mRNA的表達水平呈正相關(r=0.810,P<0.05)、與TGF-βR1 mRNA的表達水平呈負相關(r=-0.769,P<0.05),TGF-β1 mRNA與TGF-βR1 mRNA的表達水平呈負相關(r=-0.837,P<0.05)。結論 惡性卵巢上皮性腫瘤組織中miR-181a、TGF-β1高表達,而TGF-βR1低表達,三者的表達有相關關系,可能共同參與了惡性卵巢上皮性腫瘤的發生發展、侵襲轉移過程。
關鍵詞:卵巢腫瘤;惡性卵巢上皮性腫瘤;小分子單鏈RNA;轉化生長因子;轉化生長因子受體
doi:10.3969/j.issn.1002-266X.2015.43.022
中圖分類號:R737.31文獻標志碼:B
基金項目:2013年度河南省鄭州市工程技術研究中心(重點實驗室)科研課題。
收稿日期:(2015-06-22)
通信作者:李紅雨
miRNA是一類全長約22 nt的非編碼小分子單鏈RNA,在卵巢癌的侵襲、轉移中可能發揮著重要作用[1]。研究[2]證實,miR-181a在一些惡性腫瘤中表達升高,而在一些惡性腫瘤中表達下調,這種改變與TGF-β家族的功能密切相關[3],該家族的分泌紊亂及其傳導通路的中斷與腫瘤的發生發展關系密切[4]。TGF-β1、TGFβR1是TGF-β家族的重要成員,同時是miR-181a的靶基因[5]。本研究對惡性卵巢上皮性腫瘤組織中miR-181a、TGF-β1、TGF-βR1的表達及三者間的表達關系進行了觀察,探討其在惡性卵巢上皮性腫瘤發生發展、侵襲轉移過程中可能發揮的作用。
1資料與方法
1.1臨床資料2010年3月~2014年9月于鄭州大學第三附屬醫院和鄭州大學第一附屬醫院接受手術治療的原發性卵巢上皮性腫瘤患者85例(年齡17~76歲)。術前未接受化療、放療等治療,術后病理檢查證實為良性卵巢上皮性腫瘤26例(良性組)、惡性卵巢上皮性腫瘤59例(惡性組)。惡性組按FIGO(2000年)分期標準分為Ⅰ、Ⅱ期14例,Ⅲ、Ⅳ期45例;低分化29例,高、中分化30例;漿液性囊腺癌37例,黏液性囊腺癌12例,子宮內膜樣癌10例;有淋巴結轉移35例,無淋巴結轉移24例。接受手術治療的子宮良性腫瘤患者28例(對照組)三組術中均留取適量卵巢組織并分為兩份,一份立即置液氮中速凍后-80 ℃冰箱保存,用于qRT-PCR檢測;一份用10%甲醛溶液固定,石蠟包埋,4 μm厚切片,用于免疫組化檢測。
1.2主要試劑及儀器TRIzol試劑盒、逆轉錄試劑盒及SYBR Master Mix購自Tiangen公司;免疫組化SP試劑盒及DAB顯色試劑盒購自北京博奧森公司;兔抗人TGF-β1多克隆抗體和兔抗人TGF-βR1多克隆抗體購自武漢三鷹生物技術公司。生物分光光度儀為德國Eppendorf公司產品,qRT-PCR儀為美國ABI公司產品。引物由南京金斯瑞生物有限公司合成。引物序列:miR-181a上游引物為5′-CT-CAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGA-CTCAC-3′、下游引物為5′-ACACTCCAGCTGGGAAC-ATTCAACGCTGTCG-3′;U6上游引物為5′-CTCGCT-TCGGCAGCACA-3′、下游引物為5′-AACGCTTCACG-AATTTGCGT-3′;TGF-β1上游引物為5′-CTAGTCTA-GAATGCCGCCCTCCGGGC-3′、下游引物為5′-AAGG-AAAAAAGCGGCCGCTCAGCTGCACTTGCAGGAGC-G-3′;TGF-βR1上游引物為5′-ACCTTCTGATCCATCCGTT-3′、下游引物為5′-CGCAAAGCTGTCAGCCTAG-3′;GAPDH上游引物為5′-CGCTGAGTACGTCGTGGAGT-3′、下游引物為5′-GTCGCTGTTGAAGTCAGAGGAG-3′。
1.3miR-181a、TGF-β1mRNA、TGF-βR1 mRNA的檢測采用qRT-PCR法。①RNA提取、檢測:取適量卵巢組織,提取總RNA,紫外分光光度計測定總RNA純度及濃度。②逆轉錄、擴增:逆轉錄反應體系為10 μL。取3 μL總RNA,按逆轉錄試劑盒說明書逆轉錄成cDNA。逆轉錄反應條件為37 ℃孵育60 min。PCR反應:取cDNA 1 μL,總反應體系為20 μL;反應條件為95 ℃ 15 min,95 ℃ 10 s,60 ℃ 60 s,共40個循環。用U6或GAPDH作內參。所有標本設立3個復孔,記錄每個PCR反應管中標本的Ct值,以2-ΔΔCT代表目的基因的相對表達量。
1.4TGF-β1蛋白和TGFβR1蛋白的檢測采用免疫組化SP法。將石蠟包埋卵巢組織標本的切片脫蠟水化,嚴格按SP免疫組化試劑盒說明書進行操作。用PBS代替一抗作陰性對照,已知陽性組織切片作陽性對照。顯微鏡下觀察染色切片,細胞呈棕黃色顆粒狀或片狀者為陽性。在高倍鏡下(400×)隨機選取5個視野(每個視野觀察不少于100個細胞),按細胞著色強度及陽性細胞所占百分比進行結果判定[11]:細胞無著色為0分、淡黃色為1分、棕黃色為2分、棕褐色為3分;無陽性細胞為0分,陽性細胞百分比0~25%為1分、~50%為2分、~75%為3分、~100%為4分;上述兩項評分的乘積0~1為陰性(-)、2~4為弱陽性(+)、5~8為中度陽性(++)、9~12為強陽性(+++),+、++、+++均為陽性。
1.5統計學方法采用SPSS17.0統計軟件。計量資料比較用單因素方差分析,計數資料比較用χ2檢驗和Fisher精確概率法,相關性分析用Pearson相關分析法。P<0.05為差異有統計學意義。
2結果
2.1各組miR-181a、TGF-β1mRNA、TGF-βR1mRNA的表達比較各組miR-181a、TGF-β1mRNA、TGF-βR1 mRNA的檢測結果見表1。
2.2各組TGF-β1蛋白和TGF-βR1蛋白的表達比較惡性組TGF-β1蛋白、TGF-βR1蛋白的陽性表達率分別為69.5%(41/59)、23.7%(14/59),良性組分別為15.4%(4/26)、73.1%(19/26),對照組分別為35.7%(10/28)、57.1%(16/28);惡性組與良性組及對照組相比,P均<0.05;良性組與對照組相比,P均>0.05。
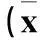
表1 各組miR-181a、TGF-β 1 mRNA、TGF-βR1 mRNA的
注:與良性組、對照組相比,*P<0.05。
2.3miR-181a、TGF-β1、TGF-βR1表達與惡性卵巢上皮性腫瘤臨床病理參數的關系miR-181a、TGF-β1 mRNA、TGF-βR1 mRNA相對表達量及TGF-β1蛋白、TGF-βR1蛋白表達與惡性卵巢上皮性腫瘤的臨床分期、組織學分級、淋巴結轉移有關(P均<0.05),而與組織類型、患者年齡無關(P均>0.05),見表2、3。
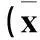
表2 miR-181a、TGF-β 1 mRNA、TGF-βR1 mRNA表達與
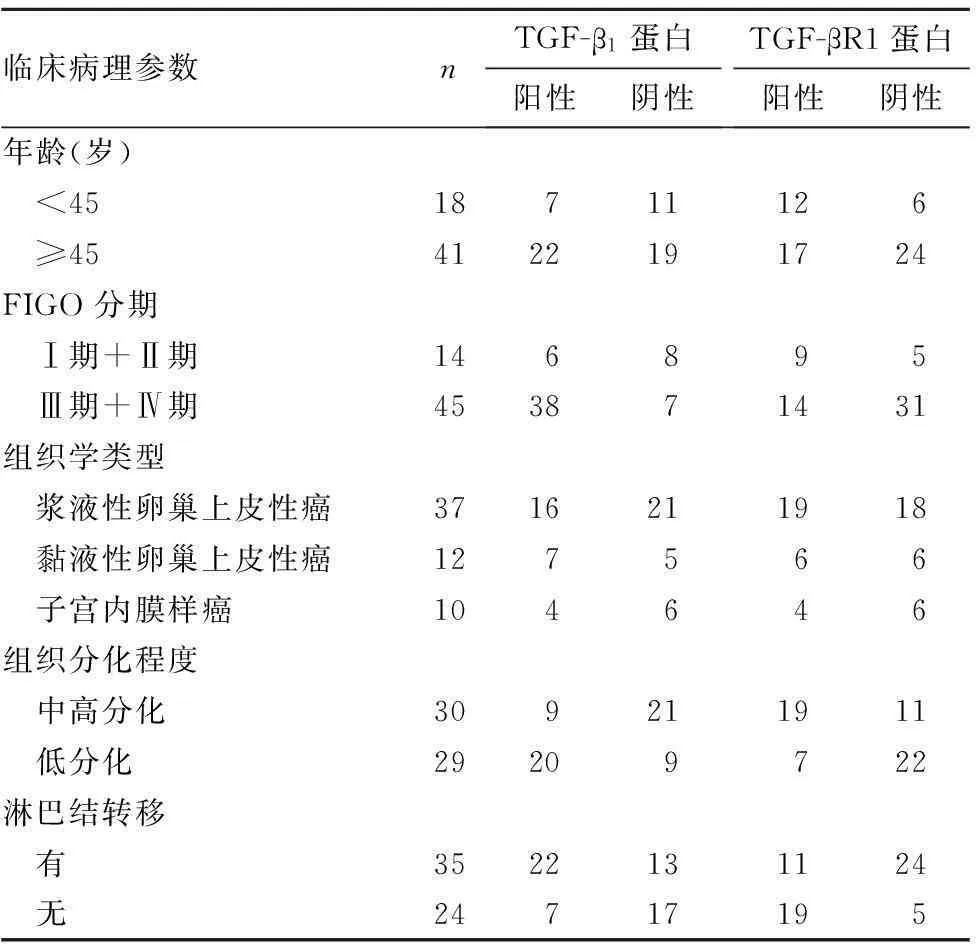
表3 TGF-β 1蛋白、TGF-βR1蛋白表達與惡性卵巢上皮性
2.4惡性卵巢上皮性腫瘤組織miR-181a、TGF-β1mRNA、TGF-βR1 mRNA表達的相關性miR-181a與TGF-β1mRNA的表達水平呈正相關(r=0.810,P<0.05)、與TGF-βR1 mRNA的表達水平呈負相關(r=-0.769,P<0.05);TGF-β1mRNA與TGF-βR1 mRNA的表達水平呈負相關(r=-0.837,P<0.05)。
3討論
miRNA是一類在動植物中廣泛存在、不編碼蛋白質的單鏈小RNA,長度一般為21~25 nt。腫瘤細胞與正常組織細胞的miRNA,表達譜存在明顯差異。有研究[4]發現,惡性卵巢上皮性腫瘤中miR-200a、miR-141高表達,而miR-199a、miR-140低表達。miR-181a長度為22 nt,定位于人9號染色體。研究[2]發現,miR-181a與多種腫瘤的發生發展密切相關,如胃癌、乳腺癌、宮頸癌等。本研究結果顯示,miR-181a在惡性卵巢上皮性腫瘤組織中的表達明顯高于正常卵巢上皮組織和良性卵巢上皮性腫瘤組織,提示miR-181a高表達可能參與了惡性卵巢上皮性腫瘤的發生。miR-181a的表達量與惡性卵巢上皮性腫瘤的臨床分期、組織學分級及淋巴結轉移明顯相關,提示miR-181a可能也參與了惡性卵巢上皮性腫瘤的侵襲轉移過程。
TGF-β是一類結構和功能密切相關的活性多肽家族,TGF-β1是miR-181a的靶基因,廣泛參與細胞的分化、增殖、形態改變、黏附、轉移、細胞外基質產生及凋亡等[5~8]。TGF-βR1是TGF-β家族的另一成員,是TGF-β1最重要的受體,其對TGF-β1信號轉導極為重要,缺失TGF-βR1的突變細胞對TGF-β1無反應[9]。在胰腺癌組織中TGF-β1表達上調,TGF-βR1表達降低,TGF-βR1表達降低是可能腫瘤細胞對TGF-β1反應性減弱的原因之一[9]。Grau等[10]報道,胰腺癌細胞存在TGF-β受體表達異常,主要為TGF-βR1基因表達異常,TGF-βR1的低表達可能為胰腺癌逃脫TGF-β負性生長調控的機制之一。本研究結果顯示,TGF-β1在惡性卵巢上皮性腫瘤組織中的表達明顯高于正常卵巢上皮組織和良性惡性卵巢上皮性腫瘤組織,且TGF-β1的表達與惡性卵巢上皮性腫瘤臨床分期、組織學分級及淋巴結轉移明顯相關,提示TGF-β1高表達可能參與了惡性卵巢上皮性腫瘤的發生和發展。而TGF-βR1在惡性卵巢上皮性腫瘤組織中的表達明顯低于正常卵巢上皮組織和良性卵巢上皮性腫瘤腫瘤組織,提示TGF-βR1的低表達可能為惡性卵巢上皮性腫瘤逃脫TGF-β負性生長調控的機制之一。
本研究還發現,惡性卵巢上皮性腫瘤組織中miR-181a與TGF-β1mRNA的表達呈正相關、與TGF-βR1 mRNA的表達呈負相關,TGF-β1mRNA與TGF-βR1 mRNA的表達呈負相關。據此推測miR-181a和TGF-β1mRNA表達的上調以及TGF-βR1 mRNA表達的降低可能起協同作用,三者共同參與惡性卵巢上皮性腫瘤的發生發展、侵襲及轉移過程[11]。
參考文獻:
[1] Fabian MR, Sonenberg N, Filipowicz W, et al. Regulation of mRNA translation and stability by microRNAs[J]. Annu Rev Biochem, 2010,79(1):351-356.
[2] Yao YH, Liao AJ, Chen J, et al.Expression of miR-181a and miR-181b in human gastric cancer cells and tissues[J]. WCJD, 2015,23(1):30-36.
[3] Tian Q, Huang SL, Liu HS, et al. The study on expression of miR-181a inducted by TGF-β and its function on HCC metastasis [J]. Gynecol Oncol, 2012,112(1):55-59.
[4] Iorio MV, Visone R, Di Leva G, et al. MicroRNA signatures in human ovarain cancer[J]. Cancer Res, 2007,67(18):8699-8707.
[5] Xie JJ, Xu LY, Wu ZY, et al. Prognostic implication of ezrin expres-sion in esophageal squamous cell carcinoma[J]. J Surg Oncol, 2011,104(5):538-543.
[6] Guo LJ,Zhang QY. Decreased serum miR-181a is a potential new tool for breast cancer screening[J]. Int J Mol Med, 2012,30(3):680-685.
[7] Yong QW,Li YM,Hong HX,et al.Hypermethylation of TGF-β1gene promoter in gastric cancer[J].World J Gastroenterl, 2013,4(33):5557-5564.
[8] Corduk N,Abban G, Yildirim B, et al. The Effect of Vitamin D on Expression of TGF-β1in Ovary[J]. Exp Clin Endocrinol, 2012,8(120):490-493.
[9] Zhang L, Yuan SZ. Expressions of tumor growth factor β1 and its receptor in patients with pancreatic cancer[J]. Hepatobilary Pancreat Dis Int, 2002,1(4):620-623.
[10] Grau AM, Zhang I, Wang W, et al. Induction of p21 wafl expression and growlh inhibition by transforming growth factor beta involve the tumor suppressor gene DPC4 in human pancreatic adenocarcinoma cells[J]. Cancer Res, 1997,8(57):3929-3934.
[11] Lou YH, Yang XS, Wang FL, et al. Expression of microRNA-21 in ouarian epithelial carcinoma and its clinical significance[J]. JSMU, 2010,30(3):608-610.

