QuEChERS樣品前處理方法聯合在線GPC/GC-MS測定水果中15種三唑類農藥殘留量方法評估
李海飛,聶繼云,徐國鋒,李 靜,閆 震,李志霞,毋永龍,匡立學
(中國農業科學院果樹研究所,農業部果品質量安全風險評估實驗室(興城),農業部果品及
苗木質量監督檢驗測試中心(興城),遼寧 興城 125100)
?
QuEChERS樣品前處理方法聯合在線GPC/GC-MS測定水果中15種三唑類農藥殘留量方法評估
李海飛,聶繼云*,徐國鋒,李靜,閆震,李志霞,毋永龍,匡立學
(中國農業科學院果樹研究所,農業部果品質量安全風險評估實驗室(興城),農業部果品及
苗木質量監督檢驗測試中心(興城),遼寧興城125100)
摘要:比較了3種QuEChERS方法(未加緩沖鹽的原創QuEChERS方法、加乙酸鹽的AOAC 2007.01方法以及加檸檬酸緩沖鹽的CEN 15662方法)提取水果中15種三唑類農藥的有效性,考察了乙二胺-N-丙基硅烷(PSA)和C18吸附劑的凈化效果,以提取后添加法評估了蘋果、梨、桃、葡萄、櫻桃、香蕉及橙子中各目標化合物的基質效應。結果表明,3種QuEChERS方法的回收率無明顯差異,但原創QuEChERS方法操作簡單、成本較低,且有較好的回收率和較低的基質效應。聯合使用PSA和C18吸附劑的凈化效果優于單獨使用PSA或C18的凈化效果。15種三唑類農藥在7種基質中均存在基質增強效應。采用原創QuEChERS方法結合在線凝膠滲透色譜串聯氣相色譜-質譜(GPC/GC-MS),實現了在線凈化與分析檢測的自動化,縮短了分析時間,彌補了原創QuEChERS方法去除干擾不徹底的缺陷,同時利用PTV大體積進樣和進樣口程序升溫方式提高了檢測靈敏度。15種農藥在7種基質3個加標水平(20,50,100 μg/kg)下的平均回收率為85.7%~120.1%,相對標準偏差(RSD)為0.2%~11.5%,在10~400 μg/L 范圍內線性關系良好,相關系數(r)大于0.998;檢出限為0.9~9.5 μg/kg。該方法簡便快速、準確可靠、經濟環保,適用于水果中三唑類農藥多殘留的快速檢測。
關鍵詞:QuEChERS;在線凝膠滲透色譜串聯氣相色譜-質譜;三唑類農藥殘留;基質效應;水果
三唑類農藥屬于有機雜環類化合物,種類很多,可作為殺菌劑、殺蟲劑和植物生長調節劑,因其作用機制獨特且藥效滿意,并具有廣譜、內吸、低毒等優良特性,在應用方面越來越受到人們的重視[1]。目前三唑類農藥在水果的種植過程中被廣泛應用且施用量逐漸加大,由其引發的殘留問題也日益受到關注。為了保證消費者安全,許多發達國家及國際組織對不同水果中三唑類農藥殘留進行了嚴格限量,最大殘留限量為0.01 mg/kg[2-3]。
樣品前處理是農藥殘留分析過程最為關鍵和耗時的環節,在很大程度上決定了分析結果的準確性,并且高效的前處理技術還能大大減少分析成本和時間。QuEChERS方法最早由Anastassiades等[4]于2003年提出,因其在水果蔬菜農藥殘留分析中具有快速、簡單、便宜、有效、可靠和安全等優勢,已在世界很多國家和地區得到驗證和推廣[5-7],并改進形成了AOAC 2007.01、CEN 15662和NY/T 1380-2007標準方法。目前對水果中三唑類農藥殘留的測定已有報道[1,8-9],但采用QuEChERS前處理方法提取水果中三唑類農藥殘留的報道較少[10-13]。
QuEChERS方法采用分散固相萃取凈化,在應用氣相色譜-質譜檢測時往往因出現襯管和柱前端嚴重污染而導致色譜峰丟失或拖尾、背景高、基質效應嚴重,從而影響了一些農藥的定性和定量檢測[6]。近年來,在線凝膠滲透色譜/氣相色譜-質譜(GPC/GC-MS)已應用于復雜基質中農藥殘留的分析[5,13-15],在線GPC/GC-MS系統中GPC可有效去除樣品基質中可能干擾目標化合物檢測的大分子量的油脂、色素等組分,從而降低背景和改善峰形,減少基質效應,彌補了QuEChERS方法去除干擾不徹底的缺陷。同時采取樣品在線處理、大體積進樣和氣相色譜進樣口的程序升溫方式提高了檢測靈敏度和選擇性,縮短了分析時間,減少了溶劑用量,降低了有機試劑對分析者和環境的危害。目前采用QuEChERS前處理方法聯合在線GPC/GC-MS對水果中多種三唑類農藥殘留進行測定的研究尚未見報道。
本研究以果樹生產中常用的三唑酮、烯效唑、戊唑醇等14種三唑類農藥以及中華人民共和國農業部公告第199號中規定的在果樹上不得使用的氯唑磷農藥為目標物,比較了3種QuEChERS樣品前處理方法(即未加入緩沖鹽的原創QuEChERS方法[4]、加入乙酸鹽緩沖鹽的AOAC 2007.01方法[16]以及加入檸檬酸緩沖鹽的CEN 15662方法[17])提取水果中15種三唑類農藥的有效性,考察了乙二胺-N-丙基硅烷(PSA)及C18吸附劑對15種三唑類農藥的凈化效果,以及目標化合物在不同水果中的基質效應。通過原創QuEChERS前處理方法結合GPC/GC-MS檢測方法,實現了在線凈化與分析檢測的自動化。該方法簡便快速、經濟環保、結果準確可靠,適用于水果中三唑類農藥殘留的定性定量分析。
1實驗部分
1.1儀器與試劑
GPC/GC-MS 2010Ultra在線凝膠色譜串聯氣相色譜-質譜聯用儀(日本島津公司);立式大容量高速離心機(日本 Hitachi公司);N-EVAT24氮吹儀(美國Organomation Associatews)。
乙腈、丙酮、環己烷(HPLC級,Fisher公司);乙酸、甲苯(HPLC級,美國J.T.Baker公司);PSA 、C18吸附劑(粒徑范圍40~60 μm,天津艾杰爾公司);無水硫酸鎂、氯化鈉、無水乙酸鈉、檸檬酸鈉(分析純,天津市科密歐公司),檸檬酸氫二鈉(分析純,美國Alfa Aesar公司);微孔濾膜(0.22 μm,天津津騰公司)。
氟硅唑、丙環唑標準品(純度≥97%,德國DR公司) 分別以丙酮配制成濃度為1 000 mg/L的標準溶液;烯效唑、己唑醇、腈菌唑(規格100 μg/mL,農業部環境保護研究所);其余農藥標樣均購于農業部環境質量監督檢驗測試中心(天津),規格為1 000 mg/L。15種農藥根據需要用丙酮-環己烷(3∶7)配成合適的混合標準工作溶液,于-20 ℃冰箱中保存。基質標準溶液:用空白樣品基質溶液配成不同濃度的基質混合標準溶液,用于制作標準工作曲線,現配現用。
1.2樣品前處理
1.2.1原創QuEChERS方法(即未加緩沖鹽的QuEChERS方法)準確稱取勻漿后的水果樣品10 g(精確至0.01 g)于50 mL塑料離心管中,加入10.0 mL乙腈溶液、1.0 g NaCl、4.0 g無水MgSO4,振搖1 min,以8 000 r/min高速離心5 min,吸取1.0 mL上層清液轉入裝有25 mg PSA、150 mg無水MgSO4的10 mL離心管中,渦旋混勻1 min,靜置,上清液過0.22 μm濾膜后,待測。
1.2.2AOAC 2007.01方法(即加乙酸鹽緩沖鹽的QuEChERS方法)準確稱取勻漿后的水果樣品15 g(精確至0.01 g)于50 mL塑料離心管中,加入15.0 mL 1% 乙酸-乙腈溶液、1.5 g NaCl、6.0 g無水MgSO4、1.5 g無水乙酸鈉,振搖1 min,以8 000 r/min高速離心5 min,吸取1.0 mL上層清液轉入裝有50 mg PSA、150 mg 無水MgSO4的10 mL離心管中,渦旋混勻1 min,靜置,上清液過0.22 μm濾膜后,待測。
1.2.3CEN 15662方法(即加檸檬酸緩沖鹽的QuEChERS方法) 準確稱取勻漿后的水果樣品10 g(精確至0.01 g)于50 mL塑料離心管中,加入10.0 mL乙腈后振搖1 min,加入1.0 g NaCl、4.0 g無水MgSO4、1.0 g檸檬酸鈉、0.5 g檸檬酸氫二鈉,振搖1 min,其余操作與“1.2.1”一致。
1.3色譜-質譜條件
1.3.1GPC條件凈化柱:Shodex EV-200凝膠色譜柱(150 mm×2.1 mm);檢測波長:210 nm;流動相:丙酮-環己烷(3∶7),流速:0.1 mL/min;柱溫:40 ℃;進樣量:10 μL。
1.3.2GC-MS分析條件色譜柱:惰性毛細管柱(5 m×0.53 mm),預柱 Rtx-5 ms(5 m×0.25 mm×0.25 μm),分析柱Rtx-5 ms(25 m×0.25 mm×0.25 μm),3根柱子通過兩通和三通串聯使用;PTV進樣口:不分流恒壓模式,程序升溫:120 ℃保持5 min,以80 ℃/min升至250 ℃,保持36 min;柱溫箱程序升溫:82 ℃保持5 min,以9 ℃/min升至280 ℃,保持10 min;載氣:氦氣,總流速:30.0 mL/min;柱流速:1.75 mL/min。
離子源溫度:200 ℃;GC-MS接口溫度:250 ℃;溶劑延遲時間:9.5 min;檢測電壓:0.79 kV;質譜檢測模式:選擇離子掃描模式(SIM)。每種化合物分別選擇1個定量離子,2個定性離子,具體SIM離子參數見表1。
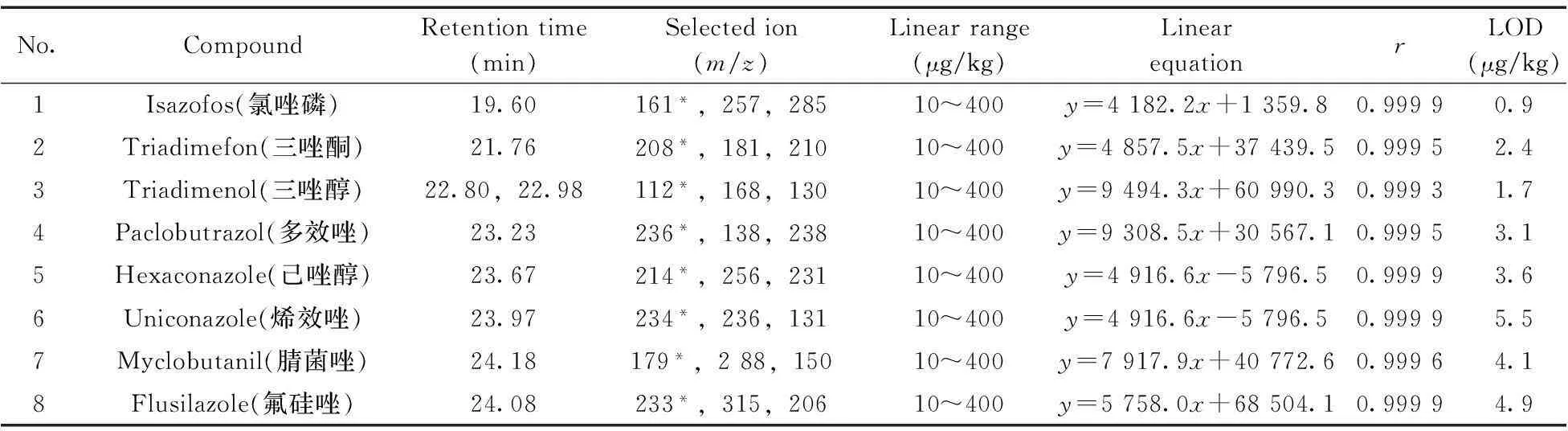
表1 15種農藥的保留時間、選擇離子、線性方程、相關系數及檢出限
(續表1)
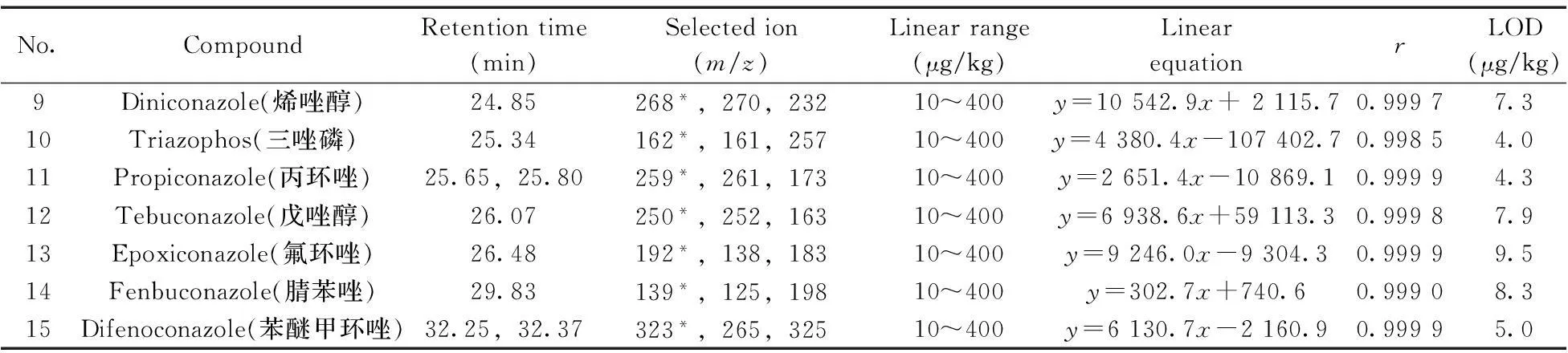
No.CompoundRetentiontime(min)Selectedion(m/z)Linearrange(μg/kg)LinearequationrLOD(μg/kg)9Diniconazole(烯唑醇)24.85268*,270,23210~400y=10542.9x+2115.70.99977.310Triazophos(三唑磷)25.34162*,161,25710~400y=4380.4x-107402.70.99854.011Propiconazole(丙環唑)25.65,25.80259*,261,17310~400y=2651.4x-10869.10.99994.312Tebuconazole(戊唑醇)26.07250*,252,16310~400y=6938.6x+59113.30.99987.913Epoxiconazole(氟環唑)26.48192*,138,18310~400y=9246.0x-9304.30.99999.514Fenbuconazole(腈苯唑)29.83139*,125,19810~400y=302.7x+740.60.99908.315Difenoconazole(苯醚甲環唑)32.25,32.37323*,265,32510~400y=6130.7x-2160.90.99995.0
*quantitative ion;x:concentration of standard solution(μg/L);y:peak area(μV·s)
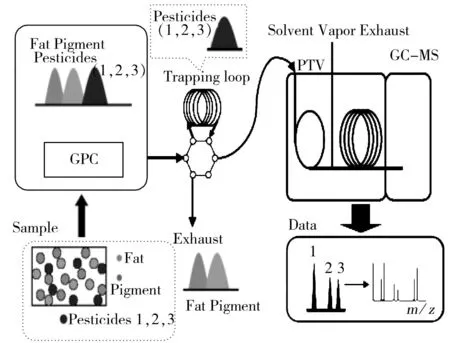
圖1 GPC/GC-MS系統流路圖Fig.1 The flow diagram of GPC/GC-MS system
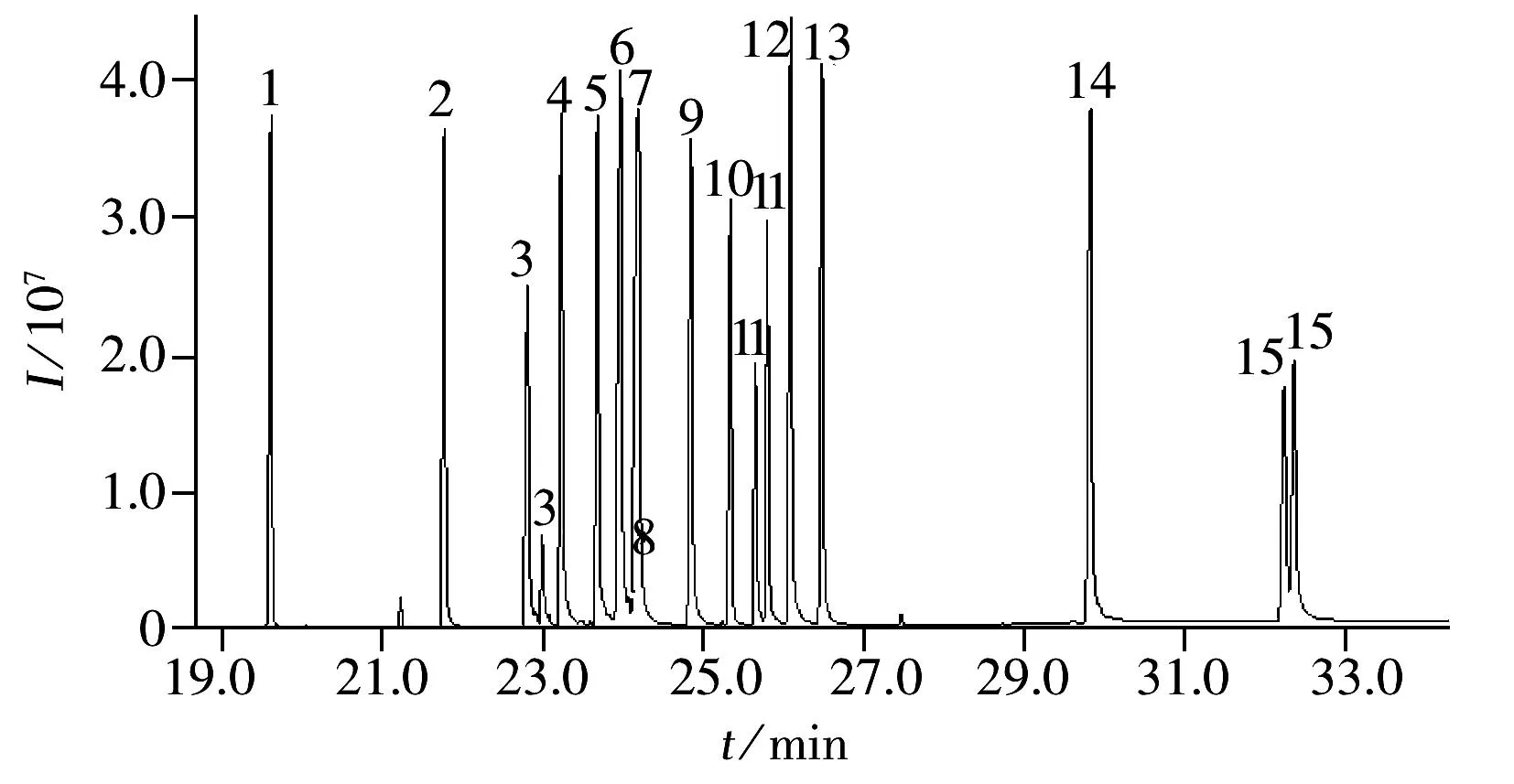
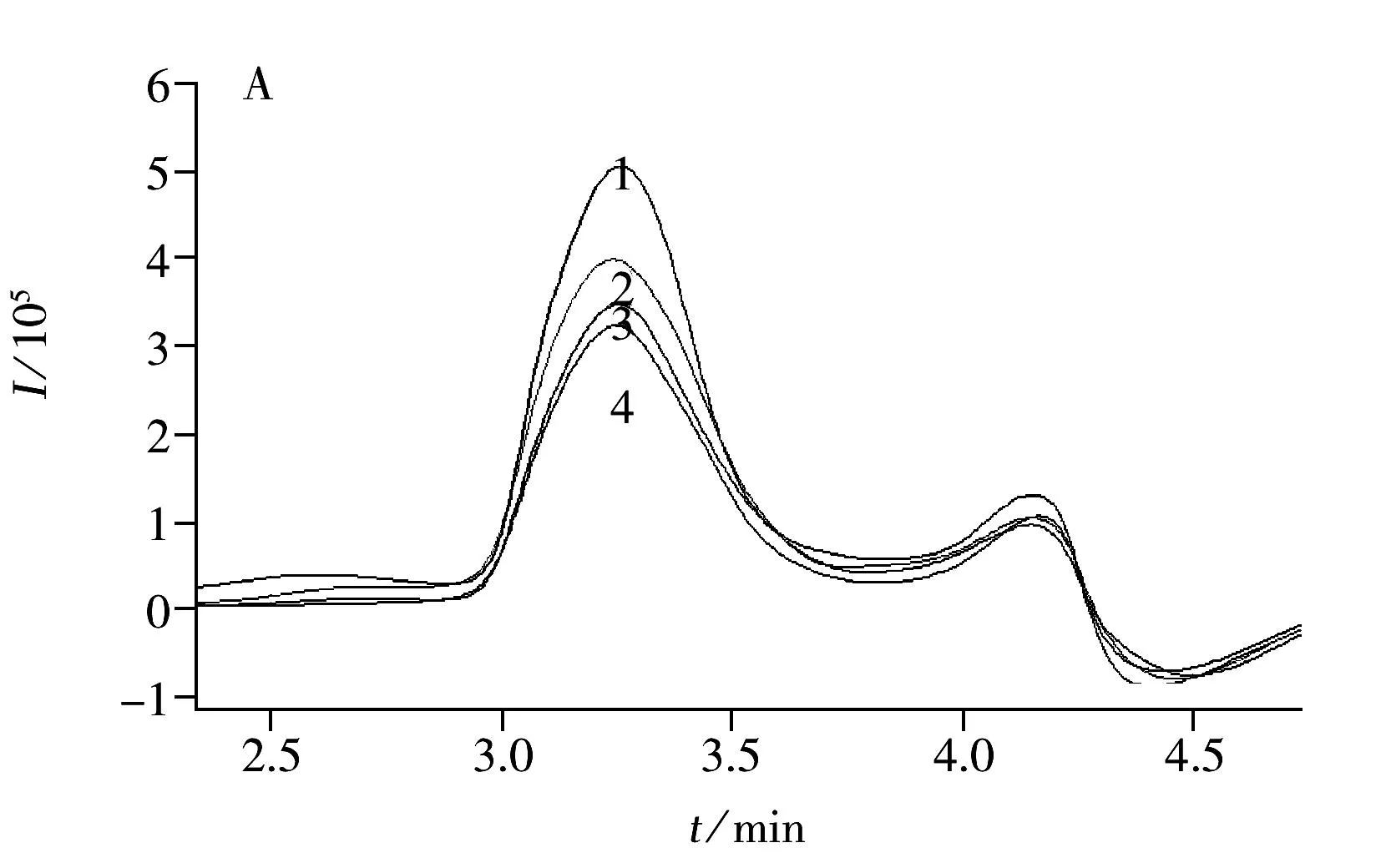
圖2 15種農藥(1 mg/L)的總離子流圖Fig.2 TIC chromatogram of 15 triazole pesticides(1 mg/L)compound No.(1-15) correspond to the numbers in Table 1
2結果與討論
2.1GPC/GC-MS在線凈化
GPC/GC-MS分析農藥殘留時,在GPC色譜柱中根據體積排阻的原理,樣品中分子量較大的脂肪和色素先從色譜柱中流出,通過六通閥的轉換將這些基質干擾物排出系統,截取含有農藥成分的部分導入試樣定量捕集環路(200 μL),再進行PTV進樣和GC-MS分離檢測,實現了全自動的前處理和儀器分析測定的在線分析(圖1)。而合理的截取時間是影響目標農藥定性和定量的關鍵,若截取時間過早,色素和油脂的去除效果降低,若截取時間過晚,分子量大的目標農藥丟失,所以在GPC/GC-MS分析中必須根據實際分析對象選擇最佳截取時間。在GPC軟件中通常采用氟胺氰菊酯和滅螨猛標準品的保留時間來確定農藥的收集開始和結束時間,本文15種三唑類農藥中苯醚甲環唑的分子量最大為406.26,小于氟胺氰菊酯的分子量(502.9),所以采用氟胺氰菊酯的保留時間作為干擾物和分析對象的切割時間,圖2為優化截取條件下15種農藥的總離子流(TIC)色譜圖。此外,GPC/GC-MS系統的進樣量為10~20 μL,比單獨的GC-MS高5~10倍,樣品提取液經分散固相萃取凈化后再利用在線GPC進一步去除干擾物質,彌補了QuEChERS方法去除干擾不徹底的缺陷,之后采用進樣口程序升溫的方式提高檢測靈敏度和選擇性,從而獲得更低的檢出限。
2.23種QuEChERS方法回收率的比較
原始QuEChERS方法對穩定性差的農藥回收率較低,其結果與基質的pH值有關[5]。加入乙酸鹽緩沖鹽體系和檸檬酸緩沖鹽體系的QuEChERS方法,其樣品提取液的pH值分別為4.8~5.5和5.0~5.5,一些對酸堿敏感的農藥可獲得高回收率。本文以蘋果、梨、桃、櫻桃、葡萄、香蕉和橙子7種水果為基質,在100 μg/kg加標水平下分別采用3種QuEChERS方法進行前處理。結果顯示,采用原創QuEChERS方法,15種農藥在上述7種基質中的回收率分別為:87.3%~103.8%,87.2%~106.1%,82.5%~100.5%,93.1%~101.9%,87.2%~102.5%,88.8%~106.2%和85.3%~107.3%;采用AOAC 2007.01方法,15種農藥的回收率分別為87.6%~108.5%,90.2%~104.0%,92.8%~102.8%,93.1%~110.7%,82.2%~99.8%,90.8%~110.9%和96.5%~102.4%;采用CEN 15662方法,15種農藥的回收率分別為:87.9%~113.6%,83.9%~111.6%,91.8%~109.4%,93.8%~113.3%,81.1%~106.6%,89.9%~102.2%和87.8%~114.7%。表2列出了蘋果、梨、桃、櫻桃4種基質的萃取回收率。3種方法的回收率均滿足殘留檢測的要求,方法間無顯著差異(p>0.05),分析其原因是目標化合物在中性或酸性介質中較穩定,其次采用原創QuEChERS方法前處理時,其提取液pH值為4.5~5.8,接近于緩沖鹽體系QuEChERS方法的pH值。原創QuEChERS方法與兩種緩沖鹽體系QuEChERS方法相比,因無其他物質的加入,引入雜質的幾率較小,且操作更方便、成本更低。因此,在分析水果中三唑類農藥的殘留量時,原創QuEChERS方法優于兩種緩沖鹽體系QuEChERS方法。
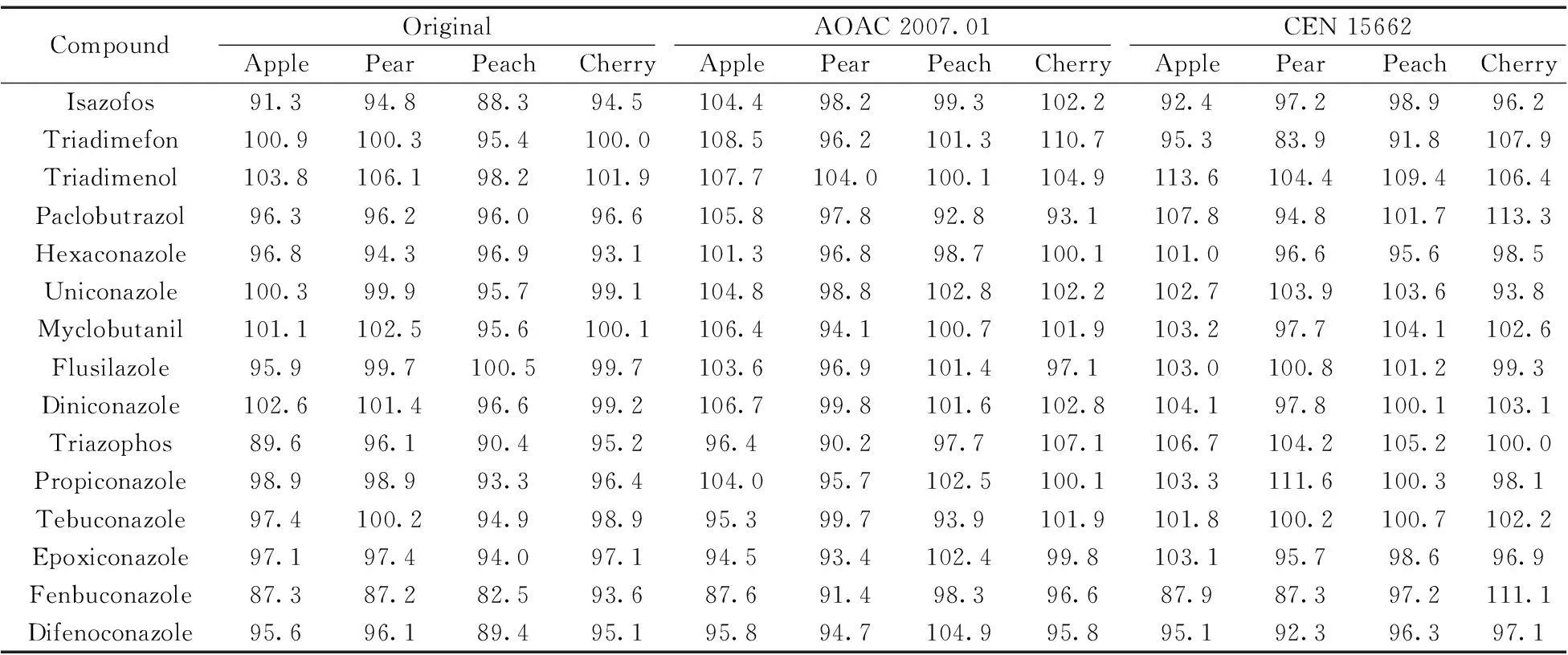
表2 3種QuEChERS方法在4種基質中的回收率比較
2.3基質效應
基質效應是指樣品分析液中分析物以外的共流出組分改變了分析物的響應值,從而影響定量分析的準確度和重現性[5]。本文以基質匹配校準曲線斜率/純溶劑標準曲線斜率比來確定基質效應,斜率比越接近1,基質效應越小,斜率比在0.80~1.20 之間則認為無基質效應[5]。與兩種緩沖鹽體系QuEChERS方法相比,原創QuEChERS方法的基質效應整體略低于前兩種方法。圖3為采用原創QuEChERS方法處理的基質效應圖。結果顯示,同一化合物在不同基質中的基質效應不同,不同化合物在同一基質中的基質效應也各不相同,15種三唑類農藥在7種基質中均顯示基質增強效應,因此本實驗采用基質匹配標準溶液進行定量,以補償基質效應對定量結果的影響。
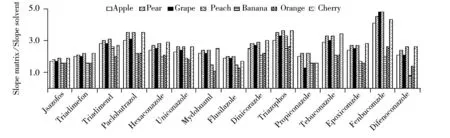
圖3 15種農藥在7種水果中的基質效應Fig.3 Matrix effects of 15 pesticides in 7 matrixes
2.4分散吸附劑的選擇
QuEChERS方法中最常用的吸附劑有PSA和C18。PSA因化學結構中含有兩個氨基,具有較強的離子交換能力,能與基質中的脂肪酸、糖類、甾醇等分子中的羥基形成共價鍵氫鍵而將其除去,但當待檢農藥分子中含有較多羥基時,則應考慮PSA對該農藥的吸附。C18是在硅膠末端鍵合十八烷基,由于十八烷基的非極性較強,因此易吸附非極性物質如維生素、脂肪、甾醇、揮發油等。本實驗采用原創QuEChERS前處理方法,以蘋果、葡萄、桃為基質,在100 μg/kg 加標水平下,以回收率和凈化效果為主要指標,比較以下4種凈化方式的凈化效果:Ⅰ.25 mg PSA+150 mg無水MgSO4;Ⅱ.25 mg C18+150 mg無水MgSO4;Ⅲ.25 mg PSA+25 mg C18+150 mg無水MgSO4;Ⅳ.50 mg PSA+150 mg無水MgSO4。結果顯示:①通過比較凈化前后提取液的顏色發現,C18對色素的去除能力明顯差于PSA,PSA+C18與PSA無明顯差異;②從圖4可知,PSA去除雜質的效果明顯優于單獨使用C18的去除效果,而凈化方式Ⅲ的凈化效果最佳;③從回收率結果可知,15 種農藥在4種凈化方式下的回收率均為83.4%~108.7%,無明顯差別。因此,綜合考慮凈化劑對色素的吸附能力、去除雜質的效果以及對回收率的影響等因素,本文最終采用方式Ⅲ(25 mg PSA+25 mg C18+150 mg無水MgSO4)作為凈化劑。
2.5定容溶液的選擇
采用GC-MS或GC-MS/MS檢測農藥時,由于QuEChERS方法最終上機測定的溶劑為乙腈溶液,而乙腈溶液的極性較強,對玻璃襯管和毛細管色譜柱前端損傷較重,容易出現色譜峰丟失或拖尾、背景高等情況,需經常更換襯管和惰性毛細管色譜柱,增加了檢測成本;再者GPC凝膠柱一般采用丙酮/環己烷或丙酮/乙酸乙酯為流動相,使用乙腈會降低其使用壽命,因此,本文將乙腈轉溶為丙酮/環己烷。在100 μg/kg 加標水平下,以蘋果中多效唑和苯醚甲環唑為例,采用乙腈定容時多效唑和苯醚甲環唑的回收率分別為103.7%和100.7%,將乙腈轉溶為丙酮/環己烷定容時,多效唑和苯醚甲環唑的回收率分別為101.4%和100.5%,二者的回收率相近,所以本文最終采用丙酮/環己烷為定容溶液。
2.6方法評價
在優化條件下,考察了15 種三唑類農藥的線性范圍及相關系數。結果顯示,在10~400 μg/L范圍內,目標化合物的純溶劑標準溶液濃度(x,μg/L)與對應的峰面積(y,μV·s)呈良好線性關系,相關系數為0.998 5~0.999 9,以20 μg/kg純溶劑標準溶液的定量離子對應色譜信號的3倍信噪比(S/N)確定方法的檢出限為0.9~9.5 μg/kg(表1)。采用原創QuEChERS前處理方法,在20,50,100 μg/kg 3個加標水平下,15種農藥在7種水果基質中的回收率為85.7%~120.1%,相對標準偏差(RSD)為0.2%~11.5%(表3),方法符合農藥殘留的檢測要求。
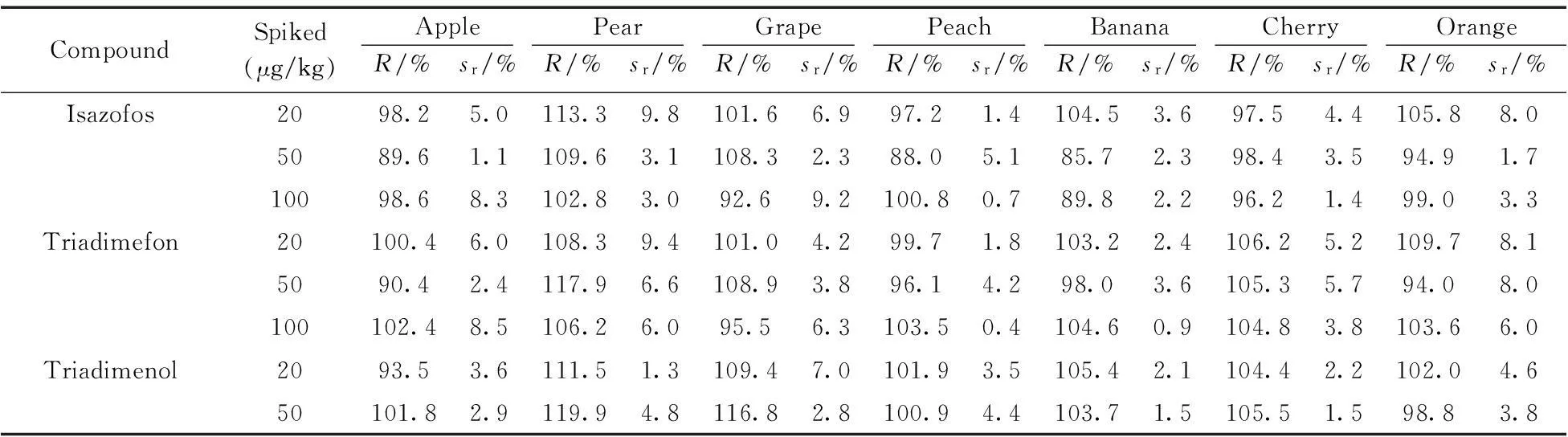
表3 15種農藥在7 種基質的加標回收率及相對標準偏差(n=6)
(續表3)
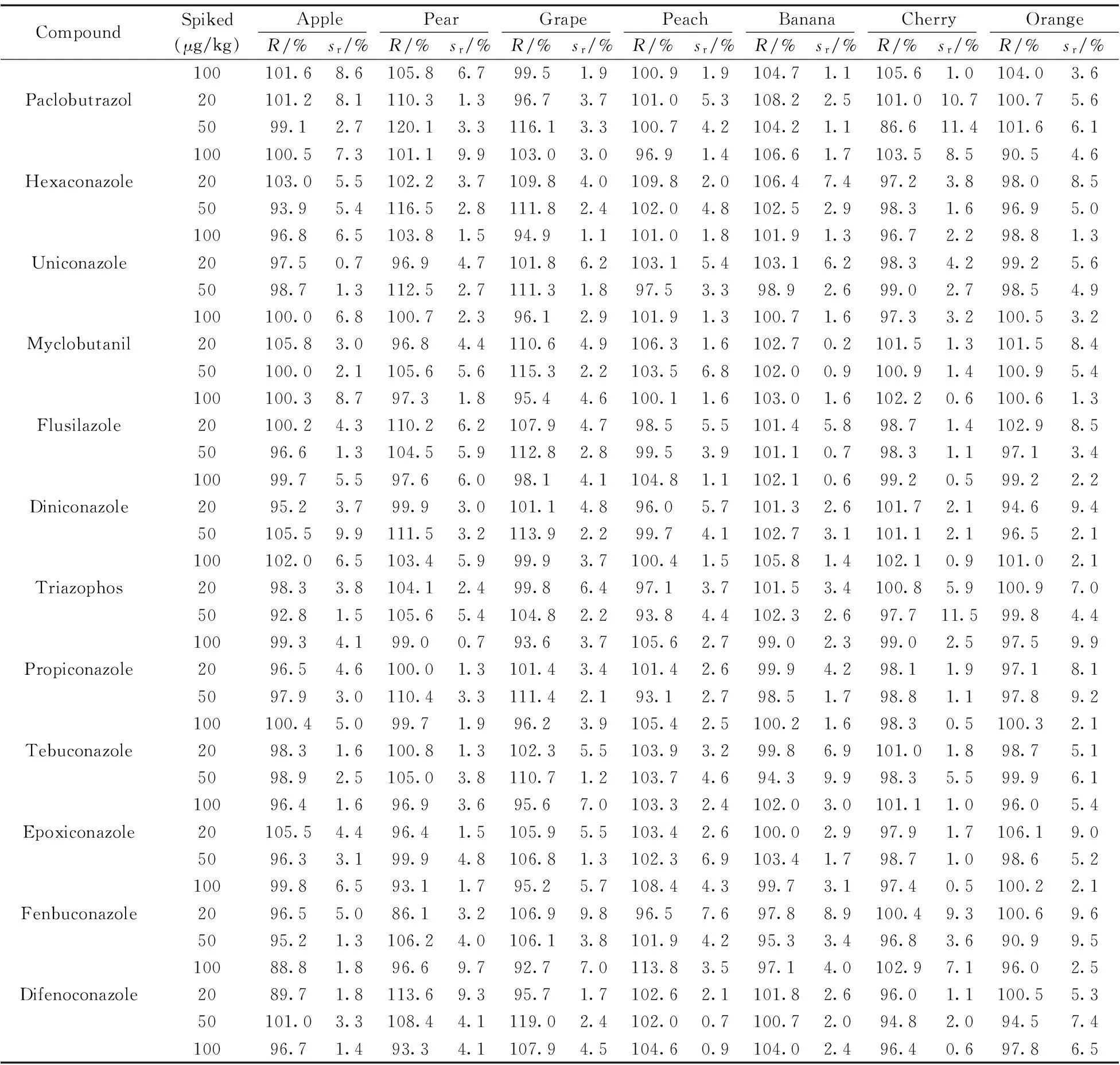
CompoundSpiked(μg/kg)ApplePearGrapePeachBananaCherryOrangeR/%sr/%R/%sr/%R/%sr/%R/%sr/%R/%sr/%R/%sr/%R/%sr/%100101.68.6105.86.799.51.9100.91.9104.71.1105.61.0104.03.6Paclobutrazol20101.28.1110.31.396.73.7101.05.3108.22.5101.010.7100.75.65099.12.7120.13.3116.13.3100.74.2104.21.186.611.4101.66.1100100.57.3101.19.9103.03.096.91.4106.61.7103.58.590.54.6Hexaconazole20103.05.5102.23.7109.84.0109.82.0106.47.497.23.898.08.55093.95.4116.52.8111.82.4102.04.8102.52.998.31.696.95.010096.86.5103.81.594.91.1101.01.8101.91.396.72.298.81.3Uniconazole2097.50.796.94.7101.86.2103.15.4103.16.298.34.299.25.65098.71.3112.52.7111.31.897.53.398.92.699.02.798.54.9100100.06.8100.72.396.12.9101.91.3100.71.697.33.2100.53.2Myclobutanil20105.83.096.84.4110.64.9106.31.6102.70.2101.51.3101.58.450100.02.1105.65.6115.32.2103.56.8102.00.9100.91.4100.95.4100100.38.797.31.895.44.6100.11.6103.01.6102.20.6100.61.3Flusilazole20100.24.3110.26.2107.94.798.55.5101.45.898.71.4102.98.55096.61.3104.55.9112.82.899.53.9101.10.798.31.197.13.410099.75.597.66.098.14.1104.81.1102.10.699.20.599.22.2Diniconazole2095.23.799.93.0101.14.896.05.7101.32.6101.72.194.69.450105.59.9111.53.2113.92.299.74.1102.73.1101.12.196.52.1100102.06.5103.45.999.93.7100.41.5105.81.4102.10.9101.02.1Triazophos2098.33.8104.12.499.86.497.13.7101.53.4100.85.9100.97.05092.81.5105.65.4104.82.293.84.4102.32.697.711.599.84.410099.34.199.00.793.63.7105.62.799.02.399.02.597.59.9Propiconazole2096.54.6100.01.3101.43.4101.42.699.94.298.11.997.18.15097.93.0110.43.3111.42.193.12.798.51.798.81.197.89.2100100.45.099.71.996.23.9105.42.5100.21.698.30.5100.32.1Tebuconazole2098.31.6100.81.3102.35.5103.93.299.86.9101.01.898.75.15098.92.5105.03.8110.71.2103.74.694.39.998.35.599.96.110096.41.696.93.695.67.0103.32.4102.03.0101.11.096.05.4Epoxiconazole20105.54.496.41.5105.95.5103.42.6100.02.997.91.7106.19.05096.33.199.94.8106.81.3102.36.9103.41.798.71.098.65.210099.86.593.11.795.25.7108.44.399.73.197.40.5100.22.1Fenbuconazole2096.55.086.13.2106.99.896.57.697.88.9100.49.3100.69.65095.21.3106.24.0106.13.8101.94.295.33.496.83.690.99.510088.81.896.69.792.77.0113.83.597.14.0102.97.196.02.5Difenoconazole2089.71.8113.69.395.71.7102.62.1101.82.696.01.1100.55.350101.03.3108.44.1119.02.4102.00.7100.72.094.82.094.57.410096.71.493.34.1107.94.5104.60.9104.02.496.40.697.86.5
3結論
由于農藥結構和性質的多樣性以及樣品種類的多樣性,最佳樣品前處理方法需能適用于更多基質及更多農藥,操作簡單、經濟環保并有較高的回收率。提取水果中三唑類農藥殘留時,原創QuEChERS方法與2種緩沖鹽體系QuEChERS前處理方法相比,具有操作簡單、成本較低、回收率較好、基質效應較低等特點,結合在線GPC/GC-MS分析方法,可彌補原創QuEChERs方法去除干擾不徹底的缺陷,同時縮短了分析時間,降低了有機溶劑用量及對操作者和環境的危害,并提高了檢測的靈敏度和選擇性。該方法簡便快速、靈敏準確、經濟環保,適用于水果中三唑類農藥殘留的檢測。
參考文獻:
[1]Li J G,Wang Y F,Shi J W,Jiang L,Yao X P,Fang L Y.Chin.J.Chromatogr.(李繼革,王玉飛,施家威,蔣麗,姚潯平,方蘭云.色譜),2012,30(3):262-266.
[2]GB2763-2014.National Food Safety Standard.Maximum Residue Limits for Pesticides in Food(食品安全國家標準 食品中農藥最大殘留限量).
[3]Wang N N.TheMainTradeCountriesandRegionsFoodPesticideandVeterinaryDrugResidueLimits.2nd ed.Beijing:Standards Press of China(王霓霓.主要貿易國家和地區食品中農獸藥殘留限量標準.2 版.北京:中國標準出版社),2010.
[4]Anastassiades M,Lehotay S J,Stajnbaher D,Schenck F J.J.AOACInt.,2003,86(2):412-431.
[5]Wang L Z,Zhou Y,Chen Y,Wang R L,Lin Z X,Lin D J,Zheng S H.Chin.J.Chromatogr.(王連珠,周昱,陳泳,王瑞龍,林子旭,林德娟,鄭少惠.色譜),2012,30(2):146-153.
[6]Lu D S,Xiong L B,Wen Y M,Qiu X L,Wang G Q.J.Chin.MassSpectrom.Soc.(盧大勝,熊麗蓓,溫憶敏,邱歆磊,汪國權.質譜學報),2011,32(4):229-235.
[7]Wang L Z,Huang X Y,Chen Y,Lin Z X,Wang G F,Zhou Y.J.Instrum.Anal.(王連珠,黃小燕,陳泳,林子旭,王根芳,周昱.分析測試學報),2014,33(10):1102-1108.
[8]Wu L,Chen M X,Mou R X,Ying X H,Cao Z Y.J.Instrum.Anal.(吳俐,陳銘學,牟仁祥,應興華,曹趙云.分析測試學報),2009,28(7):846-848,854.
[9]Ge N,Liu X M,Li X M,Huang X Z,Wu Y P,Li J,Liu Y M.J.Instrum.Anal.(葛娜,劉曉茂,李學民,黃學者,吳艷萍,李金,劉永明.分析測試學報),2011,30(12):1351-1355.
[10]Sun X,Ding Y,Wang J L,Wang D L,Shen Y,Liu X J.FoodSci.(孫星,丁悅,汪佳蕾,王冬蘭,沈燕,劉賢金.食品科學),2014,35(8):76-79.
[11]Yan H F,Li Y J,Wang M L,Dai H,Zhang Y,Huang Z Q.Anal.Test.Technol.Instrum.(顏鴻飛,李擁軍,王美玲,戴華,張瑩,黃志強.分析測試技術與儀器),2012,18(4):204-207.
[12]Xiao Y,Peng J D,Zhang J,Tang J X.J.SouthwestUniv.:Nat.Sci.Ed.(肖穎,彭敬東,張晶,唐金霞.西南大學學報:自然科學版),2013,35(5):102-106.
[13]Costa F P,Caldas S S,Primel E G.FoodChem.,2014,165:587-593.
[14]Huang Y H.J.Instrum.Anal.(黃永輝.分析測試學報),2014,28(2):217-221.
[15]Jia W,Ling Y,Hao J,Zhang F,Jiang P P,Yong W,Feng F,Huang J R,Chu X G.J.Instrum.Anal.(賈瑋,凌云,郝靜,張峰,蔣萍萍,雍煒,馮峰,黃峻榕,儲曉剛.分析測試學報),2012,31(10):1217-1222.
[16]Lehotay S J,Mastovská K,Lightfield A R.J.AOAC.Int.,2005,88(2):615-629.
[17]Lehotay S J,Son K A,Kwon H,Koesukwiwat U,Fu W,Mastovska K,Hoh E,Leepipatpiboon N.J.Chromatogr.A,2010,1217(16):2548-2560.
研究報告
Evaluation of QuEChERS Method for the Analysis of 15 Triazole Pesticides Residues in Fruits by Online Gel Permeation Chromatography Gas Chromatography-Mass SpectrometryLI Hai-fei,NIE Ji-yun*,XU Guo-feng,LI Jing,YAN Zhen,LI Zhi-xia,WU Yong-long,KUANG Li-xue
(Quality Inspection and Test Center for Fruit and Nursery Stocks,Ministry of Agriculture;Laboratory of Quality
and Safety Risk Assessment for Fruit(Xingcheng),Ministry of Agriculture;Institute of Pomology
of Chinese Academy of Agricultural Sciences,Xingcheng125100,China)
Abstract:A comparison was made among three versions of QuEChERS sample preparation methods for the extraction of 15 triazole pesticides in fruits.The three QuEChERS methods were the original method without buffer,the AOAC Official Method 2007.01 with acetate buffer,and the CEN 15662 Method with citrate buffer.The clean-up effects of primary secondary amine(PSA) sorbent and C18sorbent on 15 triazole pesticides were studied.The addition method after extraction was used to evaluate the matrix effects of triazole pesticide in matrix of apple,pear,peach,grape,cherry,banana and orange during gel permeation chromatography coupled to gas chromatography-mass spectrometry(GPC/GC-MS) analysis.As a result,the QuEChERS method without buffer gave good recoveries for 15 triazole pesticides.The cleaning up effect of PSA plus C18is superior to that of C18or PSA sorbent.The matrix effects were intensive in the 7 kinds of fruits.In this article,15 triazole pesticides were extracted by the QuEChERS method without buffer,and analysed by using matrix-matched standard calibration as the external standard method with gas chromatography-mass spectrometry in selective ion monitoring(SIM) mode.Moreover,a large volume of sample was allowed to be injected using the program of GPC programmed temperature vaporizer of gas chromatography to improve the sensitivity of measurements.The recoveries of 15 residues in 7 matrixes at three spiked levels of 20,50,100 μg/kg ranged from 85.7% to 120.1% with relative standard deviations of 0.2%-11.5%.The calibration curves were linear(r>0.998) in the range of 10-400 μg/L for all the pesticides.The limits of detection(LOD) for the pesticides in fruits ranged from 0.9 μg/kg to 9.5 μg/kg.Based on these results,the analytical method was proved to be highly efficient,robust and sensitive,and was suitable for monitoring 15 triazole pesticides residues in fruits.
Key words:QuEChERS;online gel permeation chromatography/gas chromatography-mass spectrometry(GPC/GC-MS);triazole pesticides;matrix effects;fruits
中圖分類號:O657.63;F767.2
文獻標識碼:A
文章編號:1004-4957(2015)12-1331-08
doi:10.3969/j.issn.1004-4957.2015.12.001
通訊作者:*聶繼云,博士,研究員,研究方向:果品質量安全,Tel:0429-3598178,E-mail:jiyunnie@163.com
基金項目:國家農產品質量安全風險評估計劃(GJFP2014002,GJFP2015002);中央級科研院所基本科研業務費專項(0032014013);中國農業科學院科技創新工程(CAAS-ASTIP)
收稿日期:2015-05-26;修回日期:2015-06-25

