血紅蛋白和細(xì)胞色素c構(gòu)象去折疊行為研究
凡素華,宋燕玲,沈芳明,喬夢(mèng)霞,鄭甜甜,張 宏,武 海
(阜陽(yáng)師范學(xué)院 化學(xué)與材料工程學(xué)院,安徽 阜陽(yáng) 236037)
?
血紅蛋白和細(xì)胞色素c構(gòu)象去折疊行為研究
凡素華,宋燕玲,沈芳明,喬夢(mèng)霞,鄭甜甜,張宏,武海*
(阜陽(yáng)師范學(xué)院化學(xué)與材料工程學(xué)院,安徽阜陽(yáng)236037)
蛋白質(zhì)是由α-氨基酸通過(guò)肽鍵按一定順序排列成一條肽鏈,再由一條或一條以上的肽鏈由次級(jí)鍵折疊而成的具有特殊空間結(jié)構(gòu)的生物大分子,是生命的物質(zhì)基礎(chǔ)和生命活動(dòng)的主要承擔(dān)者。蛋白質(zhì)的空間結(jié)構(gòu)決定了其特殊的生物活性,一旦空間結(jié)構(gòu)發(fā)生變化(如去折疊、變性、錯(cuò)誤折疊),其生物活性將發(fā)生重大變化,甚至引發(fā)“折疊病”,如瘋牛病、帕金森、老年癡呆等[1-2]。因此,研究蛋白質(zhì)構(gòu)象變化,并通過(guò)調(diào)節(jié)蛋白質(zhì)構(gòu)象以實(shí)現(xiàn)活性的控制,從而調(diào)控物質(zhì)代謝反應(yīng)及相應(yīng)的生理功能,將有助于因錯(cuò)誤折疊引起的疾病的機(jī)理研究、預(yù)防和診斷,在生物、醫(yī)學(xué)及化學(xué)領(lǐng)域具有重要的理論意義和實(shí)用價(jià)值[3-4]。
血紅素蛋白是一類(lèi)含有血紅素輔基的蛋白,如血紅蛋白(Hb)、細(xì)胞色素c(Cyt c)、過(guò)氧化酶、肌紅蛋白等。此類(lèi)蛋白血紅素輔基(Heme)的鐵原子以6配位方式與原卟啉環(huán)的4個(gè)氮原子配位,并與蛋白組氨酸殘基的咪唑環(huán)結(jié)合[5]。不同的血紅素蛋白與血紅素輔基的結(jié)合方式和Heme輔基活性中心的結(jié)構(gòu)不同,致使其生物功能不同。Hb和Cyt c作為典型的血紅素蛋白,常用于蛋白質(zhì)結(jié)構(gòu)與功能之間的關(guān)系、蛋白質(zhì)的直接電化學(xué)性質(zhì)、電化學(xué)傳感器的構(gòu)建等研究領(lǐng)域[6-7]。而且,此類(lèi)蛋白的構(gòu)象去折疊與結(jié)構(gòu)出現(xiàn)紊亂時(shí)的生理?xiàng)l件密切相關(guān)。例如,在酸性條件改變時(shí),由于Hb的三維構(gòu)象發(fā)生改變會(huì)引起鍵合氧能力降低,而過(guò)氧化活性急劇增加[8]。研究Hb和Cyt c的構(gòu)象變化規(guī)律,可揭示兩者結(jié)構(gòu)與功能之間的關(guān)系,對(duì)于調(diào)控蛋白構(gòu)象并利用其活性具有重要意義。
Hb是兩個(gè)由141個(gè)氨基酸殘基組成的α-亞基和兩個(gè)由146個(gè)氨基酸殘基組成的β-亞基,按特定的接觸和排列組成的一個(gè)球型蛋白質(zhì)分子,每個(gè)亞基中各含有1個(gè)亞鐵離子的Heme輔基。Hb不僅具有運(yùn)輸質(zhì)子和二氧化碳等功能,而且具有氧合功能[9]。Cyt c是一種定位于線(xiàn)粒體內(nèi)外膜間隙的血紅素蛋白,廣泛存在于各種含線(xiàn)粒體呼吸鏈的生物體中,是唯一能溶于水的細(xì)胞色素,在能量代謝中起著非常重要的作用[10]。這兩種蛋白均具有Heme輔基,但由于其與蛋白肽鏈的結(jié)合方式不同,導(dǎo)致Hb和Cyt c的功能和構(gòu)象變化機(jī)理不同。本文基于Hb和Cyt c與Heme輔基結(jié)合方式的不同而引起的結(jié)構(gòu)不同,著力研究在外界環(huán)境因素改變的條件下兩種蛋白的構(gòu)象去折疊行為和構(gòu)象變化機(jī)理,以期揭示蛋白功能與結(jié)構(gòu)之間的關(guān)系,為利用蛋白構(gòu)象變化產(chǎn)生的特殊活性提供基礎(chǔ)。
1實(shí)驗(yàn)部分
1.1試劑與儀器
血紅蛋白(Hb)和細(xì)胞色素c(Cyt c)購(gòu)自百靈威科技有限公司(上海),KH2PO4、Na2HPO4·12H2O、尿素、鹽酸胍(分析純,國(guó)藥集團(tuán)化學(xué)試劑有限公司)。0.1 mol/L 磷酸緩沖溶液(PBS)由KH2PO4和Na2HPO4·12H2O溶液調(diào)配而成,利用pH計(jì)調(diào)至所需酸度。所有實(shí)驗(yàn)均在室溫下進(jìn)行,蛋白溶液于4 ℃保存,實(shí)驗(yàn)用水為超純水。
吸收光譜利用雙光束紫外-可見(jiàn)分光光度計(jì)(TU-1901,北京普析通用儀器有限責(zé)任公司)測(cè)定;熒光光譜采用FM4-NIR-TCSPC熒光光譜儀(法國(guó)FluoroMax-4)測(cè)定。
1.2蛋白去折疊及其光譜表征方法
分別移取30.00 μL濃度均為0.75 mmol/L的Hb和Cyt c溶液于3.0 mL的尿素或鹽酸胍溶液中,尿素濃度分別為0,1.0,2.0,3.0,4.0,5.0,6.0,7.0,8.0 mol/L,鹽酸胍濃度分別為0,1.0,1.5,2.0,3.0,4.0,5.0,6.0 mol/L,pH值均為7.0。分別測(cè)定吸收光譜和熒光光譜(λex=280 nm,狹縫為5/5 nm)。
2結(jié)果與討論
2.1Hb與Cyt c的結(jié)構(gòu)及性質(zhì)
Hb是由兩個(gè)α-亞基和兩個(gè)β-亞基4條肽鏈組成的具有特殊空間結(jié)構(gòu)的球型蛋白質(zhì)分子(圖1A)。Hb中4個(gè)亞基間靠氫鍵和8個(gè)離子鍵緊密結(jié)合,形成一個(gè)長(zhǎng)、寬、高分別為6.4,5.5,5.0 nm的四聚體[11-12]。Hb的空間結(jié)構(gòu)和肌紅蛋白(Mb)的結(jié)構(gòu)相似,每個(gè)亞基中含有1個(gè)高自旋5配位的Heme輔基,F(xiàn)e原子除了與咪唑環(huán)的4個(gè)N原子配位外,第5個(gè)軸向配體為組氨酸(His 93),而第6個(gè)軸向存在一個(gè)空穴,可與O2分子可逆結(jié)合,具有載氧功能(圖1B)。Hb并不參與生物體系的電子傳遞,但具有過(guò)氧化物酶和細(xì)胞色素的活性,并能與一氧化氮結(jié)合,起著平衡血液和骨骼肌中NO濃度的作用[13]。
Cyt c是由5個(gè)α螺旋通過(guò)loop連接而成的一個(gè)球形蛋白(圖1C)。Heme輔基中心Fe原子與Cyt c 肽鏈上組氨酸(His 18)的N原子、甲硫氨酸殘基(Met 80)的S原子及Heme的4個(gè)N原子配位。而且,Heme的兩個(gè)乙烯基與肽鏈上兩個(gè)半胱氨酸殘基(Cys)的巰基配位形成兩個(gè)硫醚鍵(圖1D)。因此,Heme輔基這種鍵合于肽鏈的方式使得其在Cyt c疏水空腔內(nèi)非常穩(wěn)定[14]。Cyt c在細(xì)胞能量代謝中起著至關(guān)重要的作用,作為電子載體傳遞電子的方式是通過(guò)其血紅素輔基中鐵原子的還原態(tài)(Fe2+)和氧化態(tài)(Fe3+)之間的可逆變化,經(jīng)過(guò)一系列步驟最終將O2還原成H2O,這是呼吸作用中非常重要的環(huán)節(jié)。基于Hb和Cyt c的血紅素輔基與肽鏈的結(jié)合方式不同,這兩種蛋白的構(gòu)象變化所表現(xiàn)的性質(zhì)也存在很大差異。
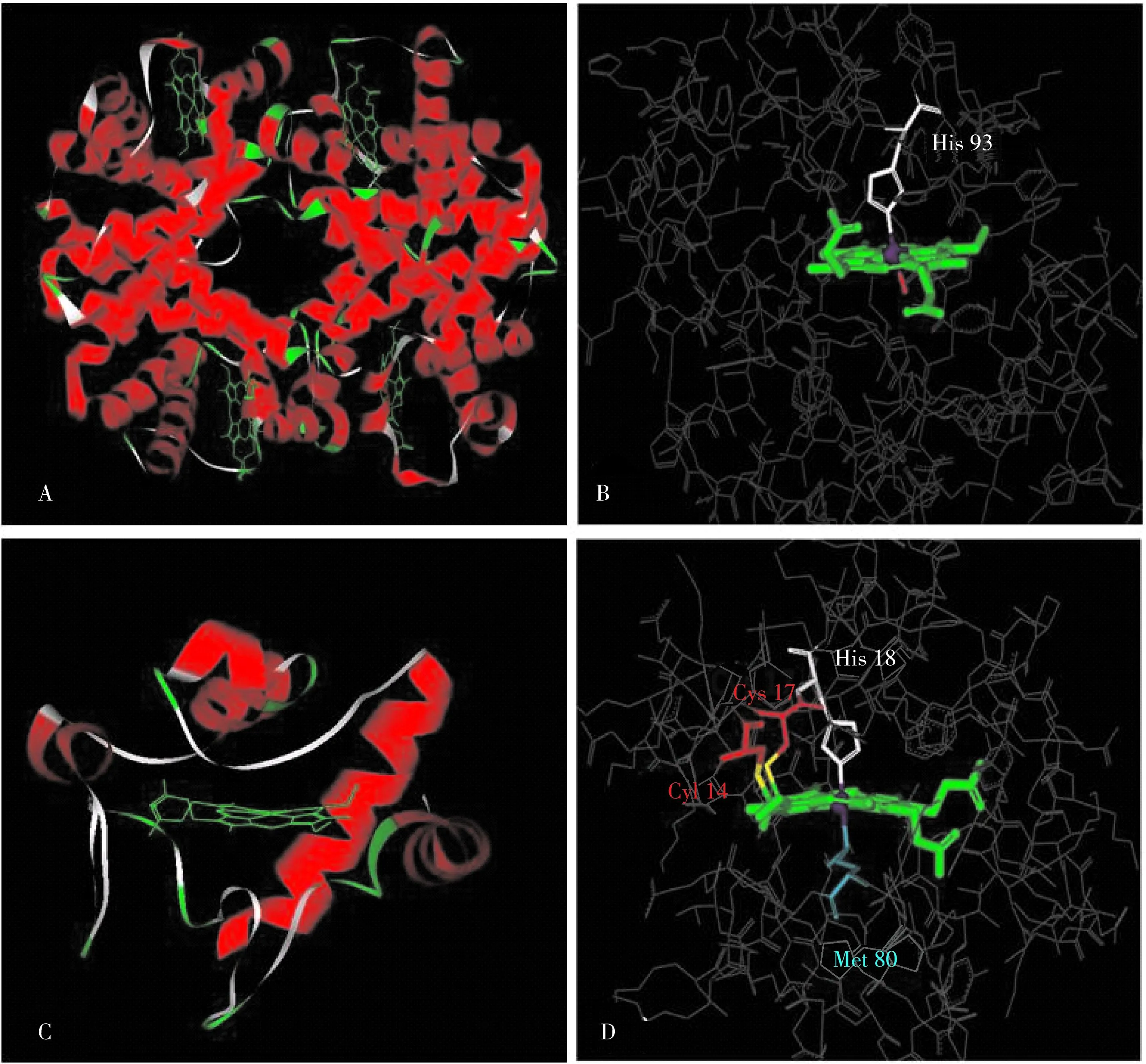
圖1 Hb(A)和Hb的一個(gè)α-亞基的Heme輔基(B)的三維構(gòu)象圖以及Cyt c(C)和
2.2Hb與Cyt c的構(gòu)象去折疊紫外-可見(jiàn)吸收光譜研究
在物理、化學(xué)因素的影響下,天然蛋白質(zhì)的分子構(gòu)象將發(fā)生改變,引起生物活性以及物理、化學(xué)性質(zhì)的異常變化,該現(xiàn)象稱(chēng)為蛋白質(zhì)的去折疊或變性[15]。只有在最適宜的條件下蛋白質(zhì)方能保持天然的折疊態(tài),顯示其特有的生物活性。各種環(huán)境因素(如溫度、機(jī)械力、溶液離子強(qiáng)度、酸度等)的改變或化學(xué)變性劑的存在均能導(dǎo)致蛋白質(zhì)的物理化學(xué)及生物化學(xué)性質(zhì)發(fā)生異常變化,甚至使其喪失生物活性。常見(jiàn)的化學(xué)變性劑有尿素(脲)和鹽酸胍,由于誘導(dǎo)蛋白質(zhì)去折疊的作用力方式不同,兩者的蛋白質(zhì)去折疊能力也有所不同。
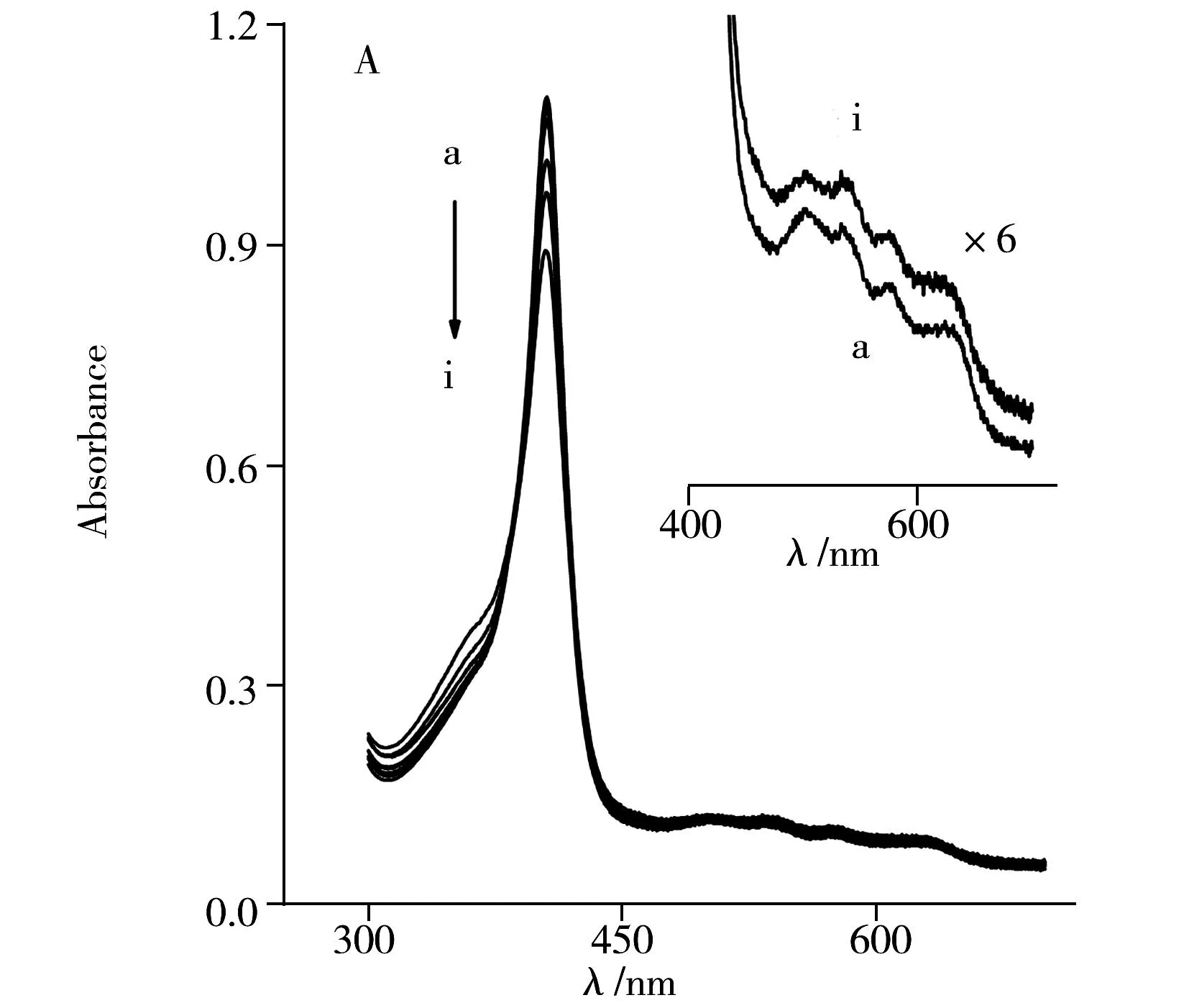
如圖2所示,Hb和Cyt c在尿素和鹽酸胍中去折疊時(shí)的紫外-可見(jiàn)吸收光譜圖呈現(xiàn)不同的變化趨勢(shì)。天然態(tài)的Hb和Cyt c分別在406 nm和409 nm處出現(xiàn)Heme與組氨酸配位而形成的Soret吸收帶,這一吸收帶的位置和形狀常用于表征卟啉環(huán)和蛋白構(gòu)象之間的變化[1]。另外,在470~700 nm處出現(xiàn)的Heme輔基的Q帶常用于表征輔基周?chē)h(huán)境的改變。圖2A和B顯示隨尿素溶液濃度的增加,Hb和Cyt c的Soret帶吸收強(qiáng)度逐漸降低,即使尿素濃度高達(dá)8.0 mol/L時(shí),其Soret帶和Q帶位置與形狀均未發(fā)生明顯變化。說(shuō)明尿素可以改變Hb和Cyt c的三維結(jié)構(gòu),使其發(fā)生構(gòu)象變化,但尿素的誘導(dǎo)去折疊能力較低,不能使Heme輔基解離。
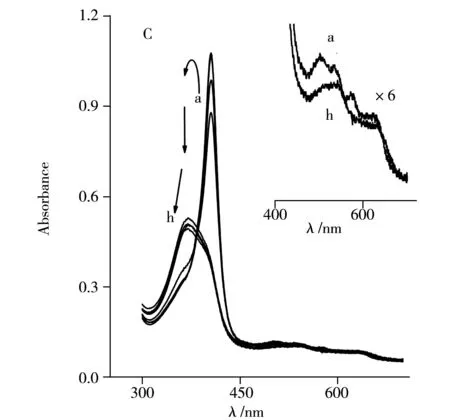
為進(jìn)一步研究?jī)烧邩?gòu)象的不同,使用具有更強(qiáng)去折疊能力的鹽酸胍作為誘導(dǎo)劑。如圖2C所示,當(dāng)鹽酸胍濃度在0~2.0 mol/L之間變化時(shí),Hb在406 nm的吸收譜帶先微弱增加而后下降,說(shuō)明Hb的三級(jí)結(jié)構(gòu)發(fā)生改變時(shí)其構(gòu)象發(fā)生重排和扭曲,使Hb的疏水空腔先緊密收縮,后發(fā)生構(gòu)象展開(kāi)。當(dāng)鹽酸胍濃度為3.0 mol/L時(shí),Hb在406 nm處的吸收峰消失,而在370 nm處出現(xiàn)一新的吸收峰,該峰歸屬于游離的Heme輔基的特征吸收。因此,在較高濃度鹽酸胍的作用下,Hb的構(gòu)象完全去折疊,Heme輔基發(fā)生解離后游離到溶液中。
然而,Cyt c卻表現(xiàn)出不同的去折疊行為。如圖2D所示,Cyt c在409 nm處的Soret吸收帶隨鹽酸胍濃度的改變先增加而后降低,該現(xiàn)象與Hb相似。但Soret吸收帶僅從409 nm輕微藍(lán)移至402 nm處,并未發(fā)生Hb Soret吸收帶的消失。這一現(xiàn)象說(shuō)明鹽酸胍能使Cyt c的結(jié)構(gòu)發(fā)生去折疊,但并不能導(dǎo)致Heme輔基從其肽鏈上解離。也進(jìn)一步說(shuō)明Heme輔基與Cyt c的肽鏈通過(guò)二硫鍵鍵合,非常穩(wěn)定地鍵合于肽鏈上。
通過(guò)Q帶的細(xì)微改變也可以表征上述過(guò)程。比較圖2A和C的插圖可以看出,尿素溶液中Hb的4個(gè)Q帶是Heme輔基與肽鏈配位后產(chǎn)生的吸收,當(dāng)其在鹽酸胍作用下發(fā)生解離后,游離Heme輔基則顯示兩個(gè)Q帶(圖2C的h曲線(xiàn))。這一現(xiàn)象是由于Heme輔基與肽鏈解離,對(duì)稱(chēng)性增加,卟啉環(huán)的Q帶個(gè)數(shù)會(huì)從4個(gè)減至2個(gè)。上述結(jié)果表明Hb與鹽酸胍作用后,Hb的Heme輔基易發(fā)生脫離。而Cyt c的Q帶在尿素和鹽酸胍的作用下未發(fā)生明顯改變(圖2B和D插圖),說(shuō)明Cyt c的結(jié)構(gòu)較為穩(wěn)定,且Heme輔基難以解離。
2.3Hb與Cyt c的構(gòu)象去折疊熒光光譜研究
熒光光譜技術(shù)是研究蛋白質(zhì)構(gòu)象變化的有效手段。多數(shù)蛋白含有色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)等具有熒光性質(zhì)的氨基酸殘基,其內(nèi)源熒光常用于表征蛋白質(zhì)的構(gòu)象及微環(huán)境的改變。Hb在每一個(gè)α和β肽鏈上含有3個(gè)色氨酸殘基[1]。Cyt c含有1個(gè)色氨酸和4個(gè)酪氨酸殘基(Tyr),其中色氨酸和兩個(gè)酪氨酸與血紅素輔基較為接近,其它包埋在疏水環(huán)境內(nèi)部。由于Hb和Cyt c含有Heme輔基,色氨酸激發(fā)態(tài)的能量向Heme輔基轉(zhuǎn)移,從而使其內(nèi)源熒光被Heme輔基猝滅。因此,天然態(tài)的Hb和Cyt c的熒光較弱。
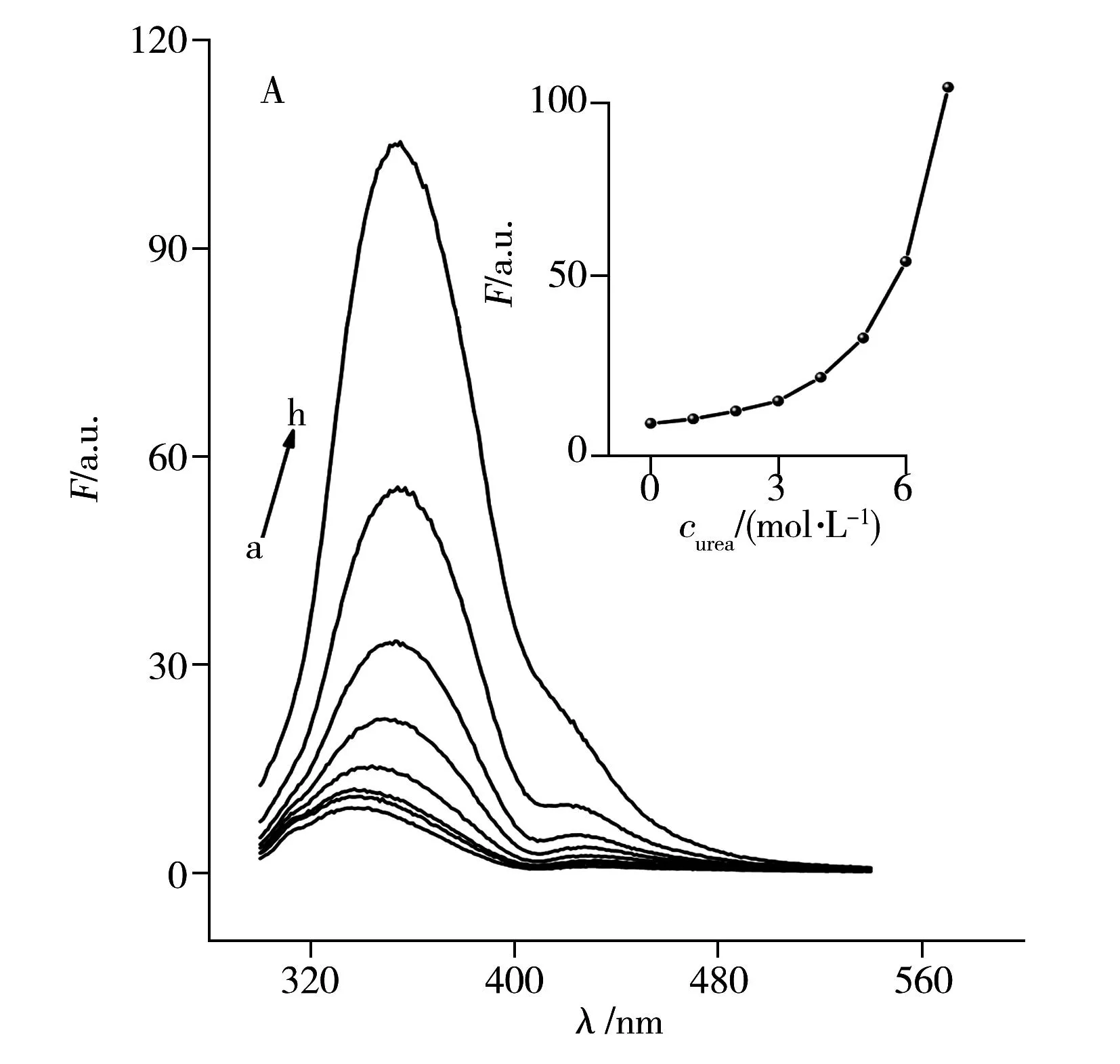
圖3 是Hb和Cyt c在尿素和鹽酸胍誘導(dǎo)去折疊過(guò)程中的熒光光譜變化圖。由圖3A及其插圖可以看出,激發(fā)波長(zhǎng)為280 nm時(shí),Hb顯示微弱的色氨酸熒光。在尿素誘導(dǎo)下,由于Hb的構(gòu)象逐漸展開(kāi),色氨酸與Heme輔基的距離增加致使熒光猝滅程度減弱,Hb的熒光逐漸增強(qiáng)。同時(shí),由于色氨酸逐漸裸露在極性環(huán)境中,最大熒光發(fā)射波長(zhǎng)發(fā)生紅移。
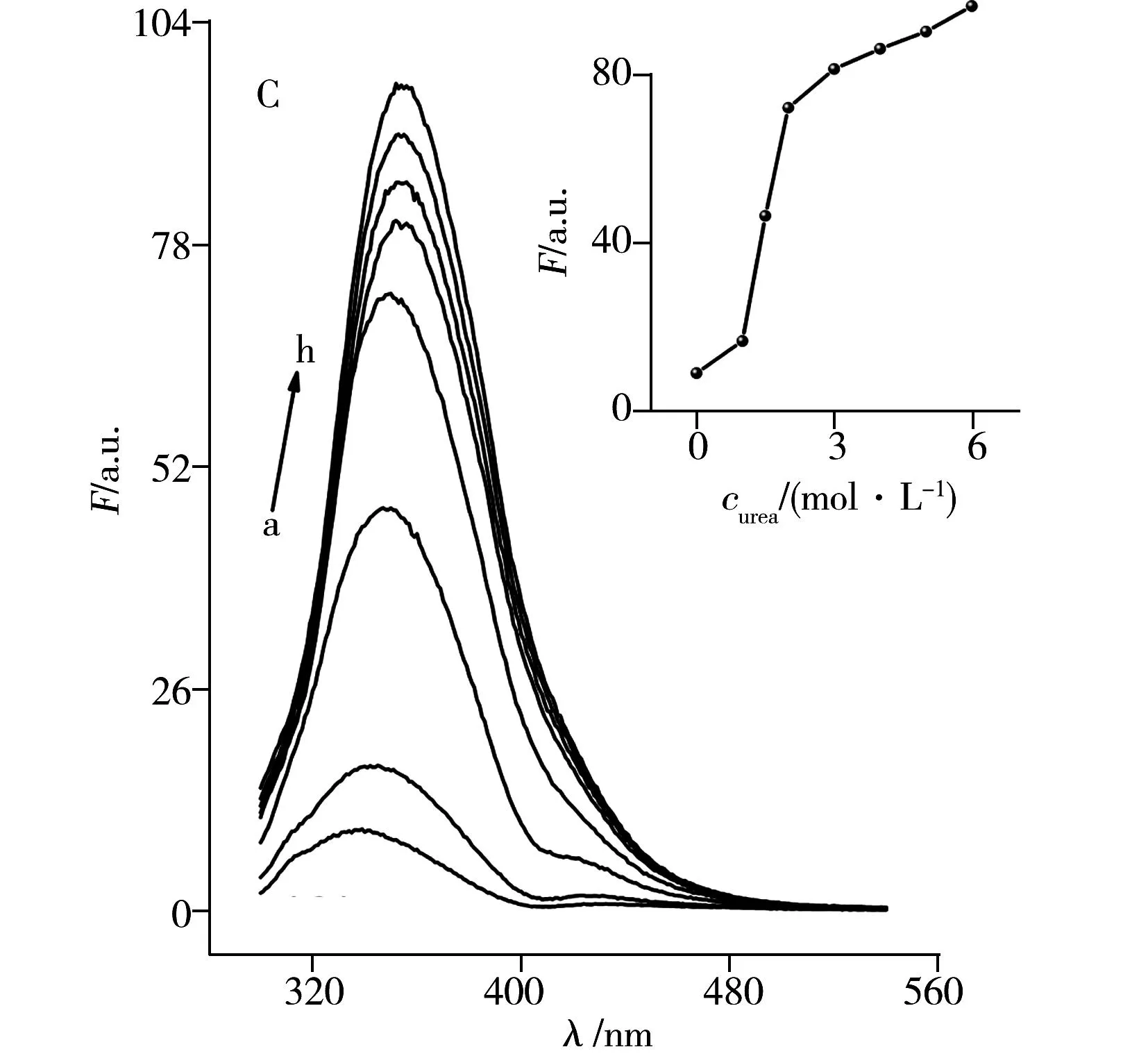
天然態(tài)的Cyt c在310 nm和355 nm處分別出現(xiàn)酪氨酸和色氨酸的熒光峰(圖3B)。由于Cyt c的酪氨酸殘基較多,其在280 nm激發(fā)時(shí),310 nm處出現(xiàn)酪氨酸的發(fā)射譜帶。根據(jù)熒光強(qiáng)度隨尿素濃度改變的曲線(xiàn),Cyt c的熒光在尿素濃度低于3.0 mol/L時(shí),色氨酸的熒光未發(fā)生明顯改變,說(shuō)明穩(wěn)定性強(qiáng)的Cyt c構(gòu)象變化較小,當(dāng)尿素濃度增加時(shí),其熒光強(qiáng)度逐漸增加,這與Hb的熒光變化趨勢(shì)相似。
圖3C和D分別是Hb和Cyt c在不同濃度的鹽酸胍溶液中的熒光光譜。與尿素作用后的熒光光譜相比(圖3A及插圖),在鹽酸胍濃度高于2.0 mol/L時(shí),Hb的熒光變化迅速減緩,說(shuō)明Hb此時(shí)逐漸完全去折疊,Heme輔基逐漸發(fā)生解離,色氨酸的熒光強(qiáng)度趨于最大。Cyt c的熒光隨鹽酸胍濃度的增大先緩慢增強(qiáng),后快速增加,說(shuō)明Cyt c的三維結(jié)構(gòu)起始時(shí)性質(zhì)較為穩(wěn)定,三維構(gòu)型逐漸打開(kāi)后,熒光出現(xiàn)快速增強(qiáng),這與尿素誘導(dǎo)去折疊時(shí)結(jié)果一致。而且,波長(zhǎng)位置的紅移進(jìn)一步說(shuō)明Cyt c通過(guò)二硫鍵與Heme輔基鍵合,使得輔基的穩(wěn)定性增加,即使較高濃度的強(qiáng)去折疊試劑也難以使Heme輔基脫落。
3結(jié)論
Hb和Cyt c均為含有Heme輔基的血紅素蛋白,但Heme輔基與肽鏈的結(jié)合方式不同。Hb的Heme輔基通過(guò)卟啉鐵與組氨酸配位包埋在蛋白的疏水空腔內(nèi)。Cyt c的Heme輔基不僅與卟啉鐵和組氨酸配位,且與半胱氨酸形成兩個(gè)硫醚鍵,配位后的Cyt c展現(xiàn)出十分穩(wěn)定的結(jié)構(gòu)和性質(zhì)。因此,在尿素和鹽酸胍化學(xué)變性劑的作用下呈現(xiàn)不同的去折疊行為。研究結(jié)果表明,尿素比鹽酸胍的去折疊能力弱、性能溫和,較高濃度的尿素難以使兩種蛋白完全去折疊,Heme輔基不會(huì)發(fā)生解離。而在鹽酸胍的作用下,Hb則因三維構(gòu)象完全去折疊使Heme輔基發(fā)生解離,Cyt c的Heme輔基不易解離。因此,本研究結(jié)果揭示了不同的蛋白結(jié)構(gòu)表現(xiàn)出不同的去折疊行為和機(jī)理,為解釋蛋白結(jié)構(gòu)與功能之間的關(guān)系提供了基礎(chǔ)。
參考文獻(xiàn):
[1]Shao Q,Wu P,Gu P,Xu X Q,Zhang H,Cai C X.J.Phys.Chem.B,2011,115:8627-8637.
[2]Ridgley D M,Claunch E C,Lee P W,Barone J R.Biomacromolecules,2014,15:1240-1247.
[3]Westerheide S D,Morimoto R I.J.Biol.Chem.,2005,280:33097-33100.
[4]Mai Z B,Zhao X J,Dai Z,Zou X Y.J.Phys.Chem.B,2010,114:7090-7097.
[5]Lin Y W,Huang Z X.Prog.Chem.(林英武,黃仲賢.化學(xué)進(jìn)展),2006,18(6):794-800.
[6]Wu H,Fan S H,Zhu W Y,Dai Z,Zou X Y.Biosens.Bioelectron.,2013,41:589-594.
[7]Ren Q Q,Yuan X J,Huang X R,Wen W,Zhao Y D,Chen W.Biosens.Bioeletron.,2013,50:318-324.
[8]Hristinsson H G,Hultin H O.J.Agric.FoodChem.,2004,52:3633-3643.
[9]Hou G W,Ma R N,Jia L P,Yao F,Huo R W,Li J,Wang H S.J.Instrum.Anal.(侯關(guān)偉,馬榮娜,賈麗萍,姚飛,霍瑞偉,李娟,王懷生.分析測(cè)試學(xué)報(bào)),2013,32(10):1166-1173.
[10]Ma L Y.Chin.J.CellBiol.(馬麗焱.細(xì)胞生物學(xué)雜志),2004,26(1):30-33.
[11]George S,Lee H K.J.Phys.Chem.B,2009,113:15445-15454.
[12]Ke X B,Shao R F,Zhu H Y,Yuan Y,Yang D J,Ratinac K R,Gao X P.Chem.Commun.(Camb),2009,14(10):1264-1266.
[13]Ma L,Wei Z Q,Huang A M,Yang H,He W R,Lin R S.ActaPhysico-ChimSin.(馬林,魏志強(qiáng),黃愛(ài)民,楊華,何維仁,林瑞森.物理化學(xué)學(xué)報(bào)),2009,25(9):1816-1822.
[14]Li X C,Zheng W,Zhang L M,Yu P,Lin Y Q,Su L,Mao L Q.Anal.Chem.,2009,81:8557-8563.
[15]Makhatadze G I.J.Phys.Chem.B,1999,103:4781-4785.

摘要:利用紫外-可見(jiàn)吸收和熒光光譜法研究了血紅蛋白(Hb)與細(xì)胞色素c(Cyt c)兩種血紅素蛋白的去折疊行為。采用化學(xué)變性劑鹽酸胍(GdHCl)和尿素(Urea)誘導(dǎo)兩種蛋白構(gòu)象去折疊,闡述了兩種蛋白的去折疊機(jī)理。Hb的血紅素(Heme)輔基通過(guò)與卟啉鐵原子和組氨酸配位,與肽鏈鍵合的穩(wěn)定性較差,在3.0 mol/L的鹽酸胍作用下即發(fā)生解離。而Cyt c的Heme輔基通過(guò)卟啉與半胱氨酸形成二硫鍵呈現(xiàn)較強(qiáng)的穩(wěn)定性,鹽酸胍濃度達(dá)到6.0 mol/L也難使其發(fā)生解離。該研究為闡釋蛋白構(gòu)象與功能之間的關(guān)系提供了重要依據(jù)。
關(guān)鍵詞:血紅蛋白;細(xì)胞色素c;蛋白;去折疊
Investigation on the Unfolding Behavior of Hemoglobin and Cytochrome c ConformationFAN Su-hua,SONG Yan-ling,SHEN Fang-ming,QIAO Meng-xia,ZHENG Tian-tian,ZHANG Hong,WU Hai*
(School of Chemistry and Materials Engineering,Fuyang Normal University,Fuyang236037,China)
Abstract:The unfolding processes of two hemoproteins including hemoglobin(Hb) and cytochrome c(Cyt c) were investigated by using UV-Vis absorption and fluorescence emission spectrometry.The unfolding behaviors of Hb and Cyt c were induced with two chemical denaturing agents of guanidine hydrochloride(GdHCl) and urea.Weak bonding energy between heme groups and the histidine on Hb peptide caused the poor stability of heme groups and their easier dissociation from the peptide of Hb only in 3.0 mol/L GdHCl.However,high bonding force due to the disulfide bond between heme group and cysteines on Cyt c peptide chain increased the stability of Cyt c.Heme group did not dissociate from Cyt c peptide with high concentration of 6.0 mol/L GdHCl.The research provides an important basis for the elaboration of relationship between protein functions and their conformations.
Key words:hemoglobin;cytochrome c;protein;unfolding
中圖分類(lèi)號(hào):O657.3;O629.73
文獻(xiàn)標(biāo)識(shí)碼:A
文章編號(hào):1004-4957(2015)12-1392-06
doi:10.3969/j.issn.1004-4957.2015.12.011
通訊作者:*武海,博士,副教授,研究方向:生物電分析化學(xué),Tel:0558-2596249,E-mail:wuhai317@126.com
基金項(xiàng)目:國(guó)家自然科學(xué)基金項(xiàng)目(21201037,21405019);安徽省自然科學(xué)基金項(xiàng)目(1408085QB39);安徽省質(zhì)量工程項(xiàng)目(2012jyxm339,2013jyxm140);安徽省教育廳重大教學(xué)改革項(xiàng)目(2014zdjy081)
收稿日期:2015-06-03;修回日期:2015-07-12

