力竭運動模型大鼠接受石菖蒲正丁醇提取物干預后紅細胞形態參數及免疫黏附變化
劉 云 李曉紅 朱洪竹 朱梅菊
(湖南工業大學體育學院,湖南 株洲 412000)
?
力竭運動模型大鼠接受石菖蒲正丁醇提取物干預后紅細胞形態參數及免疫黏附變化
劉云李曉紅朱洪竹1朱梅菊1
(湖南工業大學體育學院,湖南株洲412000)
摘要〔〕目的 探討石菖蒲正丁醇提取物對跑臺運動大鼠紅細胞(RBC)形態參數、免疫功能及自由基代謝的影響。方法6周齡SD大鼠隨機分為正常對照組、單純運動組、石菖蒲正丁醇提取物組、人參提取物組(運動+人參提取物組)。所有運動大鼠進行4 w的跑臺訓練,最后一次進行力竭跑臺。股動脈采血測定RBC形態和相關參數、RBC超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量及RBC免疫黏附功能(RBC C3b受體花環率和RBC免疫復合物花環率)等指標。結果實驗4 w后,RBC、血紅蛋白、血細胞比容、RBC中SOD活性、RBC C3b受體花環率和RBC免疫復合物花環率值明顯高于單純運動組,而平均RBC體積、RBC體積分布寬度、RBC中MDA含量和畸形RBC百分率顯著低于單純運動組(P<0.01,P<0.05)。結論石菖蒲正丁醇提取物具有改善耐力運動引起的大鼠貧血狀態、減輕RBC損傷、提高耐力運動大鼠RBC抗氧化能力和免疫功能等作用。
關鍵詞〔〕石菖蒲;免疫功能
1井岡山大學體育學院
第一作者: 劉云(1970-),男,博士,副教授,主要從事運動性疲勞與恢復方面的研究。
石菖蒲為歷代延年益智的要藥,《神農本草經》將其列為上品,屬于增力類中藥之一〔1〕。研究表明,該藥具有明顯的抗腦缺氧和提高小鼠力竭游泳時間的作用〔2〕。本課題前期研究表明,石菖蒲提取物能明顯提高大強度訓練小鼠的運動能力,使大強度耐力訓練小鼠體內糖貯備顯著增加〔3〕,并顯示石菖蒲體內抗運動性疲勞作用的活性部位主要集中在低極性的揮發油部分和極性較大的正丁醇及水部分〔4〕。人參是公認的抗運動性疲勞的中藥,本實驗以人參提取物為陽性對照,擬進一步探討石菖蒲正丁醇提取物對跑臺運動大鼠紅細胞(RBC)形態和形態參數、免疫功能及自由基代謝的影響。
1材料與方法
1.1材料實驗動物:SPF級健康雄性SD大鼠40只,鼠齡6 w,體質量(275.00±27.65)g,由廣東醫學院實驗動物中心提供。實驗動物許可證號:粵檢證字99A053號。所有的實驗程序遵守廣東省實驗動物管理委員會的相關規定。大鼠飼養的環境溫度25℃~26℃,濕度40%,光照12 h;自由飲食和飲水。石菖蒲正丁醇提取物按文獻〔4〕方法制備。從昆明市藥材局購買大理產石菖蒲1 kg,首先運用水蒸氣蒸餾法提取石菖蒲中揮發油,再用95%的乙醇熱提3次,減壓濃縮成浸膏,殘渣再用水煎煮3次,在60℃的水浴中濃縮成浸膏,依次得揮發油、乙醇提取物和水煎液。對乙醇提取物再依次用乙酸乙酯和正丁醇進行萃取,分別減壓濃縮成浸膏,得乙酸乙酯提取物、正丁醇提取物和正丁醇萃余物。將正丁醇提取物放4℃冰箱保存備用。
人參提取物的提取按文獻〔5〕方法進行。從昆明市藥材局購買人參100 g,首先運用石油醚分別熱提3次,減壓濃縮成浸膏;其殘渣先用體積分數95%的乙醇分別熱提3次,減壓濃縮成浸膏;然后再用水煎煮3次,在60℃的水浴中濃縮成浸膏。最后將此三者合并成混合提取物,放4℃冰箱保存備用。
1.2方法實驗動物適應性喂養2 d后,隨機分為正常對照組,單純運動組,人參提取物組和石菖蒲正丁醇提取物組,各10只。各組大鼠分籠飼養,自由飲食,室溫22℃~24℃。
1.2.1跑臺運動除正常對照組不進行任何運動訓練外,各組動物在小動物跑臺(天津運動醫學研究所研制)上進行跑臺訓練,訓練方案參照汶希等〔6〕介紹的大鼠運動性疲勞模型的建立。坡度為0°,運動訓練方案見表1,7次/w,連續4 w。第4周末除正常對照組外,其余各組大鼠均進行一次性力竭跑臺訓練。力竭標準為連續施加機械刺激大鼠不能繼續跑動,下跑臺后腹部觸地,嚴重呈“甲魚狀”。
1.2.2藥物干預人參提取物和石菖蒲正丁醇提取物分別用生理鹽水制備成水溶液,使用灌胃法。藥物劑量換算參照文獻〔7〕。以人參提取物(0.29 g/kg)和石菖蒲正丁醇提取物(0.62 g/kg)分別灌胃人參提取物組和石菖蒲正丁醇提取物。正常對照組和單純運動組以等體積(2 ml)生理鹽水灌胃,每天跑臺訓練前2 h灌胃1次。實驗時間4 w。
1.2.3RBC參數的測定力竭大鼠休息24 h后用1%戊巴比妥麻醉,腹主動脈采血,肝素抗凝,用日本產Symsex K-4500血細胞分析儀(Symsex Corporation,Kobe,日本)進行測定。檢測項目:RBC數量、血紅蛋白含量、血細胞比容、平均RBC體積,平均RBC血紅蛋白含量和RBC體積分布寬度。
1.2.4RBC掃描電鏡標本的制備將肝素抗凝血0.5 ml以1 000 r/min離心10 min,棄上清,加入0.86%NaCl溶液洗滌,離心,棄上清,共3次。2.5%戊二醛固定,體積分數95%乙醇梯度脫水,滴臺,CO2臨界點干燥,E-1010離子濺射儀(Philips Co.,Eindhoven,Netherlands)噴金,在PHILIPS XL30-EDAX掃描電子顯微鏡(Philips Co.,Eindhoven,Netherlands,日本)下進行RBC形態觀察,每個樣本觀察1 000個RBC,參照潘力等〔8〕報道的RBC形態分類方法觀察RBC的形態,計算畸形RBC比例。
1.2.5RBC中超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量的測定SOD活性采用黃嘌呤氧化酶法(測定。MDA含量采用硫代巴比妥酸法測定。蛋白質含量采用考馬斯亮藍G-250法測定。SOD測試盒及MDA測試盒為南京建成生物工程研究所產品,所有操作均嚴格按照說明書進行。
1.2.6RBC補體3b(C3b)受體花環率和RBC免疫復合物花環率的檢測按照郭峰等〔9〕建立的RBC C3b受體花環和免疫復合物花環實驗,分別測定RBC C3b受體花環率和RBC免疫復合物花環率。以RBC黏附2個以上(含2個)酵母多糖為一朵花環,均衡計數200個RBC,計算出花環率。酵母多糖凍干試劑由第二軍醫大學長海醫院血液免疫室提供。
1.3統計學方法應用SPSS17.0軟件進行單因素方差分析。
表1大鼠運動訓練方案(m/min×min)

周次星期一星期二星期三星期四星期五星期六星期日第一周15×1515×1518×2018×2020×2520×2520×25第二周22×2522×2523×3023×3024×3024×3024×30第三周25×3025×3026×3026×3026×3026×3026×30第四周27×3127×3227×3227×3228×3228×3228×32
2結果
實驗過程中除正常對照組外,其余各組均死亡2只。
2.1石菖蒲正丁醇提取物對運動大鼠RBC參數的影響與正常對照組相比,單純運動組大鼠RBC數量、血紅蛋白含量、血細胞比容和平均RBC血紅蛋白含量明顯降低(P<0.01),而平均RBC體積和RBC體積分布寬度顯著增加(P<0.01);與單純運動組相比,石菖蒲正丁醇提取物組和人參提取物組大鼠RBC數量、血紅蛋白含量、血細胞比容和平均RBC血紅蛋白含量增加(P<0.01,P<0.05),而平均RBC體積和RBC體積分布寬度減少(P<0.01);且石菖蒲正丁醇提取物組大鼠血細胞比容低于人參提取物組(P<0.05),平均RBC體積和RBC體積分布寬度高于人參提取物組(P<0.01,P<0.05)。見表2,圖1。
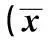

組別nRBC數量(×1012/L)血紅蛋白(g/L)血細胞比容(%)平均RBC體積(fl)平均RBC血紅蛋白(pg)RBC體積分布寬度(%)正常對照組109.56±0.32143.90±5.450.52±0.0650.20±1.9315.16±0.658.88±0.55單純運動組87.83±0.922)107.80±15.732)0.32±0.042)62.60±6.522)11.37±0.882)13.16±0.952)石菖蒲正丁醇提取物組88.93±0.441)4)120.90±14.782)3)0.38±0.052)4)5)56.20±4.591)4)5)13.41±0.751)4)10.59±0.832)4)6)人參提取物組89.22±0.394)129.10±11.194)0.43±0.052)4)51.70±3.494)13.64±0.764)9.50±0.454)
與正常對照組相比:1)P<0.05,2)P<0.01;與單純運動組相比:3)P<0.05,4)P<0.01;與人參提取物組相比:5)P<0.05,6)P<0.01

A,E為正常對照組;B,F為單純運動組;C,G為石菖蒲正丁醇提取物組;D,H為人參提取物組;A~D為×8 000,E~H為×3 000 圖1 大鼠外周血RBC形態
2.2石菖蒲正丁醇提取物對運動大鼠RBC形態的影響與正常對照組〔(11.80±3.30)%〕相比,單純運動組大鼠外周血RBC畸形率〔(41.60±7.40)%〕顯著上升(P<0.01);而與單純運動組相比,石菖蒲正丁醇提取物組〔(28.90±7.80)%〕和人參提取物組〔(20.80±8.90)%〕大鼠外周血RBC畸形率明顯下降(P<0.01);且石菖蒲正丁醇提取物組大鼠外周血RBC畸形率高于人參提取物組(P<0.05)。
2.3石菖蒲正丁醇提取物對運動大鼠RBC免疫黏附功能的影響與正常對照組比較,單純運動組大鼠RBC C3b受體花環率值和RBC免疫復合物花環率值顯著降低(P<0.01)。與單純運動組比較,石菖蒲正丁醇提取物組和人參提取物組大鼠RBC C3b受體花環率和RBC免疫復合物花環率值明顯升高(均P<0.01),但石菖蒲正丁醇提取物組和人參提取物組間RBC C3b受體花環率比較無顯著性差異(P>0.05);石菖蒲正丁醇提取物組和人參提取物組間RBC免疫復合物花環率低于人參提取物組(P<0.05)。見表3。
2.4石菖蒲正丁醇提取物對運動大鼠RBC自由基代謝的影響與正常對照組比較,單純運動組大鼠RBC SOD酶活性明顯降低,MDA水平顯著升高(P<0.01)。與單純運動組比較,石菖蒲正丁醇提取物組和人參提取物組大鼠RBC SOD酶活性明顯升高,MDA水平明顯降低(均P<0.01)。石菖蒲正丁醇提取物組大鼠RBC SOD酶活性低于人參提取物組,MDA水平高于人參提取物組(均P<0.01)。見表3。
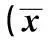

組別nSOD(U/ml)MDA(nmol/ml)RBCC3b受體花環率(%)RBC免疫復合物花環率(%)正常對照組10141.10±12.401.33±0.0812.10±1.6725.90±1.97單純運動組896.30±12.891)3.45±0.341)8.90±1.191)16.90±1.671)石菖蒲正丁醇提取物組8110.50±15.721)2)4)2.56±0.201)2)4)15.10±1.191)2)25.00±2.002)3)人參提取物組8134.30±15.741)2)1.95±0.161)2)15.00±1.831)2)26.80±1.932)
與正常對照組相比:1)P<0.01;與單純運動組相比:2)P<0.01;與人參提取物組相比:3)P<0.05,4)P<0.01
3討論
RBC是人體血液中的主要有形成分,在運動過程中它是決定運動員最大攝氧量的主要因素。血紅蛋白的主要作用是運輸氧氣,供組織利用,因此它是公認的監測機體耐力運動能力的主要指標之一〔10〕。但是血紅蛋白只有存在于RBC內才能發揮作用,如果RBC被破壞,血紅蛋白也就喪失其作用,一旦RBC受到損害,RBC的運氧能力下降,機體容易產生疲勞,嚴重影響運動能力。RBC、血紅蛋白、血細胞比容是醫學界公認的診斷貧血的重要標準之一〔11〕。平均RBC體積和RBC體積分布寬度是國內外作為觀察RBC形態的重要指標,能準確反映RBC的變形及損傷程度〔12〕。本實驗提示通過5 w遞增大強度跑臺運動大鼠出現了較明顯的貧血,并推測這種貧血不是由機體血漿體積適應性擴增引起的,而是由于遞增大強度耐力訓練造成RBC損傷所致〔13〕。RBC的掃描電鏡觀察結果也支持這種觀點。石菖蒲正丁醇提取物可能通過抵抗運動造成的RBC損傷,改善由于長時間遞增大強度跑臺運動所致的貧血狀態。
眾多研究表明氧化應激會導致RBC的損傷〔14〕。RBC MDA含量的增加不僅會導致RBC膜的脂質過氧化,既而造成RBC的損傷,而且還會修飾RBC膜蛋白,如膜收縮蛋白(spectrins)和帶3(band 3)蛋白,而引起RBC的損傷〔15〕。研究表明大強度運動訓練可以導致RBC和白細胞的氧化應激,高強度運動訓練使身體持續置于高水平的氧化應激之中,從而造成RBC的氧化損傷〔16〕。本項研究提示遞增大強度跑臺訓練大鼠RBC出現了較明顯的氧化應激損傷。石菖蒲正丁醇提取物可通過提高RBC SOD酶活性,降低RBC中MDA含量,從而減輕遞增大強度耐力訓練引起的RBC氧化損傷。
運動對RBC免疫功能的影響及其調控是運動醫學界較新的研究領域。人體大約有95%的循環C3b受體存在于RBC中表面,RBC膜上的C3b受體能夠黏附抗原-抗體-補體復合物,并將其攜帶至肝、脾被吞噬細胞吞噬清除〔17〕,是機體免疫系統的重要組成部分。研究表明大強度耐力訓練后小鼠RBC C3b受體活性降低,RBC黏附循環免疫復合物的能力降低〔18〕。實驗結果亦提示大強度耐力訓練能導致RBC免疫功能降低,推測這可能與大強度耐力訓練引起RBC的氧化損傷,破壞了RBC的正常形態等有關〔19〕。石菖蒲正丁醇提取物能減輕耐力訓練引起的RBC氧化損傷,使更多的RBC具有正常的形態和功能,RBC黏附循環免疫復合物的能力提高,以促使耐力訓練所致的RBC免疫功能降低得到改善。因此,石菖蒲正丁醇提取物組RBC C3b受體活性和RBC黏附循環免疫復合物的能力顯著高于單純運動組。
石菖蒲為天南星科菖蒲屬植物石菖蒲的干燥根莖,是歷代延年、益智的要藥,《神農本草經》將其列為上品,屬于增力類中藥之一。研究表明,該藥具有明顯的抗腦缺氧和提高小鼠力竭游泳時間的作用〔2,3〕。本實驗結果表明石菖蒲提取物不但能提高小鼠的運動能力,而且能有效地改善運動引起的貧血狀態〔20〕,并提示石菖蒲改善機體貧血狀態的有效部位可能主要集中在其正丁醇部分。5-羥甲基糠醛是石菖蒲正丁醇提取物中含量較大的活性成分,不但具有較強的抗氧化能力,而且還能顯著促進RBC的代謝,抵抗由過氧化氫介導的肝細胞損傷〔21〕。因此推測石菖蒲正丁醇提取物提高大強度耐力訓練大鼠RBC的抗氧化能力、保護RBC、改善大鼠的貧血狀態可能與5-羥甲基糠醛等有關,這有待進一步研究。
參考文獻4
1斗力,翁維健.中醫古本草增力類營養保健品的立法特色及其應用〔J〕.中國運動醫學雜志,1990;9(1):1-7.
2胡錦宮,顧健,王志旺.石菖蒲及其有效成分對中樞神經系統作用的實驗研究〔J〕.中藥藥理與臨床,1999;15(3):19-21.
3熊靜宇,朱梅菊,廖興盛.石菖蒲提取物對小鼠運動能力及糖貯備的影響〔J〕.中醫研究,2009;22(6):11-3.
4朱梅菊,譚寧華,陳斌,等.石菖蒲不同萃取部位抗運動性疲勞的體內活性篩選研究〔J〕.湛江師范學院學報,2009;30(6):108-11.
5朱梅菊,譚寧華,朱洪竹,等.三色馬先蒿、決明子、連翹抗運動性疲勞的活性研究〔J〕.井岡山大學學報(自然科學版),2012;33(5):71-4.
6汶希,潘華山,馮毅翀.大鼠運動性疲勞模型的建立〔J〕.中國實驗動物學報,2009;17(5):368-72.
7賀石林.中醫科研設計與統計方法〔M〕.長沙:湖南科學技術出版社,1988:55-6.
8潘力,崔新明,崔麗,等.高脂血癥大鼠紅細胞掃描電鏡觀察〔J〕.白求恩醫科大學學報,2001;27(2):124-6.
9郭峰,錢寶華,張樂之.現代紅細胞免疫學〔M〕.上海:第二軍醫大學出版社,2002:262-4.
10Cai RL,Yang MH,Shi Y,etal.Antifatigue activity of phenylethanoid-rich extract from Cistanche deserticola〔J〕.Phytother Res,2010;24(2):313-5.
11李海偉,高維緯,萬小艷,等.恒強旋轉磁場對運動性貧血大鼠骨髓紅系增生的作用研究〔J〕.北京體育大學學報,2011;34(12):55-8.
12Schumacher YO,Schmid A,Grathwohl D,etal.Hematological indices and iron status in athletes of various sports and performance〔J〕.Med Sci Sports Exerc,2002;34(5):869-75.
13朱梅菊,肖發強.大負荷訓練后大鼠紅細胞形態學的變化規律及針灸的促恢復作用〔J〕.北京體育大學學報,2006;29(7):928-33.
14袁濤,叢宇,趙建寧,等.亞油酸與紅細胞急性損傷:人工關節置換后隱性失血的發病機制〔J〕.中國組織工程研究,2014;18(48):7739-43.
15熊延連,熊艷蕾,李遙金,等.力竭運動誘導的氧化應激對大鼠紅細胞Band 3蛋白的影響及其機制探討〔J〕.中國細胞生物學學報,2014;36(5):617-23.
16Sured AA,Tauler P,Aguito A,etal.Relation between oxidative stress markers and antioxidant endogenous defences during exaustive exercise〔J〕.Free Radic Res,2005;39(12):1317-24.
17Lindorfer MA,Hahn CS,Foley PL,etal.Heteropolymei-mediated clearance of immune complexes vaierythrocyte CR1:mechanisms and applications〔J〕.Immunol Rev,2001;183(1):10-24.
18劉燕,黃元汛,陳筱春,等.白藜蘆醇對6 w耐力訓練小鼠紅細胞形態、抗氧化和免疫功能的影響〔J〕.體育科學,2007;27(12):53-6.
19Zhu M,Tan N,Zhu H,etal.Anti-sports anaemia effects of verbascoside and martynoside in mice〔J〕.Int J Sports Med,2010;31(18):537-41.
20熊靜宇,朱梅菊,鄒旭平.石菖蒲提取物對運動小鼠血液學指標的影響〔J〕.湘潭師范學院學報(自然科學版),2009;31(2):53-4.
21Ding X,Wang MY,Yao YX,etal.Protective effect of 5-hydroxymethylfurfural derived from processed Fructus Corni on human hepatocyte LO2 injured by hydrogen peroxide and its mechanism〔J〕.J Ethnopharmacol,2010;128(2):373-6.
〔2015-06-17修回〕
(編輯袁左鳴)
The effects of n-BuOH extracts from Acorus Tatarinowii Schott on morphology parameters, antioxidation and immunity capacity of erythrocytes in exhaustion exercised rats
LIU Yun, LI Xiao-Hong,ZHU Hong-Zhu,etal.
Institute of PE,Hunan University of Technology, Zhuzhou 412000, Hunan, China
【Abstract】ObjectiveTo study the effects of n-BuOH extracts from Acorus tatarinowii Schott on morphology,morphological indexes, antioxidation and immunity capacity of erythrocytes in exercised rats.MethodsThe six-week old rats were divided randomly into normal, exercise, exercise+Ginseng extract(serving as positive control group), exercise+ n-BuOH extracts from Acorus tatarinowii Schott groups. The exercised rats had treadmill running for 4 weeks, and at the last time they run exhaustively. The morphology and morphological indexes of erythrocyte, function of erythrocyte immune and antioxidation were tested after treadmill running exhaustively.Resultsn-BuOH extracts from Acorus tatarinowii Schott increased the counts of RBC, the contents of Hb, the value of HCT, the percentage of RBC-C3bR and RBC-ICR and the activity of RBC-SOD ,decreasing the value of MCV and RDW, RBC-MDA contents and the percentage of misshapen RBCs compared to those of exercised group (P<0.01,P<0.05).Conclusionsn-BuOH extracts from Acorus tatarinowii Schott are effective on ameliorating anemia, protecting morphological integrity of erythrocyte from injury by endurance exercise and improving antioxidation and immunity capacity of erythrocytes in rats by endurance exercise.
【Key words】Acorus tatarinowii Schott; Immunity function
通訊作者:李曉紅(1974-),女,講師,碩士,主要從事學校體育學研究。
基金項目:國家自然科學基金項目(31160217, 31360255);廣東省自然科學基金項目(10152404801000008)
中圖分類號〔〕R28〔
文獻標識碼〕A〔
文章編號〕1005-9202(2015)23-6662-04;doi:10.3969/j.issn.1005-9202.2015.23.009

