1-磷酸鞘氨醇受體2抑制脂多糖誘導的急性肺損傷*
李秀國, 延光海, 張永吉, 多久和陽, 崔 弘△
(1延邊大學醫學院,吉林 延吉 133002; 2金澤大學大學院醫學部循環醫科學血管分子生理學,日本 金澤 920-8640)
?
1-磷酸鞘氨醇受體2抑制脂多糖誘導的急性肺損傷*
李秀國1,延光海1,張永吉1,多久和陽2,崔弘1△
(1延邊大學醫學院,吉林 延吉 133002;2金澤大學大學院醫學部循環醫科學血管分子生理學,日本 金澤 920-8640)
[摘要]目的: 探討1-磷酸鞘氨醇受體2(S1P2R)對脂多糖(LPS)誘導的急性肺損傷(ALI)中的作用及機制。方法: 野生小鼠和S1pr2-/-小鼠經氣管滴注LPS,建立急性肺損傷動物模型。LPS注射24 h時觀察肺組織的病理改變,測定支氣管肺泡灌洗液(BALF)中的蛋白濃度、總細胞數、中性粒細胞的比值及TNF-α、IL-6細胞因子的表達。為了觀察S1P2R在肺損傷中的作用機制,LPS注射10 min前野生小鼠和S1pr2-/-小鼠經尾靜脈注射一氧化氮合酶抑制劑L-NAME,LPS注射12 h時,再觀察肺的病理組織學變化以及BALF中的蛋白濃度,總細胞數及TNF-α、IL-6細胞因子表達的變化。結果: 與野生小鼠比較,S1pr2-/-小鼠惡化LPS誘導的急性肺損傷,BALF中的蛋白濃度、總細胞數,中性粒細胞比值及炎癥細胞因子表達顯著增加。而L-NAME的預處理顯著抑制在S1pr2-/-小鼠LPS誘導加重的急性肺損傷。結論: S1P2R通過抑制NO合成,維持血管屏障,從而抑制急性肺損傷。
[關鍵詞]1-磷酸鞘氨醇受體2; 急性肺損傷; 一氧化氮
1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)是鞘磷脂的代謝產物之一,是目前備受關注的脂質信號分子,是一種具有多種生物學功能的溶血磷脂,廣泛存在于血液、淋巴液、紅細胞、中性粒細胞、血小板等體液和細胞中[1],通過細胞表面特定的受體而調控細胞的增殖、運動、存活、細胞間黏附、細胞分化等多種重要的生物學作用[2-3]。S1P通過細胞膜表面特異的受體G蛋白偶聯受體與1-磷酸鞘氨醇受體1(sphingosine-1-phosphate receptor-1, S1P1R)、S1P2R、S1P3R、S1P4R、S1P5R 結合發揮其生物學作用[4]。近年來研究發現,S1P/鞘氨醇激酶 (sphingosine kinase,SPHK)信號通路通過參與多種細胞的炎癥機制以及內皮細胞屏障保護功能對肺部疾病的病理生理改變發揮其重要作用[5-6],但是確切機制尚不完全明了。本實驗主要研究,在血管內皮細胞中高表達的S1P2R對LPS誘導的急性肺損傷(acute lung injury,ALI)小鼠的作用及其機制。
材料和方法
1材料
實驗動物選用8~10周齡S1pr2-/-小鼠及同窩出生的野生小鼠(C57BL/6J),雌雄各半,體質量為22~25 g,由金澤大學醫學部實驗動物中心提供。脂多糖(lipopolysaccharide,LPS)和N-硝基-L-精氨酸甲酯(Nω-nitro-L-arginine methyl ester,L-NAME)購自Sigma;ELISA試劑盒購自RB。
2方法
2.1急性肺損傷模型的建立小鼠乙醚麻醉,進行頸部切開,暴露氣管,用27G注射針經氣管滴注100 μL LPS溶液(溶于生理鹽水,給藥劑量4 mg/kg),而后將小鼠直立,垂直旋轉小鼠,使藥物在肺內均勻分布,然后頸部皮膚縫合。陰性對照組為氣管內滴注100 μL生理鹽水。L-NAME(25 g/L生理鹽水)預處理組在LPS注射10 min前經尾靜脈注射L-NAME。
2.2肺組織病理檢查經氣管滴注LPS 12 h或24 h時將小鼠腹腔注射戊巴比妥鈉30 mg/kg,進行麻醉,打開腹腔,腹主動脈切斷,放血。暴露氣管和肺,用1根導管插入氣管,結扎固定后,以距水平20 cm高度注入4%多聚甲醛進行內固定。內固定后拔出導管,結扎氣管,將全肺置于4%多聚甲醛中固定24 h,然后將肺組織常規脫水,石蠟包埋,切片,HE染色,二甲苯透明,中性樹膠封片。光鏡下觀察肺組織炎性細胞浸潤、水腫以及損傷情況。
2.3支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)的收集經氣管滴注LPS 12 h或24 h時將小鼠腹腔注射戊巴比妥鈉50 mg/kg,進行安樂死后,暴露氣管,用一次性靜脈留置針進行氣管插管,絲線結扎固定,然后取生理鹽水用1 mL注射器進行支氣管肺泡灌洗。每次取1 mL生理鹽水,經氣管套管沖洗雙側支氣管肺泡,反復注入、回收3次后收灌洗液,重復3次,回收率超過80%。將BALF以4 ℃、150×g離心10 min,取上清,保存于-80 ℃凍存,備測生化指標,細胞進行分類計數。
2.4BALF的蛋白濃度測定取-80 ℃凍存BALF上清液,室溫水浴快速化凍,Lowry法進行蛋白含量測定。
2.5BALF的細胞分類計數將BALF細胞沉淀以100 μL生理鹽水重懸,取10 μL懸液與臺盼藍混勻,于血球計數板上行細胞計數。100 μL PBS重懸后經細胞涂片機涂片,晾干后瑞氏快速染色。光學顯微鏡下細胞分類計數,取300個細胞,計算中性粒細胞等炎性細胞所占的百分比。
2.6BALF中TNF-α和IL-6測定取-80 ℃凍存BALF上清液,室溫水浴快速化凍,按試劑盒操作說明書分別進行TNF-α和IL-6測定。
3統計學處理
實驗數據以均數±標準差(mean±SD)表示,采用GraphPad Prism軟件進行統計分析,多組間比較采用單因素方差分析,組間比較采用t檢驗,以P<0.05為差異有統計學意義。
結果
1S1P2R對LPS誘導的肺損傷的作用
1.1肺組織病理變化野生型和S1pr2-/-小鼠經氣管注射LPS 24 h時,病理切片檢查結果表明,模型組肺組織呈現典型的ALI病理改變,炎癥細胞浸潤,間質肥厚,肺泡水腫等血管通透性亢進型急性肺損傷的病理現象。與野生小鼠比較S1pr2-/-小鼠更加顯著,表明S1P2R基因缺陷惡化LPS誘導的肺損傷,見圖1。
1.2BALF中蛋白含量和細胞數測定LPS波及的肺泡腔炎癥,通過測定BALF中的蛋白濃度、總細胞數以及中性粒細胞比值進行評價。野生型和S1pr2-/-小鼠經氣管內注射LPS 24 h時,發現BALF中的總蛋白濃度、總細胞數以及中性粒細胞比值都顯著增加(P<0.01),見圖2。
1.3BALF中TNF-α和IL-6的測定LPS使肺內大量單核巨噬細胞、淋巴細胞聚集和過度活化,引起嚴重的肺部炎癥。野生型和S1pr2-/-小鼠經氣管內注射LPS 24 h時,發現BALF中的TNF-α和IL-6細胞因子表達顯著增高,見圖3。
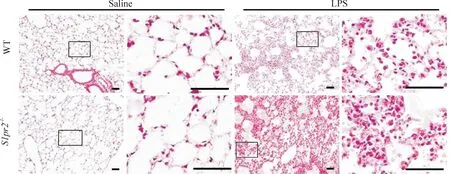
Figure 1.The effects ofS1P2Rdeficiency on LPS-induced ALI. The presentative images of HE-stained sections of the lung were showed. The scale bar=50 μm.
圖1S1P2R基因缺失對LPS誘導的急性肺損傷的作用

Figure 2.The effects ofS1P2Rdeficiency on LPS-induced increases in total protein concentration, total cell number and neutrophil infiltration in BALF.Mean±SD.n=5.**P< 0.01vssaline;##P<0.01vsWT group.
圖2S1P2R基因缺失增加BALF中LPS誘導的總蛋白濃度,總細胞數和中性粒細胞浸潤
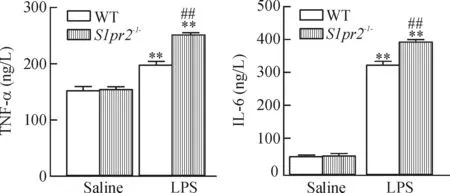
Figure 3.The effects ofS1P2Rdeficiency on LPS-induced changes of TNF-α and IL-6 in BALF.Mean±SD.n=5.**P<0.01vssaline;##P< 0.01vsWT.
圖3S1P2R基因缺失對LPS誘導的BALF中TNF-α和IL-6表達的影響
2L-NAME在S1pr2-/-小鼠LPS誘導的急性肺損傷中的作用
2.1肺組織的病理變化LPS注射10 min前小鼠行尾靜脈注射L-NAME,檢測一氧化氮合酶抑制劑在S1pr2-/-小鼠LPS誘導的肺損傷中的作用。LPS注射12 h時,在野生小鼠和S1pr2-/-小鼠的肺組織中發現炎癥細胞浸潤、間質肥厚等肺組織的ALI病理改變,與野生小鼠比較,在S1pr2-/-小鼠中更加嚴重。而L-NAME預處理顯著抑制在S1pr2-/-小鼠中LPS誘導加重的急性肺損傷,見圖4。

Figure 4.The effects of L-NAME on LPS-induced acute lung injury in WT andS1pr2-/-mice. The representative images of HE-stained sections of lung were showed. The scale bar=100 μm.
圖4L-NAME在野生小鼠和S1pr2-/-小鼠LPS誘導的急性肺損傷中的作用
2.2BALF中蛋白含量、細胞數及TNF-α、IL-6測定LPS注射12 h時,L-NAME預處理顯著減少了在S1pr2-/-小鼠BALF中蛋白濃度、總細胞數以及TNF-α、IL-6表達的增加,見圖5、6。
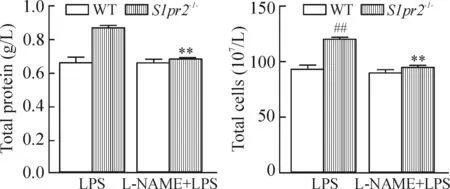
Figure 5.The effects of L-NAME on LPS-induced increases in total protein concentration and total cell number in BALF.Mean±SD.n=5.**P<0.01vsLPS;##P<0.01vsWT.
圖5L-NAME對LPS誘導增加的BALF中蛋白濃度和總細胞數的影響
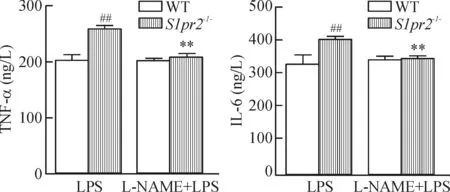
Figure 6. Effects of L-NAME on LPS-induced increases in TNF-α and IL-6 level in BALF. Mean±SD.n= 5.**P< 0.01vsLPS;##P<0.01vsWT.
圖6L-NAME對LPS誘導增加的BALF中TNF-α和IL-6表達的影響
以上結果表明,S1P2R基因表達的缺失使LPS誘導的急性肺損傷惡化,而這與一氧化氮合酶生成的一氧化氮(nitric oxide,NO)有關。
討論
S1P通過與G蛋白偶聯的S1P受體發揮作用,研究證實S1P通過激活不同受體的信號途徑對肺部疾病的發生發展起重要作用[7]。Milara等[8]研究發現S1P通過激活Gi蛋白和細胞內Ca2+-PLD-ERK1/2信號通路,促使肺泡上皮細胞分泌IL-8和ICAM-1表達增加。在脂多糖誘導的巨噬細胞炎癥模型中,S1P可使巨噬細胞從促炎作用向抗炎作用轉換,且引起TNF-α、IL-12等促炎因子減少[5]。LPS誘導的小鼠肺損傷模型中也可發現S1P和S1PR1選擇性激動劑可通過對肺血管通透性的保護作用降低炎癥誘導的肺滲漏[9-10]。在急性肺損傷的病理過程中,S1P發揮及其重要作用。但是S1P1R以外的S1P受體在急性肺損傷中的作用尚不清楚。LPS誘導的肺損傷模型廣泛應用于急性肺損傷研究。LPS激活肺泡上皮細胞和巨噬細胞等,進而釋放出TNF-α、 IL-6等炎癥細胞因子及組織損傷性物質,導致血管內皮細胞損傷,同時肺泡上皮細胞損傷,最后引起血管通透性升高,造成水腫及大量單核巨噬細胞、中性粒細胞等炎癥細胞浸潤[11-12]。
本研究主要關注在血管內皮中高表達的S1P2R,利用S1P2R基因敲除小鼠,觀察LPS誘導的急性肺損傷中S1P2R的作用及其作用機制,發現與野生小鼠比較,S1pr2-/-小鼠在LPS誘導的急性肺損傷中病情更加惡化。LPS氣管內注射24 h時,在野生小鼠和S1pr2-/-小鼠的肺組織中發現了LPS誘導的肺泡水腫,肺泡壁肥厚以及炎癥細胞浸潤等血管通透性亢進型急性肺損傷的病理現象,與野生小鼠比較,S1pr2-/-小鼠更加嚴重。LPS誘導BALF中的總蛋白濃度、總細胞數以及中性粒細胞增加,與野生小鼠比較,在S1pr2-/-小鼠中更加顯著。同樣,LPS注射后與野生小鼠比較,BALF中TNF-α和IL-6炎癥因子表達在S1pr2-/-小鼠顯著增加。以上結果表明,S1P2R基因缺失小鼠在LPS誘導的急性肺損傷中病情惡化,S1P2R在減輕LPS誘導的急性肺損傷中發揮保護作用。
最近的研究表明,NO在炎癥反應和微血管通透性增加過程中起重要的作用[13-14]。本研究探討一氧化氮合酶抑制劑L-NAME在S1pr2-/-小鼠中LPS誘導的急性肺損傷的作用。發現在S1pr2-/-小鼠經L-NAME預處理后,發生LPS誘導的急性肺損傷時BALF中的總蛋白濃度、細胞總數以及TNF-α和IL-6細胞因子表達顯著被抑制。相反,在野生小鼠中L-NAME的效果不顯著。可知S1P2R基因缺失導致的血管通透性亢進和炎癥細胞浸潤,與一氧化氮合酶的生成是不可分的。一氧化氮合酶分為內皮型一氧化氮合酶(eNOS)、神經型一氧化氮合酶(nNOS)和誘導型一氧化氮合酶(iNOS)[15-16]。主要表達在血管內皮細胞的eNOS和表達在炎癥細胞、肺泡巨噬細胞及肺泡上皮細胞的iNOS,可能參與S1P2R基因缺失導致血管通透性亢進的病理過程。本課題組在最近的研究中發現,S1pr2-/-小鼠全身過敏反應動物模型以及體外培養細胞實驗中,在血管內皮表達的S1P2R介導抑制Akt/eNOS信號傳導途徑,抑制血管通透性[17]。S1pr2-/-小鼠惡化LPS誘導的肺損傷可能也與S1P2R基因缺失而激活內皮細胞的Akt/eNOS信號通路有關,而產生過多的NO引起血管通透性亢進,具體的作用信號途徑有待進一步研究。
本研究證實了S1P2R在急性肺損傷等病態血管通透性亢進中的重要作用,S1P2R通過抑制一氧化氮合酶,進而抑制LPS誘導的急性肺損傷。S1P2R選擇性激動劑可能成為治療急性肺損傷新的藥物。
[參考文獻]
[1]Yatomi Y, Igarashi Y, Yang L, et al. Sphingosine 1-phosphate, a bioactive sphingolipid abundantly stored in platelets, is a normal constituent of human plasma and serum[J]. J Biochem, 1997,121(5): 969-973.
[2]Takuwa Y, Okamoto Y, Yoshioka K, et al.Sphingosine-1-phosphate signaling and biological activities in the cardiovascular system[J]. Biochim Biophys Acta, 2008,1781(9): 483-488.
[3]Takuwa Y, Okamoto Y, Yoshioka K, et al.Sphingosine-1-phosphate signaling in physiology and diseases[J].Biofactors, 2012, 38(5):329-337.
[4]Spiegel S, Milstien S. Functions of the multifaceted family of sphingosine kinases and some close relatives[J]. J Biol Chem, 2007, 282(4):2125-2129.
[5]Hughes JE, Srinivasan S, Lynch KR, et al. Sphingosine-1-phosphate induces an antiinflammatory phenotype in acrophages[J]. Circ Res, 2008, 102(8):950-958.
[6]Puneet P, Yap CT, Wong L, et al. SphK1 regulates proinflammatory responses associated with endotoxin and polymicrobial sepsis[J]. Science, 2010, 328(5983):1290-1294.
[7]Wadgaonkar R, Patel V, Grinkina N, et al. Differential regulation of sphingosine kinases 1 and 2 in lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2009, 296(4):L603-L613.
[8]Milara J, Mata M, Mauricio MD, et al. Sphingosine-1-phosphate increases human alveolar epithelial IL-8 secretion, proliferation and neutrophil chemotaxis[J]. Eur J Pharmacol, 2009, 609(1-3):132-139.
[9]McVerry BJ, Peng X, Hassoun PM, et al. Sphingosine 1-phosphate reduces vascular leak in murine and canine models of acute lung injury[J]. Am J Respir Crit Care Med, 2004,170(9):987-993.
[10]Sammani S, Moreno-Vinasco L, Mirzapoiazova T, et al. Differential effects of sphingosine 1-phosphate receptors on airway and vascular barrier function in the murine lung[J]. Am J Respir Cell Mol Biol, 2010,43(4):394-402.
[11]Wang HM, Bodenstein M, Markstaller K. Overview of the pathology of three widely used animal models of acute lung injury[J]. Eur Surg Res, 2008, 40(4): 305-316.
[12]楊紅,斯琴,孫仁宇. 肺血管內皮細胞在大鼠急性肺損傷發生中的作用[J]. 中國病理生理雜志,2000,16(9):831-834.
[13]Durán WN, Breslin JW, Sánchez FA. The NO cascade, eNOS location, and microvascular permeability[J]. Car-diovasc Res, 2010, 87(2):254-261.
[14]徐明舉,利凱,崔紅玉,等.豬流感病毒誘導的小鼠急性肺損傷與SOD、NO、MDA和OH·變化的相關性[J]. 中國病理生理雜志,2011, 827(4):783-786, 790.
[15]Andrew PJ, Mayer B. Enzymatic formation of nitric oxide synthases[J]. Cardovasc Res, 1999,43(3):521-531.
[16]陳慎仁 ,陳林興, 陳少如.誘導型一氧化氮合酶與疾病[J]. 中國病理生理雜志,2000, 16(2):179-183.
[17]Cui H, Okamoto Y, Yoshioka K, et al. Sphingosine-1-phosphate receptor 2 protects against anaphylactic shock through suppression of endothelial nitric oxide synthase in mice[J]. J Allergy Clin Immunol, 2013,132(5):1205-1214.e9.
(責任編輯: 林白霜, 羅森)

*[基金項目]國家自然科學基金資助項目(No. 81303288);黑龍江省自然科學基金資助項目(No. p015107);黑龍江省應用技術研究與開發計劃項目院所創新專項(No. 2013G1081)
Sphingosine-1-phosphate receptor-2 attenuates lipopolysaccharide-induced acute lung injuryLI Xiu-cuo1, YAN Guang-hai1, ZHANG Yong-ji1, TAKUWA Yoh2, CUI Hong1
(1CollegeofMedicine,YanbianUniversity,Yanji133002,China;2DepartmentofVascularPhysiology,KanazawaUniversityGraduateSchoolofMedicine,Kanazawa920-8640,Japan.E-mail:cuihong@ybu.edu.cn)
[ABSTRACT]AIM: To investigate the effects and mechanisms of sphingosine-1-phosphate receptor-2 (S1P2R)on lipopolysaccharide (LPS)-induced acute lung injury (ALI). METHODS: ALI model was induced by intratracheal administration of LPS in both wild-type mice and S1P2R-deficient mice. The pathological changes in the lung tissues were observed, and the protein concentration, total cell number, neutrophil ratio, TNF-α level and IL-6 level were determined in the bronchoalveolar lavage fluid (BALF) 24 h after LPS injection. In order to investigate the mechanisms of S1P2R in LPS-induced ALI, 10 min before LPS injection, both wild-type mice and S1P2R-deficient mice were injected with nitric oxide synthase inhibitor by tail vein injection, the pathological changes of the lung tissues were observed, and the protein concentration and total cell number in BALF were determined 12 h after LPS injection. RESULTS: Compared with wild-type mice, S1P2R-deficient mice showed more severe LPS-induced ALI, and the protein concentration, neutrophils and inflammatory cytokines in BALF were significantly increased in S1P2R-deficient mice. Administration of nitric oxide synthase inhibitor Nω-L-nitro-arginine methyl ester protected S1P2R-deficient mice from aggravation of ALI. CONCLUSION: S1P2R mediates the protection from LPS-induced ALI possibly through inhibiting nitric oxide synthase.
[KEY WORDS]Sphingosine-1-phosphate receptor-2; Acute lung injury; Nitric oxide
通訊作者△Tel: 0451-55665478; E-mail: wmzyyjy@163.com
[收稿日期]2015- 05- 27[修回日期] 2015- 09- 07
[文章編號]1000- 4718(2015)12- 2244- 05
doi:10.3969/j.issn.1000- 4718.2015.12.021
[中圖分類號]R363.2+1
[文獻標志碼]A

