大熊貓慢性營養不良綜合征治療
王成東 , Carlos Sanchez , 蘭景超 , 羅 娌 , 楊 智 , 李明喜 , 黃祥明 , 吳孔菊
(1.成都大熊貓繁育研究基地 , 四川成都610081;2.華盛頓國家動物園 , 美國華盛頓20008)
大熊貓慢性營養不良綜合征治療
王成東1, Carlos Sanchez2, 蘭景超1, 羅 娌1, 楊 智1, 李明喜1, 黃祥明1, 吳孔菊1
(1.成都大熊貓繁育研究基地 , 四川成都610081;2.華盛頓國家動物園 , 美國華盛頓20008)
根據動物源性蛋白質過敏理論,選用甲硝唑作為抗過敏藥物并輔以腸道營養液替代富含動物源性蛋白質的傳統精飼料,先后對8只患慢性營養不良綜合征大熊貓進行了診斷性治療。治療結果顯示,(1)甲硝唑與腸道營養液配合,對大熊貓慢性營養不良綜合征治療的有效率為100%,且無一例動物治療后出現病情反復;(2)診斷性治療結果證明,大熊貓慢性營養不良綜合征的發病原因為傳統人工日糧中動物源性蛋白質導致。
大熊貓 ; 營養不良 ; 動物源性蛋白質 ; 治療
圈養條件下,大熊貓慢性營養不良綜合征(俗稱“僵貓”)是一種發病率極高、難以預防與治愈的疑難病癥,其發病致死率占大熊貓圈養種群總死亡率的37.5%[1]。特別是處于生長發育階段的亞成體大熊貓,一旦發生營養不良綜合征,極容易變成僵貓、失去繁殖能力,最終死亡[1-5]。有關該病的發病原因和治療措施,國內外曾開展過部分研究,但至今未明確真正的發病原因并找到有效的防治措施[1-6]。筆者通過對該病病因學系列研究后發現,其發病原因與傳統人工精料中的動物源性蛋白高度相關[7],通過采用植物源性蛋白質精料替代傳統模式下的動物源性蛋白質精料,并輔助抗過敏藥物等措施先后對8只患病大熊貓個體進行了診斷性治療。診斷性治療結果顯示,發病個體的治愈率達到100%(8/8),且無1例發生病情反復。報告如下。
1 患病大熊貓個體資料 見表1。

表1 患病大熊貓個體基本資料
注:數據來源于2005年
2 臨床癥狀
按照文獻[4,7]標準,同時符合以下條件的大熊貓個體被診斷為慢性營養不良綜合征:(1)食欲時好時壞、體形消瘦、被毛粗亂無光澤、腹圍增大或伴有波動感,排黏頻繁(>4次/月);(2)與同齡個體相比,體形明顯瘦小;(3)與實際年齡相比生殖器發育不成熟;雌性個體不發情、發情行為紊亂或偶爾受孕產畸形胎兒;雄性個體繁殖季節無性欲,采不出精液或者偶爾采出精液但精液質量無法滿足繁殖需要。
3 臨床檢查
所有8只個體均表現為:消瘦、被毛粗亂無光澤、體溫36.0 ℃~37.0 ℃、呼吸18~25次/min,心率78~102次/min、節律未見異常;B超檢查,除 387#和494#個體腹腔內有少量腹水外,其余6只個體未見腹水。
4 實驗室檢驗
4.1 血液學檢查(見表2) 血液常規和生化檢查結果顯示,8只患病大熊貓除都表現有貧血、低蛋白血癥、低血鈣、血清Ca/P倒置外,血液嗜中性粒細胞下降、淋巴細胞偏高,尤其是嗜酸性粒細胞顯著升高(8%~30%),呈現典型的嗜酸性粒細胞血癥[8]。
4.2 病原學檢查 采集4只患病個體的血液和糞便分別開展細菌學、病毒學和寄生蟲學檢查,結果顯示,未檢出相關的細菌、病毒和寄生蟲性病原。[7]
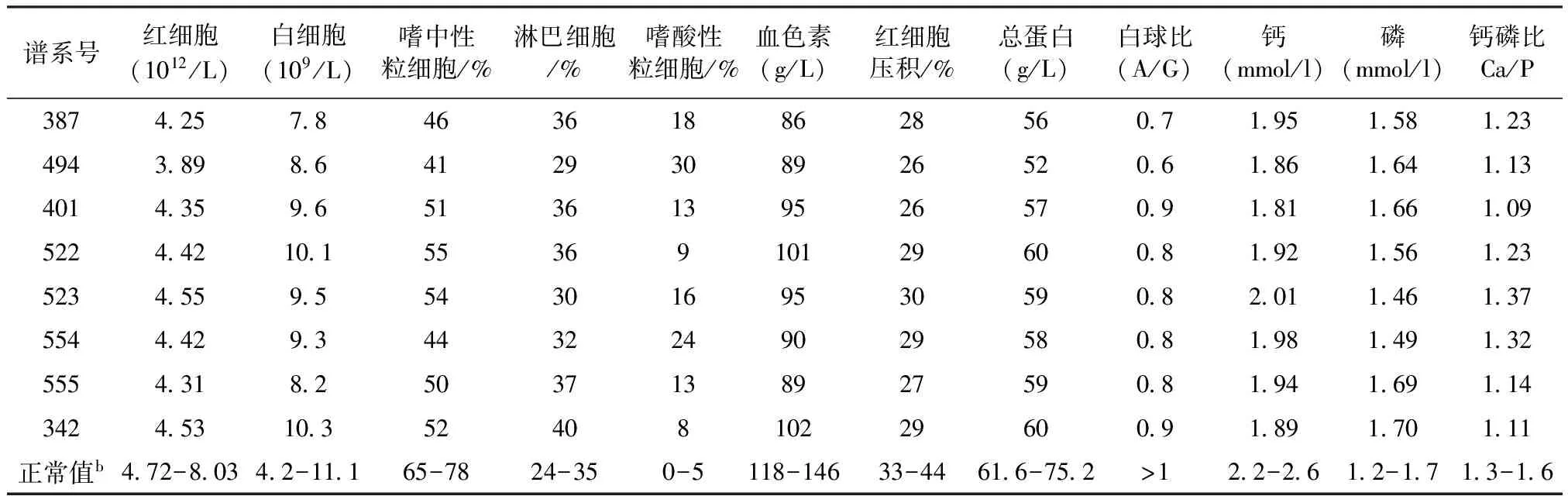
表2 8只患病大熊貓血液學檢查結果
注:數據來源于成都大熊貓基地2006~2010年對60只成年大熊貓血液檢查數據統計結果
4.3 病理學檢查 患病動物結腸黏膜的病理組織學檢查結果顯示,黏膜固有層幾乎無法看到正常狀態所見嗜中性粒細胞和淋巴細胞、淋巴管明顯增大且淋巴管內有很多黏液,黏膜上皮完整、腸腺大小未見改變,黏膜固有層大量結締組織增生[7]。結果提示,動物極可能受到某種不利因素的長期刺激,致結腸黏膜固有層炎性細胞明顯減少而無法抵抗外來病原入侵,作為一種代償性機制反應,結腸黏膜淋巴管大量黏液的出現是為快速沖刷外來入侵病原,最后導致結腸黏膜固有層大量結締組織堆積。
5 初步診斷
根據病原學檢查結果、患病動物血液嗜酸性粒細胞血癥特征和結腸黏膜病理組織學檢查結果,將該病初步診斷為動物源性蛋白質過敏綜合征。
6 治療
治療原則:(1)立即停止富含動物源性蛋白質的人工精料,改用腸道營養液進行替代;(2)篩選有效藥物進行脫敏治療;(3)提供優質食用竹(筍),任其自由采食。
6.1 人工營養液替代治療 替代精料的腸道營養液須滿足以下特點:(1)不需增加消化負擔即可被直接吸收利用;(2)易于投飼并能夠滿足動物基本營養要求。腸道營養液配方:能全力500 mL+復方氨基酸注射液250 mL, 按照 5 mL/kg體重進行口服,每日2次,連續6月為1個療程。
6.2 脫敏藥物篩選與治療 選擇2只患病個體,1只采用以地塞米松磷酸鈉(0.05 mg/kg體重,1日2次,口服)、另1只采用甲硝唑片(5 mg/Kg體重,1日1次,口服)進行治療,40 d為1個療程以觀察藥物療效。1個療程后的結果顯示,單獨應用甲硝唑治療后,動物的體重增加3.1 kg、日大便量平均增加5.2 kg、血液嗜酸性粒細胞由治療前的12%降低到治療后的3%、排黏反應由治療前的8次/月降低為0次/月,眼觀未見外寄生蟲感染;而使用地塞米松磷酸鈉治療后,動物體重僅增加0.8 kg、日大便量平均增加1.4 kg、血液嗜酸性粒細胞由治療前的11%降低到治療后的8%、排黏反應由治療前的4次/月降低為2次/月,但動物眼框和口角周圍都出現非常嚴重的螨蟲感染(圖1~2)。藥物篩選試驗結果表明,甲硝唑對大熊貓慢性營養不良綜合征具有良好的治療效果。
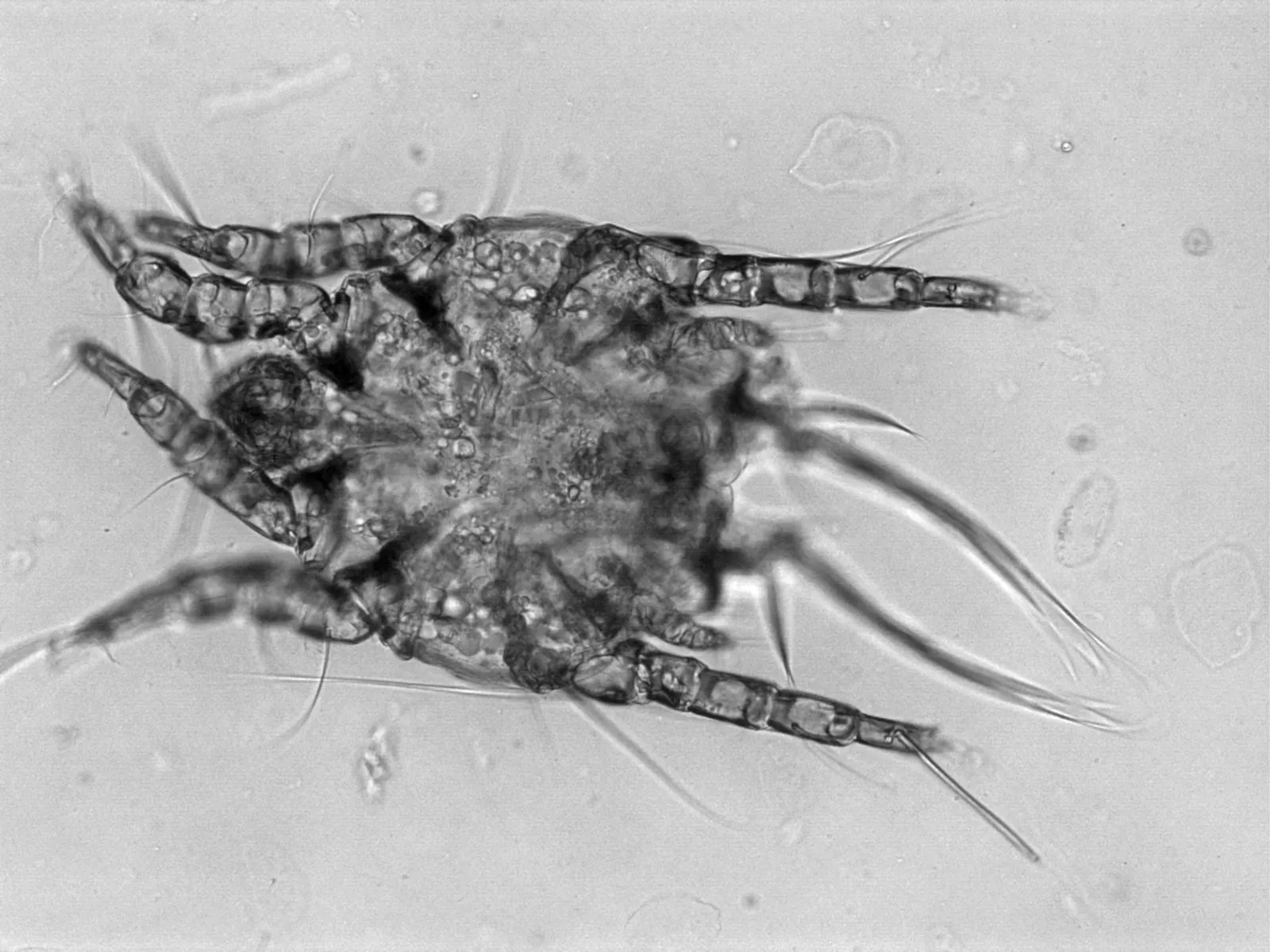
圖1 地塞米松治療組大熊貓感染的雄足螨(10×4)

圖2 地塞米松治療組大熊貓感染的雌足螨(10×4)
7 推廣治療
對使用過地塞米松治療不理想的1只個體和其余的6只患病個體,全部采用甲硝唑配合腸道營養液進行治療。治療措施:(1)甲硝唑按5 mg/kg體重,每日1次、連續口服40 d,自配腸道營養液按5 mL/kg體重、每日2次、連續飼喂為6個月;(2)根據血清Ca/P的不同,口服鈣爾奇D(1 200 mg~2 400 mg/只·d)以糾正Ca、P代謝紊亂;(3)6個月后停止人工營養液,替換為正常飼養管理模式下全部以植物源性蛋白質組成的精飼料。該方案治療后全部8只動物的體重、排便與排黏情況見表3、血液檢查結果見表4。由表3可知,所接受治療的8只患病個體,1個療程的治療與調理后體重平均增加19.5 kg,日大便量平均增加8.58 kg、排黏液頻率由治療前平均5.75次/月陡然下降到治療后的0次/月。由表4可知,所有接受該方法治療的8只個體血液生理生化指標全部恢復正常,無1例出現蛋白倒置(A/G>1),血液常規檢查中嗜酸性粒細胞保持0%~5%的正常水平。8只個體經過1個療程的治療和調理后,全部恢復為以植物源性蛋白質組成的精飼料進行飼養管理,1年后重新返回繁殖種群。
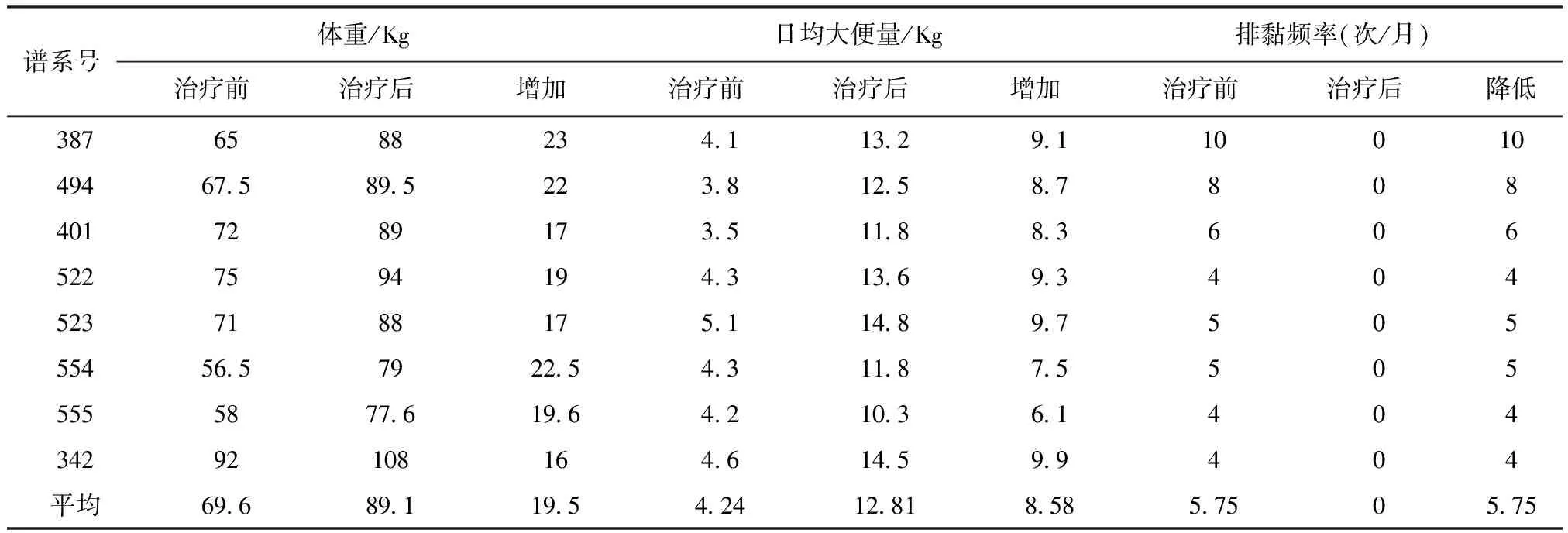
表3 甲硝唑配合腸道營養液對8只患病大熊貓個體治療前后的體重、排便量和排黏變化
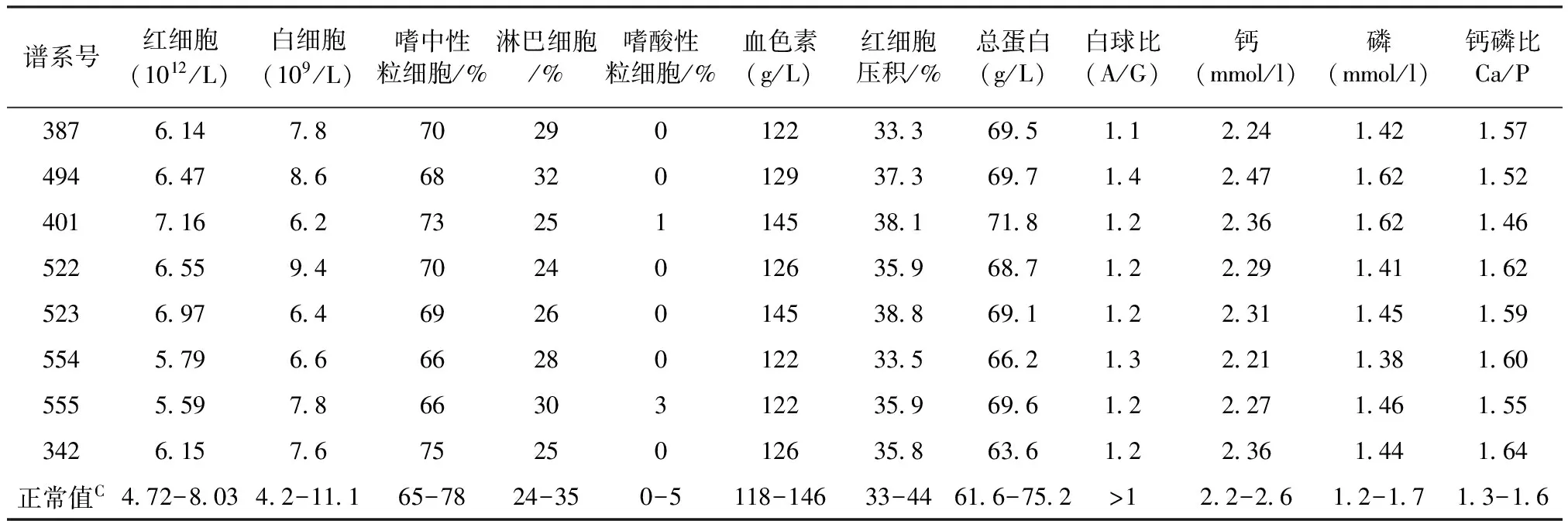
表4 8只患病大熊貓脫敏治療后血液學檢查結果
注:數據來源于成都大熊貓基地2006-2010年對60只成年大熊貓血液檢查數據統計結果
8 討論
有關大熊貓慢性營養不良綜合征的發病原因,國內外已開展過部分探索,但至今也未明確真正的原因。倫敦動物園曾通過免疫學方法分析后認為,該病的發生與食物中的卵清蛋白高度相關[9-10]。張金國等(1998)報道,該病病因與低T3綜合征相關[2]。余建秋等(1998)報道,患該病大熊貓除表現為低蛋白血癥外,最明顯的表現為毛發中Cu、Zn、Mn等微量元素含量極顯著低于健康個體[3]。張成林等(2014)認為,消化吸收障礙是引發大熊貓發生該病病因[5]。而筆者通過采集患病大熊貓血液、糞便和結腸黏膜開展包括血液學、細菌學、病毒學、寄生蟲學和病理組織學系列研究后發現,大熊貓患該病的原因與傳統人工精料中的動物源性蛋白質高度相關[7]。本文根據動物源性蛋白質過敏理論,采用以腸道營養液替代富含動物源性蛋白質的人工精料并輔助甲硝唑進行脫敏治療方案,先后對成都大熊貓種群中8只患病個體進行了診斷性治療。診斷性治療結果顯示,所有接受該方案治療的8只患病大熊貓,在經歷1個療程治療后全部康復,治愈率達100%,且無1例個體在回歸正常飼養管理模式下出現病情反復。治療性診斷結果表明,大熊貓慢性營養不良綜合征的發病原因確實為人工精料中動物源性蛋白質所導致,與倫敦動物園通過免疫學檢測提出的推斷相吻合,[9-10]至于動物源性蛋白質過敏原的確切成分,還有待開展進一步的深入研究確定。
[1] 張金國. 大熊貓常見疾病的防治概況[C].成都國際大熊貓保護學術研討會論文集,成都:四川科技出版社,1994: 359-366.
[2] 張金國,張成林. 大熊貓營養不良研究[C]. 成都國際大熊貓保護學術研討會論文集,成都:四川科技出版社,1998: 221-224.
[3] 余建秋,葉智勇,李光漢. 大熊貓慢性胃腸炎研究[C].成都國際大熊貓保護學術研討會論文集,成都:四川科技出版社,1998: 228-233.
[4] David E.Wildt, Anju Zhang, Hemin Zhang, Donald L. Janssen, Susie Ellis.Giant Pandas [M]. Cambridge: Cambridge University Press, 2006:37-99.
[5] 張成林,夏茂華,楊明海,等. 圈養大熊貓營養不良綜合癥研究[J]. 野生動物學報,2014, 35(3):271-276.
[6] 王成東,王強,牛李麗. 亞成體大熊貓頑固性胃腸功能紊亂伴嚴重厭食治療[C]. 成都國際大熊貓保護學術研討會論文集,成都:四川科技出版社,1998:225-227.
[7] 王成東,Carlos Sanchez,羅娌,等.大熊貓慢性營養不良綜合癥病因學研究[J]. 野生動物學報,2016,37(4):301-306.
[8] 陳灝珠. 實用內科學(下冊)[M],10版.北京:人民衛生出版社,1997: 1934-1936.
[9] Knight J, Brostoff J, Pack S, Sarner M. A possible allergic illness in a giant panda[J].The Lancet,1982, 12( 25):1450-1451.
[10] Frape D L, Cash R S,Ricketts S W. Panda food allergy[J] .The Lancet, 1983, 4(16) : 870-871.
Treatment of Giant Pandas Characterized with Stunted Development Syndrome
WANG Cheng-dong1, Carlos Sanchez2, LAN Jing-chao1, LUO Li1, YANG Zhi1LI Ming-xi1, HUANG Xiang-ming1, WU Kong-ju1
(1.Chengdu Research Base of Giant Panda Breeding, Chengdu 610081,China; 2.National Zoological Park, Washington 20008, America)
Based on the pathohistological findings in colic mucousa of giant pandas with Stunted Development Syndrome (SDS), it was assumed that the cause was allergic reaction associated with animal origin protein in a concentrated food supplement. As a result, a treatment protocol for this disease was developed and applied to 8 infected animals. Metronidazole was administrated as a desensitizing drug combined with an artificial nutritional supplement as a substitute for the concentrated food that was believed to cause the reaction. The results indicated that the efficacy of the protocol to this disease was 100% and the etiological assumption of allergy associated with animal origin protein was confirmed by the desensitizing treatment and deprivation of the allergen.
giant panda (Ailuropodamelanoleuca); stunted development syndrome; treatment;animal origin protein
2016-07-27
成都大熊貓繁育研究基金會資助(CPF08011)
王成東(1965-),男,研究員,碩士,從事大熊貓獸醫學研究,E-mail: wcdsyy@sina.com
S855.3
A
0529-6005(2016)12-0112-04

