2型糖尿病腎病患者尿足細胞標志蛋白和血管內皮生長因子水平與氧化應激的相關性*
董閃閃,張 潔,劉 璠,秘玉靜,李欣盼,周慧敏
(河北醫科大學第一醫院:1.內分泌科;2.檢驗科,石家莊 050031)
2型糖尿病腎病患者尿足細胞標志蛋白和血管內皮生長因子水平與氧化應激的相關性*
董閃閃1,張 潔1,劉 璠1,秘玉靜2,李欣盼1,周慧敏1
(河北醫科大學第一醫院:1.內分泌科;2.檢驗科,石家莊 050031)
目的 探討2型糖尿病(T2DM)并發不同程度腎病患者尿足細胞標志蛋白(PCX)和血管內皮生長因子(VEGF)水平變化,及其與氧化應激的關系。方法 186例T2DM患者按照24 h尿清蛋白排泄率(UAER)分為單純T2DM組(SDM組,62例)、微量組(NA組,60例)、大量組(MA組,64例),另取24 h UAER正常者作對照(NC組,60例)。分別檢測PCX、VEGF、超氧化物歧化酶(SOD)、谷胱甘肽過氧化物酶(GSH-px)和丙二醛(MDA)水平。結果 與其他3組比較,MA組VEGF、PCX及MDA水平最高(P<0.01),SOD和GSH-px水平最低(P<0.01,P<0.05)。VEGF、UAER、HbA1c是尿PCX的獨立危險因素。結論 糖尿病腎病患者尿PCX及血VEGF與氧化應激相關,氧化應激與足細胞的損傷密切相關。
糖尿病腎病;尿足細胞標志蛋白;血管內皮生長因子;氧化性應激
糖尿病腎病(DN)是糖尿病的主要微血管并發癥,目前已成為引起終末期腎病的主要原因。而其具體發病機制目前尚未明確。足細胞附著于腎小球基底膜外側,參與構成腎小球濾過膜的最后一道屏障。足細胞的損傷和脫落與蛋白尿的發生密切相關,是腎小球硬化形成和發展的關鍵因素[1-2]。最近人體活組織檢查研究表明,DN發病過程中足細胞功能及結構上的損傷早期已出現[3]。足細胞標志蛋白(PCX)及血管內皮生長因子(VEGF)主要表達于足細胞,是足細胞損傷的主要標志物。腎臟對氧化損傷敏感,多項研究證實氧化應激在DN的發病中起著重要作用。DN發生時活性氧(ROS)產生增加,ROS可介導足細胞的凋亡,同時誘導PCX的脫落,促進VEGF的過度表達,是引起足細胞損傷的主要原因。體內主要的氧化應激標志物丙二醛(MDA)作為脂質過氧化產物,反映了細胞氧化損傷程度。抗氧化應激物質的減少是引起足細胞損傷的另一主要原因,超氧化物歧化酶(SOD)和谷胱甘肽過氧化物酶(GSH-px)是體內的最重要的抗氧化酶[4]。本研究旨在探討DN患者尿PCX及血VEGF與氧化應激的相關性,并為DN患者足細胞損傷的機制提供理論依據。
1 資料與方法
1.1 一般資料 選取2012年3月至2014年5月本院2型糖尿病(T2DM)患者186例(T2DM組),均符合1999年WHO糖尿病診斷標準。根據24 h尿清蛋白排泄率(UAER)分為單純糖尿病組(UAER<20 μg/min,SDM組)62例、微量組(20 μg/min≤UAER<200 μg/min,NA組)60例、大量組(UAER≥200 μg/min,MA組)64例,另選取60例健康體檢者為對照者(NC組)。納入標準:(1)所有研究對象均符合人體試驗倫理學標準,并取得倫理委員會的批準及簽署知情同意書;(2)研究對象均排除糖尿病急性并發癥、泌尿系感染、其他腎臟疾病、高血壓、嚴重心腦肺疾病、嚴重肝病、精神心理疾病及其他內分泌等疾病;(3)1年未服用過抗氧化應激藥物;(4)無手術、外傷等應激情況。各組患者年齡、性別、BMI、收縮壓(SBP)和舒張壓(DBP)比較,差異無統計學意義(P>0.05),見表1。
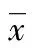
表1 各組臨床一般資料比較(±s)
1.2 方法 測量身高、體質量、血壓,計算BMI。空腹10 h抽靜脈血,采用美國貝克曼DXC800進行全血生化測定,采用Vantage(德國,拜耳)測定糖化血紅蛋白(HbA1c)。采用ELISA法測定血VEGF(晶美生物工程有限公司)。采用比色法測定SOD、GSH-px和MDA(南京建成生物工程研究所)。留取晨尿10 mL采用ELISA法測定PCX(上海越研生物科技有限公司),同日留取24 h尿檢測UAER。
2 結 果
2.1 各組糖代謝指標的比較 與NC組比較,T2DM組患者空腹血糖(FPG)及HbA1c高于NC組,差異有統計學意義(P<0.05)。T2DM 3組間比較,NA組及MA組FPG及HbA1c高于SDM組,差異有統計學意義(P<0.05),見表2。
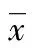
表2 各組糖代謝指標比較(±s)
a:P<0.01,與NC組比較;b:P<0.01,與SDM組比較。
2.2 各組VEGF、PCX及UAER比較 與NC組比較,T2DM組患者VEGF、PCX及UAER高于NC組,差異有統計學意義(P<0.05)。T2DM 3組患者VEGF、PCX及UAER為SDM組 2.3 各組氧化應激指標的比較 與NC組比較,T2DM組患者MDA高于NC組,T2DM組患者GSH-px及SOD低于NC組,差異有統計學意義(P<0.05)。T2DM 3組患者MDA水平為SDM組 2.4 Pearson相關分析 尿PCX與UAER、MDA、VEGF、FPG、HbA1c呈正相關(r=0.823,0.823,0.870,0.639,0.700),與SOD、GSH-px呈負相關(r=-0.739,-0.474,均P<0.05);血VEGF與PCX、UAER、MDA、FPG、HbA1c呈正相關(r=0.870,0.794,0.877,0.672,0.707),與SOD、GSH-px呈負相關(r=-0.771,-0.514,均P<0.05)。 2.5 多元逐步回歸分析 以PCX為因變量,UAER、SOD、GSH-px、MDA、VEGF、FPG、HbA1c、病程、BMI、SBP、DBP、血清總膽固醇(TC)、三酰甘油(TG)為自變量進行多元逐步回歸分析,回歸方程為Y=-10.56+0.032(VEGF)+0.029(UAER)+1.043(HbA1c),P<0.01,說明VEGF、UAER、HbA1c是尿PCX的獨立危險因素。 表3 各組VEGF、PCX及UAER比較(±s) a:P<0.01,與NC組比較;b:P<0.01,與SDM組比較;c:P<0.01,與NA組比較。 表4 各組氧化應激指標的比較(±s) a:P<0.01,與NC組比較;b:P<0.05,c:P<0.01,與SDM組比較;d:P<0.05,e:P<0.01,與NA組比較。 腎小球的臟層上皮細胞又稱為足細胞,是一種終末分化的多突狀細胞,分化成熟后一般不能再生,是腎小球濾過膜的重要構成部分[5]。PCX是一種唾液酸黏蛋白分子,正常表達于足細胞,固定于足細胞頂膜構成腎小球分子屏障,同時因其帶負電荷,故又參與構成腎小球的電荷屏障[6]。Hara等[7]、Ye等[8]多項研究表明PCX是T2DM患者足細胞損傷的早期標志物,ELISA法可準確檢測尿中PCX的水平,本研究表明T2DM組尿PCX明顯高于NC組,FPG與尿PCX呈正相關,HbA1c是PCX獨立危險因素,說明高血糖可導致足細胞的損傷,進一步研究表明UAER是PCX獨立危險因素,尿PCX排泄增多可反映出足細胞的損傷呈進行性加重,提示PCX與足細胞損傷程度相平行。隨著尿PCX逐漸升高,UAER亦逐漸升高,證實尿PCX的水平可反應腎臟損傷的嚴重程度。 VEGF即血管通透因子,具有增加血管通透性作用。足細胞是表達VEGF最豐富的細胞,生理情況下足細胞分泌的VEGF 通過自分泌方式調節自身鈣離子平衡,降低細胞毒性,提高足細胞存活率,同時對維持腎小球基底膜的完整性及正常功能起著重要作用,而腎小球發生病理改變時足細胞表達VEGF也相應發生變化。本研究發現VEGF與FPG、HbA1c呈正相關,說明高血糖可通過蛋白激酶C(PKC)、細胞外信號調節激酶(ERK)介導的PKC-ERK 機制促進足細胞VEGF mRNA 及蛋白的表達[9]引起VEGF分泌增多,過高分泌的VEGF可引起足細胞Ⅳ型膠原分泌增多,從而引起基底膜結構發生改變,形成更大的孔,使大分子蛋白更易通過,同時還可引起足細胞的損傷和凋亡,在蛋白尿的發生發展中起著重要的作用[10]。本研究驗證了上述觀點,血VEGF與UAER、PCX呈顯著正相關,隨血VEGF分泌增多,UAER、PCX隨之升高,MA組VEGF、PCX顯著高于其他組。 最近研究證實[4],氧化應激反應增強在DN發生發展中發揮了重要的作用。ROS產生過多和/或抗氧化系統活性降低可導致體內氧化應激水平增加,本研究表明T2DM組代表氧化損傷水平的MDA顯著高于NC組,代表抗氧化水平的SOD、GSH-px顯著低于NC組,且隨著UAER的升高,氧化-抗氧化系統的失衡逐漸加重,MA組MDA最高,SOD、GSH-px最低證實了上述觀點。DN發生時高血糖通過多元醇途徑、晚期糖基化終末產物(AGEs)途徑、PKC途徑和氨基己糖途徑導致ROS產生增多[4],進一步激活p38MAPK途徑引起足細胞凋亡,同時通過ERK1/2的磷酸化導致足突形態發生改變[11],引起PCX的脫落。本研究表明PCX與MDA呈正相關,與SOD、GSH-px呈負相關,且隨著氧化應激反應的加重,尿PCX排泄增多,MA組PCX最高,這與Lin等[12]研究一致,抗氧化劑α-硫辛酸通過減輕氧化應激可使尿PCX排泄減少。同時Susztak等[13]研究表明ROS介導足細胞的凋亡,ROS可直接攻擊足細胞,并激活足細胞還原型尼克酰胺腺嘌呤核苷酸磷酸氧化酶產生過多的ROS,從而形成惡性循環。ROS產生增多可啟動高遷移率蛋白 1,激活c-jun氨基末端激酶誘導VEGF的表達[14],研究發現VEGF與MDA呈正相關,與SOD、GSH-px負相關,SDM組中足細胞分泌的VEGF已顯著增加,隨著UAER升高,氧化應激反應進行性加重,VEGF水平相應升高,Thallas-Bonke等[15]研究表明氧化應激的減輕可使VEGF分泌減少。此外VEGF與足細胞損傷密切相關[16],VEGF可介導單核吞噬細胞的趨化或活化,進而產生大量毒性的促生長物質,如蛋白水解酶、血小板活化因子及生長因子等從而引起足細胞損傷。本研究發現VEGF是尿PCX的獨立危險因素,說明過高分泌的VEGF一方面可直接引起PCX的丟失,從而引起腎小球分子屏障及電荷屏障受損,另一方面可引起腎小球毛細血管通透性加大,促使大分子蛋白濾過,這些可能是蛋白尿形成的主要原因。 氧化應激反應的增強可以直接引起PCX的丟失,同時促使足細胞分泌過多的VEGF,進而引起足細胞的損傷和凋亡,這可能是DN進行性惡化的主要原因,所以,盡早改善高血糖及氧化應激,可延緩DN的發生,并為治療DN開辟了新的途徑。 [1]Matsui K,Kamijo-Ikemori A,Hara M,et al.Clinical significance of tubular and podocyte biomarkers in acute kidney injury[J].Clin Exp Nephrol,2011,15(2):220-225. [2]Merscher S,Fornoni A.Podocyte pathology and nephropathy-sphingolipids in glomerular diseases[J].Front Endocrinol (Lausanne),2014,5(5):127. [3]Maezawa Y,Takemoto M,Yokote K.Cell biology of diabetic nephropathy:Roles of endothelial cells,tubulointerstitial cells and podocytes[J].J Diabetes Investig,2015,6(1):3-15. [4]Brownlee M.The pathobiology of diabetic complications-A unifying mechanism[J].Diabetes,2005,54(6):1615-1625. [5]Tsilibary EC.Microvascular basement membranes in diabetes mellitus[J].J Pathol,2003,200(4):537-546. [6]Nielsen JS,Mcnagny KM.The role of podocalyxin in health and disease[J].J Am Soc Nephrol,2009,20(8):1669-1676. [7]Hara M,Yamagata K,Tomino Y,et al.Urinary podocalyxin is an early marker for podocyte injury in patients with diabetes:establishment of a highly sensitive ELISA to detect urinary podocalyxin[J].Diabetologia,2012,55(11):2913-2919. [8]Ye H,Bai X,Gao H,et al.Urinary podocalyxin positive-element occurs in the early stage of diabetic nephropathy and is correlated with a clinical diagnosis of diabetic nephropathy[J].J Diabetes Complications,2013,28(1):96-100. [9]Hoshi S,Nomoto K,Kuromitsu J,et al.High glucose induced VEGF expression via PKC and ERK in glomerular podocytes[J].Biochem Biophys Res Commun,2002,290(1):177-184. [10]Chen S,Kasama Y,Lee JS,et al.Podocyte-derived vascular endothelial growth factor mediates the stimulation of alpha3(IV) collagen production by transforming growth factor-beta1 in mouse podocytes[J].Diabetes,2004,53(11):2939-2949. [11]Koshikawa M,Mukoyama M,Mori K,et al.Role of p38 mitogen-activated protein kinase activation in podocyte injury and proteinuria in experimental nephrotic syndrome[J].J Am Soc Nephrol,2005,16(9):2690-2701. [12]Lin H,Ye S,Xu J,et al.The alpha-lipoic acid decreases urinary podocalyxin excretion in type 2 diabetics by inhibiting oxidative stress in vivo[J].J Diabetes Complications,2014,29(1):64-67. [13]Susztak K,Raff AC,Schiffer M,et al.Glucose-induced reactive Oxygen species cause apoptosis of podocytes and podocyte depletion at the onset of diabetic nephropathy[J].Diabetes,2006,55(1):225-233. [14]Lee JJ,Hsiao CC,Yang IH,et al.High-mobility group box 1 protein is implicated in advanced glycation end products-induced vascular endothelial growth factor A production in the rat retinal ganglion cell line RGC-5[J].Mol Vis,2012,18:838-850. [15]Thallas-Bonke V,Jha JC,Gray SP,et al.Nox-4 deletion reduces oxidative stress and injury by PKC-α-associated mechanisms in diabetic nephropathy[J].Physiol Rep,2014,2(11):e12192. [16]Brosius FC,Podocytes CR,Pathways S.And vascular factors in diabetic kidney disease[J].Adv Chronic Kidney Dis,2014,21(3):304-310. Association of urinary podocalyxin and vascular endothelial growth factor levels with oxidative stress in patients with type 2 diabetes nephropathy* DongShanshan1,ZhangJie1,LiuFan1,MiYujing2,LiXinpan1,ZhouHuimin1 (1.DepartmentofEndocrinology;2.DepartmentofClinicalLaboratory,FirstHospitalofHebeiMedicalUniversity,Shijiazhuang,Hebei050031,China) Objective To investigate the change of urinary podocalyxin(PCX) and vascular endothelial growth factor(VEGF) levels and its association with the oxidative stress in the patients with type 2 diabetes mellitus(T2DM) complicating different degrees of diabetic nephropathy.Methods Totally 186 patients with T2DM were divided into the pure T2DM (SDM,62 cases),trace amount group(NA group,60 cases) and massive amount group(MA group,64 cases) according to the 24 h urinary albumin excretion rate(UAER).60 cases of normal 24 h UAER were taken as the control group(NC group).The levels of PCX,VEGF,superoxide dismutase (SOD),malondialdehyde(MDA) and glutathione peroxidase (GSH-px)were determined.Results Compared with other three groups,the level of VEGF,PCX and MDA in the MA group were highest(P<0.01),while the levels of SOD and GSH-px were lowest(P<0.01,P<0.05).VEGF,UAER,HbA1c were the independent risk factors for urinary PCX.Conclusion In patients with diabetic nephropathy,urinary PCX and VEGF are correlated with the oxidative stress,while the oxidative stress is closely correlated with glomerular podocyte injury. diabetic nephropathy;podocytes;vascular endothelial growth factor;oxidative stress 河北省衛生廳重點科技研究計劃(20130260)。 董閃閃(1982-),主治醫師,碩士,主要從事糖尿病及糖尿病并發癥研究。 ??·臨床研究 10.3969/j.issn.1671-8348.2016.10.011 R587.1 A 1671-8348(2016)10-1334-03 2016-01-02 2016-01-21)
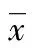
3 討 論

