非生物因子脅迫對何首烏二苯乙烯苷含量的影響
張 先, 劉紅昌, 李金玲, 王華磊, 羅春麗, 趙 致*
(1.貴州大學 資助管理中心, 貴州 貴陽 550025; 2.貴州省藥用植物繁育與種植重點(工程)實驗室, 貴州 貴陽 550025)
非生物因子脅迫對何首烏二苯乙烯苷含量的影響
張 先1, 劉紅昌2, 李金玲2, 王華磊2, 羅春麗2, 趙 致2*
(1.貴州大學 資助管理中心, 貴州 貴陽 550025; 2.貴州省藥用植物繁育與種植重點(工程)實驗室, 貴州 貴陽 550025)
為探明何首烏主要活性成分二苯乙烯苷在非生物因子脅迫下的變化,為人工栽培調控提供參考。采用UV-C照射、茉莉酸甲酯和乙烯利噴施脅迫處理遺傳背景一致的何首烏組培苗。結果表明:用茉莉酸甲酯溶液處理何首烏組培苗,0.20×10-3mol/L溶液能有效誘導二苯乙烯苷的產生,根中的二苯乙烯苷含量增加極顯著,莖中略有下降,葉中略有升高,但不顯著;0.25×10-3mol/L溶液抑制根、莖中的二苯乙烯苷的生物合成,且根中的下降量與對照相比達極顯著水平,葉中的量略有增加,但不顯著。用乙烯利溶液噴施何首烏組培苗,250 mg/L溶液處理的組培苗根和莖中的二苯乙烯苷增加量與對照相比達極顯著水平,葉中略有升高,但不顯著;300 mg/L溶液處理根和莖中的二苯乙烯苷的生物合成均受抑制,且根中的下降量與對照相比達極顯著水平,葉中含量略微增加,但不顯著。用UV-C照射刺激何首烏組培苗,10 min/d持續處理5 d,何首烏植株根、莖中二苯乙烯苷的生物合成均被抑制,與對照相比達極顯著水平,葉中略有上升但不顯著;20 min/d處理5 d時,何首烏植株根、莖、葉中的二苯乙烯苷的生物合成均被抑制,且與對照相比,根和莖中的下降量均達極顯著水平。二苯乙烯苷作為茋類化合物,在外界因子脅迫下其生物合成會被誘導合成或抑制。
何首烏; 二苯乙烯苷; 茋類化合物; 非生物因子
茋類化合物是一類具有二苯乙烯母核的物質總稱,目前已在葡萄、花生和松樹等多個科屬的植物中分離鑒定得到,其多是在受到紫外照射、化學因素(如O3、表面活性劑、抗生素、部分植物激素等)、病原菌侵染等各種誘發因子作用下被誘導合成,具有提高植物抗性的作用,被視為一種重要的植保素[1-2]。另外,茋類化合物對于人類也有很好的保健作用,其中研究最深入的白藜蘆醇被廣泛用于抗腫瘤、降血脂、降血壓、保護心血管及神經系統等的保健治療[3]。二苯乙烯苷作為茋類化合物的重要成員,目前已有大量文獻對其進行了研究報道,現代藥理研究表明,二苯乙烯苷具有抗氧化清除自由基、抗衰老、保護肝臟、提高記憶功能、血管舒張等藥理作用[4]。二苯乙烯苷作為茋類化合物是否也如白藜蘆醇、赤松素等茋類化合物一樣,作為一種植保素在植物受到外界非生物因子或生物因子脅迫下產生,目前還不清楚。為了探究非生物因子對何首烏二苯乙烯苷合成的影響,以及為下一步從轉錄組水平研究非生物因子脅迫導致的轉錄差異,采用UV-C不同時間照射處理、茉莉酸甲酯和乙烯利不同濃度噴施處理何首烏組培苗,檢測非生物因子脅迫下何首烏二苯乙烯苷含量的變化情況,為何首烏生產中人工調控其二苯乙烯苷含量以及下一步從轉錄組水平研究其轉錄差異奠定基礎。
1 材料與方法
1.1 試驗材料
何首烏:于2010年采自貴州省施秉縣何首烏GAP基地,并種植于貴州大學教學試驗場大棚內,該何首烏于1994年引種自廣東德慶縣,經貴陽中醫學院藥學院鑒定為蓼科(Polygonaceae)蓼屬(Polygonum)植物何首烏(PolygonummultiflorumThunb.)。
試劑:二苯乙烯苷(生產批號110844-201109)標品購自中國藥品生物制品檢定所,茉莉酸甲酯(產品編號392707-5,含量≥95.0%)和乙烯利(產品編號090M1155V)均購自Sigma,色譜純乙腈購自Fisher公司,超純水,其余試劑均為分析純。
儀器:Agilent1260型高效液相色譜儀(四元泵、DAD檢測器及配套色譜工作站),萬分之一天平(丹佛儀器有限公司),KQ-800KDE型高功率數控超聲波清洗器(昆山市超聲波儀器有限公司),滅菌鍋,超凈工作臺,回流裝置等。
1.2 組培苗的培養及其脅迫試驗
于2010年3月上旬,取大棚內生長健壯的何首烏植株帶芽莖段作為外植體,在9:00左右取材。外植體用自來水沖洗3~4 h后,于超凈工作臺上用75%酒精浸泡15~20 s,無菌水沖洗4次,0.1%升汞溶液浸泡8 min,再無菌水沖洗5次,取出外植體用無菌吸水紙吸干表面水分,接種至已備好的MS+2 mg/L 6-BA長叢生芽培養基中培養31 d。待莖段長出大量叢生芽后,將叢生芽轉接至1/2 MS+0.2 mg/L NAA+1.5 mg/L多效唑(Paclobutrazol)生根培養基中,每個培養瓶中接叢生芽5株,將培養瓶置于(25±2)℃、光照強度為2 000 lx、光照時間為12 h/d的組培室中培養60 d,植株帶3~4片葉,高8~10 cm,根長2~3 cm即為遺傳背景一致的何首烏組培苗。當組培苗群體建成后,用UV-C照射、MeJA溶液噴施和乙烯利溶液噴施3種非生物因子進行脅迫處理,處理后的培養條件仍同上。
1.2.1 UV-C照射 采用單因素兩水平試驗,即用UV-C照射10 min/d和20 min/d,連續處理5 d,然后繼續培養30 d。紫外燈功率30 W,波長254 nm,組培苗植株離燈距離40 cm,照射時揭開封口膜,每次照射時把培養瓶混排,保證照射均衡性。以相同功率日光燈照射處理的組培苗作為對照。試驗操作于上午9時左右進行,重復3次,每個重復30株苗。培養30 d后取樣,檢測二苯乙烯苷含量變化。
1.2.2 噴施MeJA溶液 設單因素2水平試驗,即分別用0.20×10-3mol/L和0.25×10-3mol/L1的茉莉酸甲酯溶液噴施何首烏組培苗。茉莉酸甲酯因難溶于水,應先用少量0.1%乙醇溶解后加蒸餾水至所需濃度,其中含0.1%(v/v)植物細胞活性劑TritonX-100,溶液配好后經0.22 μm一次性濾膜過濾滅菌置于無菌的小噴壺中備用,每個培養瓶噴施2 mL茉莉酸甲酯溶液。噴施時,每片葉均需噴到且噴均勻,以未加茉莉酸甲酯的溶液噴施的組培苗作對照。試驗操作在上午9時左右進行,3次重復,每個重復30株組培苗。噴施后繼續培養30 d,然后取樣檢測二苯乙烯苷含量變化。
1.2.3 噴施乙烯利溶液 采用單因素2水平試驗,即分別用250 mg/L和300 mg/L的乙烯利溶液噴施何首烏組培苗。乙烯利溶液中含有0.1%(v/v)植物細胞活性劑Triton X-100,溶液配至所需濃度后經0.22 μm一次性濾膜過濾滅菌置于無菌的小噴壺中備用。其余試驗操作同茉莉酸甲酯溶液的處理方法。
1.3 檢測樣品的制備
將組培苗的根、莖、葉分開,105℃烘30 min,75℃烘36 h,置干燥器中保存備用。用研缽將已干燥樣品磨至能過2號篩,萬分之一天平稱樣0.5 g左右,記錄到萬分之一位,樣品倒入錐形瓶,加入50%乙醇,靜置過夜,稱重,回流30 min,取出冷卻、補重,最后取1 mL過0.22 μm油性有機濾膜,4℃條件下可貯存7 d備用。3次重復,每重復取植株30株。
1.4 色譜條件及標準曲線制作
色譜條件參照2010版中國藥典[5]。色譜柱為Agilent SB-C18(4.6 mm×150 mm,5 μm)原裝進口色譜柱,流動相為乙腈-水(25∶75),流速為1 mL/min,檢測波長為320 nm,柱溫25℃,進樣量10 μL。
二苯乙烯苷標樣原始濃度5 μg/mL,分別進樣0.5 μL、1 μL、2 μL、4 μL、6 μL、8 μL、10 μL、12 μL、14 μL、16 μL、18 μL、20 μL、22 μL及24 μL,記錄每次進樣體積的色譜圖,以橫坐標數值為二苯乙烯苷濃度,縱坐標數值為二苯乙烯苷峰面積制作標準曲線圖。線性方程為y=3601.2x-0.7196(R2=0.999 9),樣品濃度在0.01~0.4 μg/mL范圍呈良好的線性關系。
1.5 方法學考察
1.5.1 精密度試驗 取同一供試品溶液,進樣量10 μL,重復進樣5次,記錄二苯乙烯苷的保留時間和色譜峰面積并計算各自的相對標準偏差(RSD)。二苯乙烯苷保留時間變化范圍為4.623~4.637 min,二苯乙烯苷重復5次的峰面積分別為269.93、274.86、275.35、269.74、270.12。保留時間RSD為0.19%,峰面積RSD(%)為1.05%。一般規定RSD窗口閥值<3%,表明試驗所用設備精密度良好。
1.5.2 重現性試驗 取0.20×103mol/L茉莉酸甲酯溶液處理根樣平行制備6份供試品溶液,每份進樣10 μL,記錄二苯乙烯苷的保留時間和色譜峰面積并計算各自的RSD。二苯乙烯苷保留時間為4.628~4.641 min,6份平行樣供試溶液中二苯乙烯苷的峰面積分別為111.31、117.17、114.50、117.21、117.14、113.54。保留時間RSD為0.49%,峰面積RSD為2.04%,均小于3%的RSD窗口閥值,表明樣品重復性較好。
1.5.3 加樣回收試驗 取0.20×10-3mol/L茉莉酸甲酯溶液處理根樣平行制備3份供試溶液,分別加入5 μg/mL二苯乙烯苷標液2 μL,分別進樣10 μL,進行含量測定,計算回收率。經測定平均加樣回收率達99.39%,表明試驗條件穩定,可進行下一步操作。
1.5.4 最低檢測限試驗 分別進樣二苯乙烯苷標液(5 μg/mL)0.1 μL、0.2 μL、0.3 μL,3次重復,進行二苯乙烯苷含量測定。當進樣量為0.1 μL時,儀器未能檢測出二苯乙烯苷。進樣量0.2 μL時,檢測出的二苯乙烯苷量為0.002 7 μg。即所測樣品中二苯乙烯苷含量低于0.2 μL時,則不能被檢測。
2 結果與分析
2.1 UV-C照射何首烏組培苗的二苯乙烯苷含量
由表1可知,UV-C照射處理10 min/d,持續進行5 d,與對照相比,何首烏組培苗根、莖中二苯乙烯苷的生物合成均受抑制,葉中則呈升高趨勢,根、莖中二苯乙烯苷含量分別下降33.88%、55.73%,下降量達顯著水平;葉中二苯乙烯苷含量上升21.05%,但不顯著。當照射時間達20 min/d時,處理根、莖、葉中二苯乙烯苷含量分別下降35.48%、46.11%和39.13%,與對照比均達極顯著水平。表明,一定劑量的UV-C照射會抑制何首烏根、莖中二苯乙烯苷的生物合成,超過一定劑量后葉中的合成也會受阻。
表1 UV-C照射何首烏組培苗的二苯乙烯苷含量
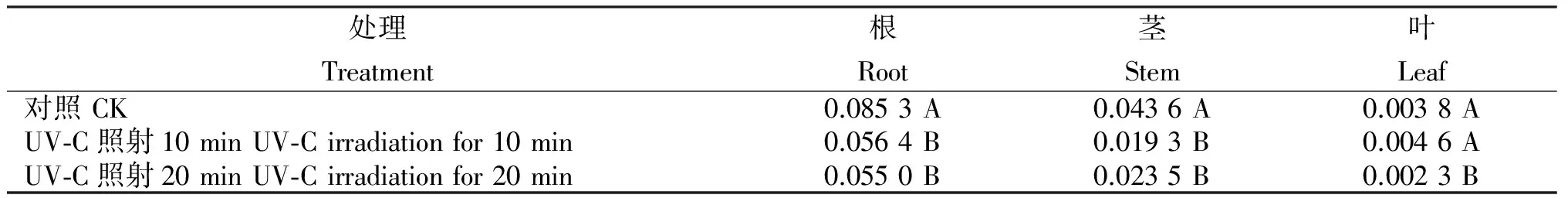
Table 1 Stilbene glucoside content of stibene glucoside in P. multiflorum tissue culture seedlings treated with UV-C irradiation %
注:表中同列大、小寫字母分別表示差異極顯著(P<0.01)和顯著(P<0.05),下同。
Note: Different capital and lowercase letters in the same column indicated 1% and 5% significant levels respectively. The same below.
2.2 茉莉酸甲酯(MeJA)溶液噴施何首烏組培苗的二苯乙烯苷含量
表2結果明,與對照相比,0.20×10-3mol/L MeJA溶液噴施何首烏組培苗能顯著提高根中二苯乙烯苷的生物合成,升高42.09%,差異極顯著;莖中二苯乙烯苷含量對照和處理差異不大,處理略有下降(4.13%);葉中二苯乙烯苷含量略有升高(10.53%),但不顯著。0.25×10-3mol/L MeJA處理根中的二苯乙烯苷含量極顯著下降,下降率達47.06%;莖中二苯乙烯苷含量對照與處理差異不明顯,處理略下降(10.34%);葉中二苯乙烯苷的含量對照與處理間差異也不大,處理略高,上升5.48%。
表2 (MeJA)溶液噴施何首烏組培苗的二苯乙烯苷含量
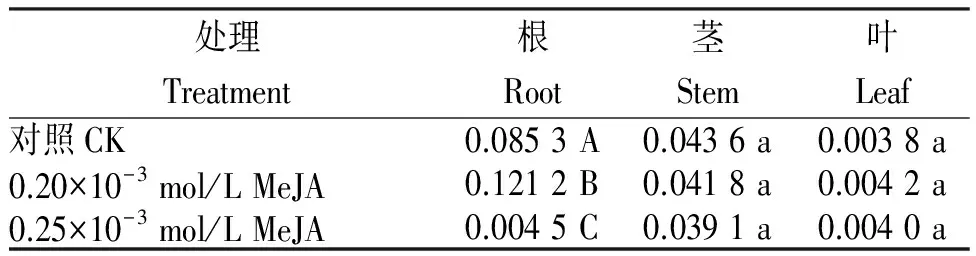
Table 2 Stilbene glucoside content in P.multiflorum tissue culture seedlings sprayed with MeJA solution %
2.3 乙烯利溶液噴施何首烏組培苗的二苯乙烯苷含量
由表3可知,250 mg/L的乙烯利溶液噴施處理何首烏組培苗能顯著誘導根、莖的二苯乙烯苷的生物合成,葉的略有上升,但不顯著,其中,根增加47.65%,莖增加38.97%,葉增加18.92%。當乙烯利溶液噴施濃度提高到300 mg/L時,處理根、莖中的二苯乙烯苷含量極顯著降低,根的下降達45.02%,莖下降25.69%;葉的變化差異不大,上升18.42%。
表3 乙烯利溶液噴施何首烏組培苗的二苯乙烯苷含量
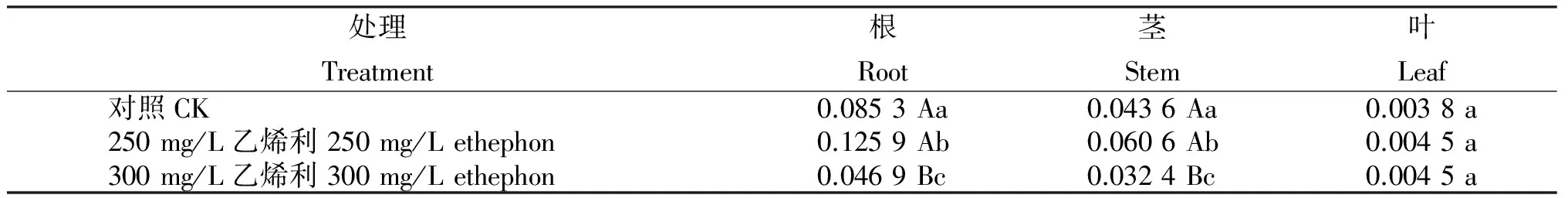
Table 3 Stilbene glucoside content in P.multiflorum tissue culture seedlings sprayed with ethephon solution %
3 結論與討論
1)試驗結果表明,一定濃度的茉莉酸甲酯和乙烯利溶液能有效誘導何首烏中二苯乙烯苷的生物合成,超過一定濃度限度后反而會抑制二苯乙烯苷的產生,此研究結果與在葡萄系列種質中的研究結果一致[6-8]。同時,不論是誘導二苯乙烯苷的生物合成還是抑制其產生,反應最敏感的器官首先是根,其次是莖,葉的反應較遲鈍。這為后面利用何首烏的根從轉錄組水平上探索二苯乙烯苷生物合成相關基因進一步提供了參考。
2) UV-C能有效提高花生、葡萄等植物中的茋類化合物的含量[9-11]。本試驗中,UV-C照射何首烏組培苗10 min/d和20 min/d,持續處理5 d,根、莖、葉中除葉照射10 min/d外,各處理器官中的二苯乙烯苷的生物合成均被抑制,原因可能是試驗所用材料為組培苗,比較幼嫩,長時間紫外照射引起苗中二苯乙烯苷生物合成代謝最終受阻。
3) 二苯乙烯苷、茉莉酸甲酯、和乙烯利3種非生物因子誘導何首烏中二苯乙烯苷的生物合成結果表明,二苯乙烯苷應是一種誘導型化合物,其作為植物植保素茋類化合物的重要成員,當植株受到外界因素刺激時其合成代謝途徑會迅速啟動以抵御外界因素的刺激,從而避免植株受到進一步傷害[12];但不論何種處理,葉均是作為主要受體,二苯乙烯苷作為一種植保素,為避免非生物因子對何首烏的進一步損傷,其生物合成途徑理應在葉中迅速啟動并大量積累,但二苯乙烯苷含量變化最大的卻是根,其次是莖。因此,推測二苯乙烯苷的主要合成部位可能在根部。
[1] Jeandet P, Douillet-Breuil A C, Bessis R,et al. Phytoalexins from the Vitaceae: biosynthesis, phytoalexin gene expression in transgenic plants, antifungal activity, and metabolism[J].J Agric Food Chem,2002,50(10):2731-2741.
[2] 生書晶,趙樹進.茋合酶基因的分子生物學研究[J].生物技術通報,2009(11):24-29.
[3] Delaunois B,Cordelier S,Conreux A,et al. Molecular engineering of resveratrol in plants[J].Plant biotechnology journal,2009,7(1):2-12.
[4] 呂麗爽.何首烏中二苯乙烯苷的研究進展[J].食品科學,2006,27(10):608-612.
[5] 國家藥典委員會.中華人民共和國藥典(一部)[S].北京:化學工業出版社,2010:165.
[6] Belhadj A, Telef N, Cluzet S, et al. Ethephon elicits protection against Erysiphe necator in grapevine[J].Journal of agricultural and food chemistry,2006,56(14):5781-5787.
[7] Faurie B, Cluzet S, Corio-Costet M F, et al.Methyl jasmonate/ethephon cotreatment synergistically induces stilbene production inVitisviniferacell suspensions but fails to trigger resistance to erysiphe necator[J].Journal international des sciences de la vigne et du vin,2009,43(2):99-110.
[8] Santamaria A R, Antonacci D, Caruso G, et al. Stilbene production in cell cultures ofVitisviniferaL. cvs Red Globe and Michele Palieri elicited by methyl jasmonate[J].Natural product research,2010,24(15):1488-1498.
[9] Guerrero R F, Puertas B, Fernandez M I, et al. Induction of stilbenes in grapes by UV-C: Comparison of different subspecies of Vitis [J].Innovative food science and emerging technologies,2010,11(1):231-238.
[10] Tang K, Zhan J C, Yang H R, et al. Changes of resveratrol and antioxidant enzymes during UV-induced plant defense response in peanut seedlings[J].Journal of plant physiology,2010,167(2):95-102.
[11] Wang W, Tang K, Yang H R, et al. Distribution of resveratrol and stilbene synthase in young grape plants (VitisviniferaL. cv. Cabernet Sauvignon) and the effect of UV-C on its accumulation[J].Plant physiology and biochemistry,2010,48(2-3):142-152.
[12] Vannozzi A, Dry I B, Fasoli M, et al. Genome-wide analysis of the grapevine stilbene synthase multigenic family: genomic organization and expression profiles upon biotic and abiotic stresses[J].BMC Plant Biology,2012,12:130.
(責任編輯: 聶克艷)
Effects of Abiotic Factors Stress on Stilbene Glucoside Content inPolygonummultiflorum
ZHANG Xian1, LIU Hongchang2, LI Jinling2, WANG Hualei2, LUO Chunli2, ZHAO Zhi2*
(1.StudentFinancialAssistanceManagementCenter,GuizhouUniversity,Guiyang,Guizhou550025; 2.GuizhouKey(Engineering)LaboratoryofPropagationandCultivationonMedicinalPlants,Guiyang,Guizhou550025,China)
In order to explore the changes of the main active component stilbene glucoside inP.multiflorumunder abiotic factors stress, and provide references for artificial cultivation regulation, tissue culture seedlings with the same genetic backgrounds were treated with UV-C irradiation,MeJA and ethephon. Results: Applying 0.20×10-3mol/L MeJA solution could effectively induce the produce of stilbene glucoside, very significantly increase the content of stilbene glucoside in root, slightly decrease the content in stem and increase the content in leaf with no significant difference. Applying 0.25×10-3mol/L MeJA solution inhibited the biosynthesis of stilbene glucoside in root and stem, the decrement in root reached the very significant level compared with the control. The content in leaf increased with no significant difference. Applying 250 mg/L ethephon solution very significantly increased the content of stilbene glucoside in root and stem compared with the control, and the content in leaf increased with no significant difference. Applying 300 mg/L ethephon solution inhibited the biosynthesis of stilbene glucoside in root and stem. And very significantly decreased the content in root compared with the control, slightly increase the content in leaf. 10 min/d UV-C irradiation for five days inhibited the biosynthesis of stilbene glucoside in root and stem very significantly compared with the control. The content in leaf slightly increased. 20 min/d UV-C irradiation for five days inhibited the biosynthesis of stilbene glucoside in root, stem and leaf. The decrement in root and stem reached the very significant level. As one kind of stilbenes, its biosynthesis could be induced or inhibited under stress of external factors.
Polygonummultiflorum; stilbene glucoside; stilbenes; abiotic factors
2015-09-19; 2016-04-13修回
國家科技支撐計劃子課題“何首烏種質資源遺傳多樣性及優良種源篩選研究”(2009BAI74B01)
張 先( 1981-),女,講師,碩士,從事藥用植物資源及次生代謝研究。E-mail: yelang7113@163.com
*通訊作者:趙 致(1959-),男,教授,從事藥用植物生理生態及其栽培研究。E-mail: zzhao@ gzu.edu.cn
1001-3601(2016)04-0173-0116-04
S567.1+9
A

