臍血干細胞移植與肝再生增強因子聯合治療急性肝衰竭的實驗研究
田佳,張墨陽,周忠義,謝曉紅
(海南省人民醫院重癥醫學科,海南 海口 570010)
臍血干細胞移植與肝再生增強因子聯合治療急性肝衰竭的實驗研究
田佳,張墨陽,周忠義,謝曉紅
(海南省人民醫院重癥醫學科,海南 海口 570010)
目的 觀察臍血干細胞移植與肝再生增強因子聯合治療急性肝衰竭大鼠的療效,以期為肝臟組織工程修復提供依據。方法建立肝衰竭大鼠模型40只,按照隨機數表法將大鼠隨機分為對照組(采用腹腔注射生理鹽水)、臍血干細胞移植組(移植組,采用腹腔移植2×107臍血干細胞)、臍血干細胞移植聯合肝再生增強因子組(聯合組,采用腹腔移植2×107臍血干細胞聯合注射肝再生增強因子50 μg·kg-1·d-1)和肝再生增強因子組(增強因子組,采用腹腔注射肝再生增強因子50 μg·kg-1·d-1),每組各10只。用DAPI標記肝細胞。大鼠肝衰竭造模成功后,經治療一個月后分別取四組大鼠的肝組織制作冰凍切片,并于熒光顯微鏡下觀察肝組織中DAPI標記的細胞計數。結果移植組肝臟歸巢及定植的干細胞為(12.6±2.0)個細胞/100倍視野,多于增強因子組的(8.1±3.4)個細胞/100倍視野,差異有統計學意義(P<0.05),增強因子組到肝臟歸巢及定植的干細胞又多于對照組的(3.1±3.4)個細胞/100倍視野,差異有統計學意義(P<0.05),而聯合組肝臟歸巢及定植的干細胞為(18.1±3.4)個細胞/100倍視野,多于以上各組,差異有統計學意義(P<0.05)。結論不同干預手段對臍血干細胞歸巢、定植于肝臟有一定影響,聯合組的干細胞歸巢率優于單行移植組和增強因子組。因此臍血干細胞移植聯合肝再生增強因子是一種較為理想的急性肝衰竭治療手段。
臍血干細胞;肝臟歸巢;急性肝衰竭;肝再生增強因子;定植
急性肝功能衰竭起病急、病死率高、疾病進展快,嚴重威脅著人類的生命質量。目前較為公認的治療方法為同種異體肝移植,但是國內可開展該項治療的醫院較少,對技術要求較高,且供體肝臟來源及治療費用的限制,因此制約了該項目的普及治療[1]。目前普遍采用的治療方法為內科綜合治療,但是所取得的療效有限。盡管人類的肝臟具有較為強大的再生功能,且肝衰竭患者肝臟局部雖表達高水平的促肝細胞增殖因子,但是肝臟的再生能力仍不足,急性肝衰竭導致肝臟不能為機體提供足夠的肝功能支持,所致肝臟損傷及衰竭現象加重[2]。因此尋找一種高效、利用度高、供體來源相對容易、價格合理的方法,是該病治療亟待解決的問題。若能夠補充一定數量的異體干細胞,同時還能抑制機體的免疫排斥反應,既能起到阻止干細胞進一步壞死的作用,同時還能夠保護現有的肝細胞,為減少肝功能的損傷提供支持,又為移植肝細胞免遭受異體的免疫排斥。為其提供足夠的生長調節劑時間,達到修復肝臟,治愈肝衰竭的目的[3]。采用傳統的抗病毒及保肝治療已難以逆轉肝功能的好轉,而原位肝移植是目前治療最理想的手段。但由于供體、手術費用昂貴和長期使用免疫抑制劑等諸多因素阻礙了其推廣[4]。目前,干細胞移植研究在醫學領域,取得了令人矚目的成就。間充質干細胞作為新型的生物治療手段,近年來受到了廣泛的關注,其具有在一定調解下可誘導向下一跨胚層分化的作用,通過旁分泌及自分泌等機制受到周圍組織環境等調控,促進組織修復的作用[5]。臍血干細胞屬于中胚層的一類多能干細胞,其具有強大的分化潛能,可在特定條件下可以分化成脂肪細胞、成骨細胞和肝細胞等多種細胞。而干細胞移植的一個關鍵點也取決于其是否能有效的在肝臟中歸巢與定植。由于骨髓間充質來源的干細胞取材有創性較大,且細胞數量在短時間內難以達到需求,加上個體分化差異[6]。但是臍帶血間充質干細胞具有臍血干細胞的優勢,且來源更為充足。肝再生增強因子是近年來發現的機體自身產生的一種細胞因子,其具有促進肝細胞增殖及修復的作用,可通過直接刺激肝細胞,從而發揮促增殖的免疫調控作用[7-8]。由于臍血干細胞一直具有簡單易行、對受體影響小、應用靈活、價格相對低廉等優點,近年來發展較快,有望成為急性肝功能衰竭較為有效且有廣闊應用前景的治療方法[9]。本研究建立肝衰竭大鼠模型,通過研究三種不同干預手段對肝衰竭大鼠進行治療觀察,了解臍血干細胞其在肝臟的歸巢、定植及對肝再生的作用,對其產生的不同結果進行統計學分析,為臍血干細胞移植聯合肝再生增強因子治療急性肝衰竭提供理論依據,并闡明移植中促干細胞歸巢的作用。
1 材料與方法
1.1 實驗動物 實驗于2014年6月至2015年12月在海南醫學院分子實驗室完成。取4周齡孕40 d大鼠40只,雌性,體質量為200~250 g;40只8周齡、體質量(200±10)g的雄性清潔級SD大鼠,均由海南醫學院實驗動物中心提供動物合格證號:許可證號:SCXK (粵)2015-0020。實驗過程符合2006年科學技術部發布的《關于善待實驗動物的指導性意見》,對動物處置符合動物倫理學要求。
1.2 主要試劑及儀器 主要試劑及儀器的名稱和來源見表1。
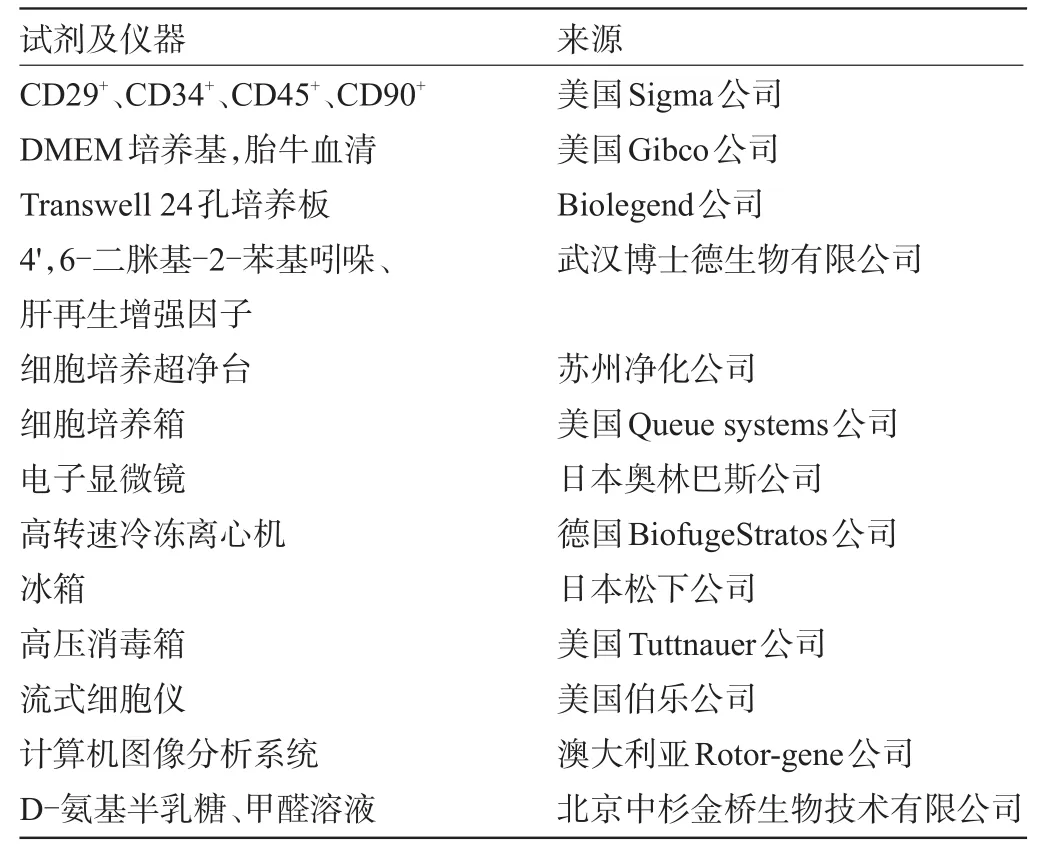
表1 主要試劑及儀器
1.3 方法
1.3.1 臍血干細胞的分離、培養[10]取40只雌性大鼠頸椎脫臼法處死,無菌條件下剖腹抽取臍血干細胞,以DMEM培養基懸浮組織,移入10 cm2的培養皿中,置37℃恒溫培養箱中消化1.5 h,棄消化液,磷酸鹽緩沖液(PBS)清洗3次,加入含血清培養基后置5% CO2,37℃,飽和濕度的孵箱中培養。在24 h首次換液后,1 000 r/min離心5 min,棄上清后采用完全培養基進行重懸,計數板計數之后,濃度調整到5×109/L,接種在培養瓶中,每3 d換液,待細胞長至90%~95%融合,以0.25%胰蛋白酶消化傳代,5×105個細胞數接種于25 mL培養瓶,標記為P1,后每3~4 d換液,待細胞達到融合生長后繼續傳代,體積分數5%的CO2培養箱單重進行貼壁培養,運用倒置顯微鏡下觀察細胞生長狀況和形態變化。使用P3代細胞進行下一步實驗。
1.3.2 形態學觀察[11]將生長狀態良好的P3代細胞以5×104/mL種植于10 cm2培養皿中,每天在倒置相差顯微鏡下觀測細胞狀態并拍照,待細胞70%~80%融合,PBS洗3次,4%多聚甲醛15 min固定,雙蒸水沖洗,顯微鏡下拍照。
1.3.3 細胞表面抗原免疫熒光鑒定[12]4%多聚甲醛固定細胞之后,3%過氧化氫消除內源性過氧化物酶15 min,使用PBS洗三次,0.5%的曲拉通打孔15 min,PBS洗3次,5%BSA封閉30 min,甩干,不洗,滴加兔多克隆抗體CD44、CD34、CD105,4℃過夜后,PBS洗5次,滴加生物素標記二抗羊抗兔,PBS洗5次,常溫30 min,滴加SABC-FITC,SABC-CY3室溫30 min之后,PBS洗5次,Hoechst33258染核5 min,抗熒光淬滅封片劑封片,熒光顯微鏡拍照。
1.3.4 DAPI標記臍血干細胞[13]取P3代臍血干細胞,待細胞60%~70%融合時,培養液中加入終濃度為1 μg/mL的DAPI溶液,孵育12 h后用PBS洗滌至少6次,去除未與細胞結合的DAPI,在熒光顯微鏡下觀察細胞標記情況。
1.3.5 急性肝衰竭大鼠模型制備[14]取40只雄性大鼠,經大鼠大鼠腹腔內注射注射1.2 g/kg的D-氨基半乳糖,建立急性肝衰竭模型。肝臟組織病理學證實模型成功。
1.3.6 分組處理 40只雄性大鼠,按照隨機數表法將大鼠隨機分為四組。對照組采用腹腔注射生理鹽水、移植組采用腹腔移植2×107臍血干細胞,第1天2 mL,之后每天0.5 mL,連續注射6 d、聯合組采用腹腔移植2×107臍血干細胞聯合注射肝再生增強因子50 μg·kg-1·d-1,共6 d、增強因子組采用腹腔注射肝再生增強因子50 μg·kg-1·d-1,共6 d,每組各10只。用DAPI標記肝細胞。以上各組治療后均動態觀測1個月。
1.4 主要觀察指標 對臍血干細胞的培養鑒定,造模情況、臍血干細胞歸巢定植情況。大鼠急性肝衰竭后,經治療一個月后分別取四組大鼠肝組織制作冰凍切片,并于熒光顯微鏡下觀察肝組織中DAPI標記的細胞計數。
1.5 統計學方法 所有采集的數據應用SPSS21.0統計軟件進行分析。其中對符合正態分布資料的數據以均數±標準差(±s)表示,遵循正態分布而且方差齊性,兩兩比較采用LSD檢驗,以P<0.05為差異有統計學意義。
2 結 果
2.1 大鼠臍血干細胞的分離培養 早期分離培養的細胞呈圓形,隨后逐漸伸展,呈梭形的臍血干細胞顯著增多,散在或呈簇狀分布,見圖1。
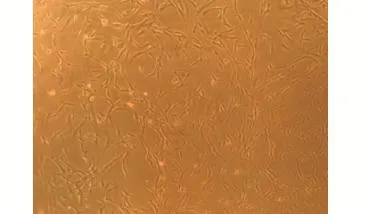
圖1 大鼠臍血干細胞的分離培養(×100)
2.2 大鼠臍血干細胞表面標志物測定 免疫熒光法結果顯示細胞均一性較好,CD105+、CD44+、CD34+的陽性率分別為6.18%、62.59%、73.66%,傳代貼壁生長的梭形細胞為臍血干細胞,見圖2。

圖2 大鼠臍血干細胞表面標志物測定(×100)
2.3 動物情況 大鼠于急性肝衰竭造模成功后半天內開始活動、進食和飲水。①對照組:2只于第二天后死亡,余8只均存活。②增強因子組:2只大鼠因門靜脈注入干細胞后止血不徹底而死亡,成活8只。③移植組:1只大鼠于注入干細胞后即出現呼吸困難、四肢無力而死亡,成活9只。④聯合組:有1只大鼠因移植后出現凝血功能障礙而死亡,成活9只。對照組中3只、臍血干細胞門靜脈移植組、臍血干細胞門靜脈移植聯合注射集落刺激因子組和臍血干細胞門靜脈移植聯合中藥灌胃組各有3只出現顯著的腹部膨隆,解剖腹腔發現大量清亮腹水。
2.4 臍血干細胞歸巢情況 臍血干細胞移植術后一個月,在熒光顯微鏡觀察肝組織中帶有藍色熒光的DAPI標記陽性的臍血干細胞細胞:肝臟歸巢及定植的干細胞聯合組>移植組>增強因子組>對照組,各組比較差異具有統計學意義(P<0.05),見表2。

表2 臍血干細胞歸巢情況(個細胞/100倍視野)
3 討 論
多種原因引起的急性肝功能衰竭其病情危急、發病迅速、致死率極高,當疾病浸入終末期時,傳統的藥物治療效果有效,不能及時有效發揮租用,目前臨床上較為公認有效的方法為人工肝及肝移植之勞,但是由于要求條件較高且供體來源缺乏限制了其應用的開展[15]。間充質干細胞作為一種新型的生物治療手段,近年來不斷被大家認識。其能夠誘導跨胚層分化,通過自分泌、旁分泌等機制發揮免疫調節及修復靶向組織的作用,在肝衰竭之后,間充質干細胞能夠靶向趨化、定植、歸巢,誘導分化為肝細胞,促進肝細胞的再生,并表達肝細胞的相關功能,從而發揮修復肝臟[16]。以往應用骨髓間充質干細胞,但是由于其取材困難、數量有限,因此限制了其應用。臍帶血具有某些生物特性,含有較多的造血祖細胞及干細胞,其具有較強的體外集落形成能力,可刺激細胞進入生長周期,且具有較強的自分泌和增殖能力,其能力優于骨髓及外周血干細胞,因此近年來受到了廣泛關注[17]。臍血中具有T淋巴細胞群,其抗原抗體表達弱,因此排異反應較弱,且細胞毒性較低,加上免疫系統不成熟,因此排斥反應較少,一般情況下不會出現抗宿主反應。同時臍血干細胞還具有間充質干細胞的特性,具有多向分化的潛能,可在細胞因子的誘導下向靶細胞分化,加上其還具有較強的體外增殖能力,因此是組織工程修復的良好種子細胞[18]。
本研究通過建立肝衰竭大鼠模型,以探討該病有效的細胞治療效果。D-氨基半乳糖是公認的建立急性肝衰竭動物模型的藥物,其主要通過干擾肝臟內UTP代謝,導致肝細胞RNA及蛋白質代謝障礙,從而誘導肝細胞壞死,造模之后我們通過病理檢查發現,急性肝衰竭肝組織出現大量溶解現象,肝小葉結構崩解、嗜酸性粒細胞增多,炎癥細胞浸潤[19]。本研究通過成功建立急性肝衰竭模型,在造模之后,通過研究三種不同干預手段對肝衰竭大鼠進行治療觀察,了解臍血干細胞其在肝臟的歸巢、定植及對肝再生的作用,對其產生的不同結果進行統計學分析,為臍血干細胞移植聯合肝再生增強因子治療急性肝衰竭提供理論依據,并闡明移植中促干細胞歸巢的作用。
我們通過腹腔移植的方法,其移植數量較大,且操作簡單、并發癥小、腹腔內無明顯的粘連,可提高大鼠的存活率,大量臨床研究表明該移植途徑具有較高的安全性及可行性。通過四組不同干預手段的治療,結果提示,聯合組的肝臟歸巢及定植的干細胞多于移植組,而移植組的肝臟歸巢及定植的干細胞又多于增強因子組,增強因子組的肝臟歸巢及定植的干細胞又多于對照組,各組比較差異均具有統計學意義(P<0.05)。不同干預手段對臍血干細胞歸巢、定植于肝臟有一定影響,聯合組的干細胞歸巢率優于移植組和增強因子組。肝再生增強因子是一種有效骨干再生因子,有研究發現通過肝再生因子的治療,可降低肝衰竭大鼠的死亡率,促進肝再生,降低轉氨酶水平。本研究聯合使用臍血干細胞及肝再生增強因子治療之后,有效促進了肝衰竭大鼠恢復,促進臍血干細胞的定植歸巢,進而促進肝臟的肝細胞增殖及修復[20]。
綜上所述,臍血干細胞移植聯合肝再生增強因子是一種較為理想的急性肝衰竭治療手段,可促進肝臟再生,改善肝臟組織及功能,提高存活率,且通過肝再生增強因子的移植可有效促進臍血干細胞向肝細胞增殖分化。D-氨基半乳糖有效模擬了人體的急性肝衰竭病情,所采用的同種異體移植的方式與臨床上實際情況相似,為進一步臨床治療提供了應用依據,我們將進一步深入探討該治療的免疫調控機理,為將來的臨床應用奠定基礎。
[1]Ezzat TM,Dhar DK,Newsome PN,et al.Use of hepatocyte and stem cells for treatment of post-resectional liver failure:are we there yet [J].Liver Int,2011,31(6):773-784.
[2]張丹,王允野.骨髓間充質干細胞在肝纖維化中的研究進展[J].中國實用醫藥,2014,9(12):249-250.
[3]羅建蓉,賈永前.人臍血間充質干細胞的體外分離、培養[J].中國醫藥導刊,2010,12(12):2124-2127.
[4]張在祺,姚鵬,楊大偉,等.Fibroscan對自體骨髓干細胞移植治療失代償期肝硬化的療效評估[J].世界華人消化雜志,2012,20(18): 1630-1637.
[5]Abdulrazzak H,Moschidou D,Jones G,et al.Biological characteristics of stem cells from foetal,cord blood and extraembryonic tissues [J].J R Soc Interface,2010,7 Suppl 6:S689-706.
[6]師玲玲,劉赴平,王立生,等.人臍血間充質干細胞移植治療大鼠急性肝損傷[J].暨南大學學報(自然科學與醫學版),2011,32(2): 188-193.
[7]Bakhtina A,Tohfafarosh M,Lichtler A,et al.Characterization and differentiation potential of rabbit mesenchymal stem cells for translational regenerative medicine[J].In Vitro Cell Dev Biol Anim,2014, 50(3):251-260.
[8]Manuyakorn W,Howarth PH,Holgate ST.Airway remodelling in asthma and novel therapy[J].Asian Pac J Allergy Immunol,2013,31 (1):3-10.
[9]喬飛,張馨,盛云峰,等.臍帶血干細胞治療肝硬化失代償期療效觀察[J/CD].中國肝臟病雜志(電子版),2011,3(2):10-13.
[10]梁麗,顧福嘉,黃國美,等.臍血干細胞移植治療失代償期肝硬化效果觀察[J].鄭州大學學報(醫學版),2014,49(4):552-555.
[11]郭健,陳洪,王智.干細胞移植治療肝硬化Meta分析[J].東南大學學報(醫學版),2013,32(4):429-436
[12]郭子寬.間充質干細胞及其臨床應用中的幾個問題[J].中國組織工程研究,2012,16(1):1-10.
[13]Rodríguez R,García-Castro J,Trigueros C,et al.Multipotent mesenchymal stromal cells:clinical applications and cancer modeling[J]. Adv Exp Med Biol,2012,741:187-205.
[14]Berair R,Saunders R,Brightling CE.Origins of increased airway smooth muscle mass in asthma[J].BMC Med,2013,11:145.
[15]Gilgenkrantz H,Collin de l'Hortet A.New insights into liver regeneration[J].Clin Res Hepatol Gastroenterol,2011,35(10):623-629.
[16]周曉玲,謝勝,陳峭,等.臍血干細胞移植結合補益腎氣利濕法治療ChildA、B級肝硬化的療效及機制探討[J].實用臨床醫藥雜志, 2014,18(17):25-28.
[17]高琳琳,關方霞,鄭鵬遠,等.人羊膜臍帶源性間充質干細胞對大鼠肝硬化的治療作用[J].世界華人消化雜志,2012,20(11):916-922
[18]Carolyn A,Holladay,Aoife M,et al.Recovery of cardiac function mediated by MSC and interleukin-lO plasmid functionalized scaffold [J].Biomaterials,2012,33(5):1303-1314.
[19]Luo Y,Wang Y,Poynter JA,et al.Pretreating mesenchymal stem cells with interlenkin-ipand transforming growth factor-1 Psynergistically increases vascular endothelial growth factor production and improves mesenchymal stem cell-mediated myocardial protection after acute ischemia[J].Surgery,2012,151(3):353-363.
[20]Ronzani C,Casset A,Pons F.Exposure to multi-walled carbon nanotubes results in aggravation of airway inflammation and remodeling and in increased production of epithelium-derived innate cytokines in a mouse model of asthma[J].Arch Toxicol,2014,88(2):489-499.
Experimental study of umbilical cord blood stem cell transplantation and augmenter of liver regeneration in the treatment of acute liver failure.
TIAN Jia,ZHANG Mo-yang,ZHOU Zhong-yi,XIE Xiao-hong.Intensive Care Unit, People's Hospital of Hainan Province,Haikou 570010,Hainan,CHINA
ObjectiveTo observe the effect of umbilical cord blood stem cell transplantation and augmenter of liver regeneration(ALR)in the treatment of acute liver failure,in order to provide the basis for liver tissue engineering.MethodsForty rat models with liver failure,according to the random number table,were randomly divided into control group(intraperitoneal injection of normal saline),transplantation group(intraperitoneal transplantation of 2×107umbilical cord blood stem cells),combination group(intraperitoneal transplantation of 2×107umbilical cord blood stem cells combined with intraperitoneal injection ofALR 50 μg·kg-1·d-1)andALR group(intraperitoneal injection ofALR 50 μg·kg-1·d-1),with 10 rats in each group.Liver cells were labeled with DAPI.One month after treatment,liver tissue of the rats in the four groups were taken for frozen sections,and cell count was observed in liver tissue under fluorescence microscope based on DAPI label.ResultsThe stem cells of homing and colonization in combination group were(18.1±3.4)cells/100 magnification,which were significantly more than that in transplantation group of(12.6±2.0)cells/100 magnification,ALR group of (8.1±3.4)cells/100 magnification and control group of(3.1±3.4)cells/100 magnification,with statistically significant difference between each two of the four groups(P<0.05).ConclusionDifferent intervention means had different effect on the homing and colonization of umbilical cord blood stem cells,and the homing rate of stem cells in the combination group was better than transplantation group and ALR group.Therefore,umbilical cord blood stem cell transplantation combined withALR is an ideal treatment for the treatment of acute liver failure.
Umbilical cord blood stem cells;Liver homing;Acute liver failure;Augmenter of liver regeneration (ALR);Colonization
R657.3
A
1003—6350(2016)19—3105—04
10.3969/j.issn.1003-6350.2016.19.003
2016-03-05)
田佳。E-mail:tianjia8898@sina.com

