甲狀腺激素對體外循環腦損傷保護作用的研究
賈龍飛,陳群清,吳源周,李少彬,閆玉生,童健(南方醫科大學珠江醫院胸心外科,廣東廣州510280)
?
甲狀腺激素對體外循環腦損傷保護作用的研究
賈龍飛,陳群清,吳源周,李少彬,閆玉生,童健
(南方醫科大學珠江醫院胸心外科,廣東廣州510280)
摘要:目的探討體外循環(CPB)心臟手術中,甲狀腺激素(TH)對患者腦損傷的保護作用。方法152例CPB心臟瓣膜置換術患者隨機分為干預組和對照組,每組76例,干預組于術前7 d開始口服左甲狀腺素鈉片(優甲樂)50μg/d至手術日早晨。檢測術前(T1)、CPB開始后30 min(T2)、CPB結束時(T3)、CPB結束后6 h(T4)和CPB結束后24 h(T5)的血清S100-β蛋白、神經元特異性烯醇化酶(NSE)、白細胞介素6(IL-6)、C反應蛋白(CRP)、游離三碘甲腺原氨酸(FT3)水平,并于術晨、術后1、3和7 d對患者進行簡易智能狀態檢查量表(MMSE)評分。結果在T2、T3、T4時,干預組S100-β蛋白水平低于對照組(P<0.05);在術中及術后24 h內,干預組NSE、IL-6、CRP水平顯著低于對照組(P<0.05),干預組FT3水平顯著高于對照組(P<0.05)。術后1周內,干預組MMSE評分高于對照組(P<0.05)。結論CPB術前應用TH,可有效地提高圍手術期血清TH水平,通過抑制炎癥因子,產生一定的腦保護作用。
關鍵詞:甲狀腺激素;體外循環;腦保護;低T3綜合征;腦損傷
自1954年Gibbon報道將體外循環(cardiopulmonary bypass,CPB)技術用于心臟直視手術以來,心臟外科手術取得飛速發展,但CPB導致的腦損傷一直是心臟外科面臨的重要臨床問題。在CPB心臟手術期間腦微血栓的形成、腦灌注改變以及系統性或局部性的炎癥級聯反應等因素常造成腦損傷。據文獻報道,術后嚴重的中風發生率為2%~5%,病理性腦病發生率為10%~30%,認知功能障礙在術后1周內的發生率為50%~70%,術后2個月其發生率仍高達30%~50%,嚴重者甚至死亡[1]。中樞系統的并發癥在一定程度上增加患者死亡率,延長住院時間,降低生活質量,并消耗更多的醫療資源,因此心臟手術期間腦保護意義重大[2]。目前,國內外腦保護的方法仍然是低溫、保證腦供血和缺血預處理等,缺乏理想、安全、低成本的腦保護藥物。
心臟術后常常出現低T3綜合征,甲狀腺激素(thyroid hormone,TH)應用于心臟手術,可顯著提高患者術后游離三碘甲腺原氨酸(free triiodothyronine,FT3)水平,減少術后心功能不全發生率[3]。目前,在腦死亡的心臟捐贈者中經常應用TH,其原因是TH可有效提高移植心臟的功能,同時TH有較好的腦保護作用[3-4]。另外,TH被認為在缺血性腦疾病中具有明顯腦保護作用[5]。然而TH在心臟手術腦損傷的預防及治療方面研究甚少,并且TH在CPB心臟手術腦損傷過程中的作用機制不明確。本文通過隨機研究方法觀察術前口服左甲狀腺素鈉片對心臟手術患者血清中腦損傷炎癥因子指標的影響,探索TH對CPB手術的腦保護作用。
1 資料與方法
1.1一般資料
選取2013年1月-2015年3月在本院接受CPB下行心內直視手術心臟瓣膜置換的患者152例。其中,男性81例,女性71例;年齡23~73歲,美國美國紐約心臟病學會分級Ⅱ~Ⅳ級。納入標準:①無甲狀腺疾病病史;②無缺血性與出血性腦血管疾病病史;③無其他神經精神疾病病史;④頭顱CT檢查無腦梗死或腦出血灶。隨機分為:干預組和對照組,每組76例。
1.2實驗分組
干預組患者術前1周開始口服50μg左甲狀腺素鈉片,1次/d,(商品名:優甲樂,德國默克公司生產)至術晨。
1.3手術方式
手術在氣管內全身麻醉、中低溫CPB下進行,膜式氧合器(美國美敦力公司生產)行體外血流氧合,平均主動脈灌注壓保持在60~80 mmHg;胸骨正中切口進胸,心臟切口從右心房-房間隔入路行二尖瓣置換,升主動脈根部斜切口行主動脈瓣置換(使用人工機械瓣膜)。其中二尖瓣置換術103例,主動脈瓣置換術29例,雙瓣置換術(二尖瓣聯合主動脈瓣置換術)20例。
1.4觀察項目及檢查方法
分別于術前(T1)、CPB開始后30 min(T2)、CPB結束時(T3)、CPB結束后6 h(T4)和CPB結束后24 h (T5)采集頸內靜脈球部血樣各5 ml,以酶聯免疫吸附法(enzyme-linked immunosorbent assay,ELISA)檢測S100-β蛋白、神經元特異性烯醇化酶(neuron specific enolase,NSE)、白細胞介素6(interleukin-6,IL-6)水平,以免疫比濁法檢測C反應蛋白(C-reac tive protein,CRP)水平,以放射免疫法檢測FT3水平。術晨、術后1、3和7 d對患者進行簡易智能狀態檢查量表(mini-mental state examination,MMSE)評分。1.5統計學方法
采用SPSS 19.0統計軟件進行數據分析,計量資料以均數±標準差(±s)表示,組內重復測量資料用方差分析,兩組間計量資料比較用t檢驗,計數資料比較用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1一般情況
干預組與對照組在性別、年齡、體重、身高、心臟瓣膜置換類型、CPB時間、主動脈阻斷時間等方面比較,差異無統計學意義(P>0.05)。見表1。
2.2血清生化指標
T1時,兩組S100-β蛋白、NSE、IL-6、CRP及FT3水平比較,差異無統計學意義(P>0.05)。CPB開始后,兩組S100-β蛋白、NSE、IL-6、CRP水平開始上升,其中S100-β蛋白、NSE、CRP水平在T3時達高峰,停機后回落,IL-6水平在T4時達高峰,之后下降。干預組S100-β蛋白水平在T2、T3、T4時顯著低于對照組(P<0.05),T5時干預組仍低于對照組,但差異無統計學意義(P=0.149);干預組在術中及術后,NSE、IL-6、CRP水平顯著低于對照組(P<0.05)。兩組血清FT3水平在CPB后開始下降,FT3水平在T3時達最低點,停CPB后開始上升。在術中及術后,干預組FT3水平顯著高于對照組(P<0.05)。見表2。
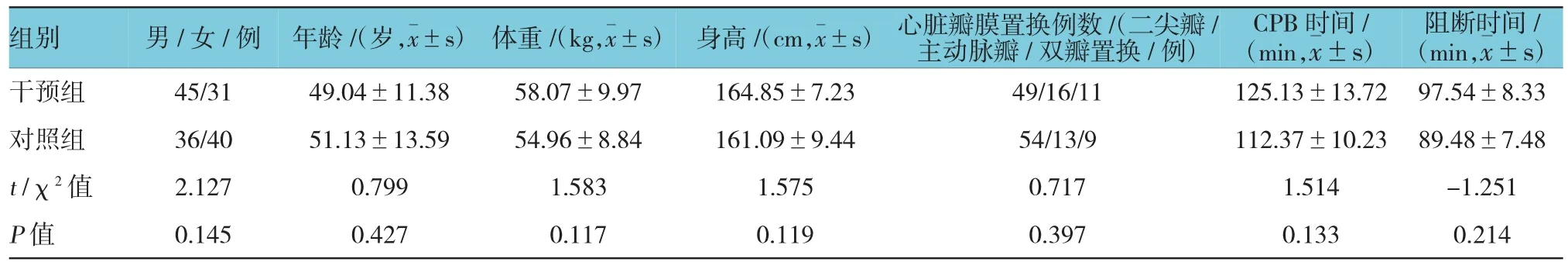
表1 兩組患者的一般資料
2.3MMSE評分結果
術晨兩組患者MMSE評分比較,差異無統計學意義(P=0.762)。術后兩組患者MMSE評分較術前開始下降,術后1 d時MMSE評分最低,之后兩組患者MMSE評分開始上升。術后7d時,干預組MMSE評分與術晨比較,差異無統計學意義(P=0.137);對照組MMSE評分仍低于術晨(P=0.002)。術后1周內,干預組MMSE評分明顯高于對照組(P<0.05)。見表3。
表2 兩組患者不同時間的血清生化指標比較(±s)
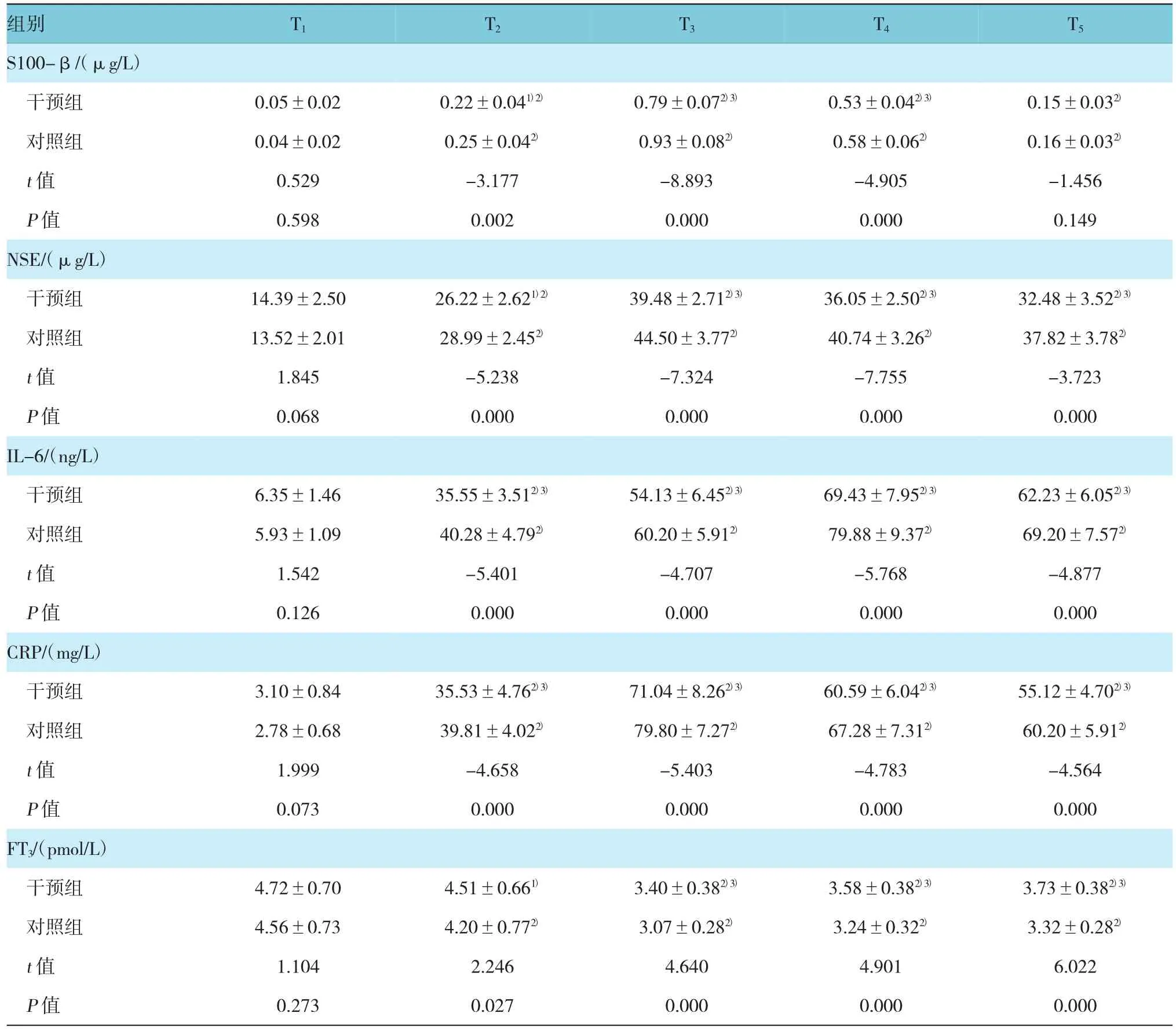
表2 兩組患者不同時間的血清生化指標比較(±s)
注:1)與對照組比較,P<0.05;2)與T1比較,P<0.01;3)與對照組比較,P<0.01;4)與T1比較,P<0.05
組別 T1 T2 T3 T4 T5S100-β/(μg/L)干預組 0.05±0.02 0.22±0.041)2) 0.79±0.072)3) 0.53±0.042)3) 0.15±0.032)對照組 0.04±0.02 0.25±0.042) 0.93±0.082) 0.58±0.062) 0.16±0.032)t值 0.529 -3.177 -8.893 -4.905 -1.456 P值 0.598 0.002 0.000 0.000 0.149 NSE/(μg/L)干預組 14.39±2.50 26.22±2.621)2) 39.48±2.712)3) 36.05±2.502)3) 32.48±3.522)3)對照組 13.52±2.01 28.99±2.452) 44.50±3.772) 40.74±3.262) 37.82±3.782)t值 1.845 -5.238 -7.324 -7.755 -3.723 P值 0.068 0.000 0.000 0.000 0.000 IL-6/(ng/L)干預組 6.35±1.46 35.55±3.512)3) 54.13±6.452)3) 69.43±7.952)3) 62.23±6.052)3)對照組 5.93±1.09 40.28±4.792) 60.20±5.912) 79.88±9.372) 69.20±7.572)t值 1.542 -5.401 -4.707 -5.768 -4.877 P值 0.126 0.000 0.000 0.000 0.000 CRP/(mg/L)干預組 3.10±0.84 35.53±4.762)3) 71.04±8.262)3) 60.59±6.042)3) 55.12±4.702)3)對照組 2.78±0.68 39.81±4.022) 79.80±7.272) 67.28±7.312) 60.20±5.912)t值 1.999 -4.658 -5.403 -4.783 -4.564 P值 0.073 0.000 0.000 0.000 0.000 FT3/(pmol/L)干預組 4.72±0.70 4.51±0.661) 3.40±0.382)3) 3.58±0.382)3) 3.73±0.382)3)對照組 4.56±0.73 4.20±0.772) 3.07±0.282) 3.24±0.322) 3.32±0.282)t值 1.104 2.246 4.640 4.901 6.022 P值 0.273 0.027 0.000 0.000 0.000
表3 兩組患者不同時間的MMSE評分比較(±s)
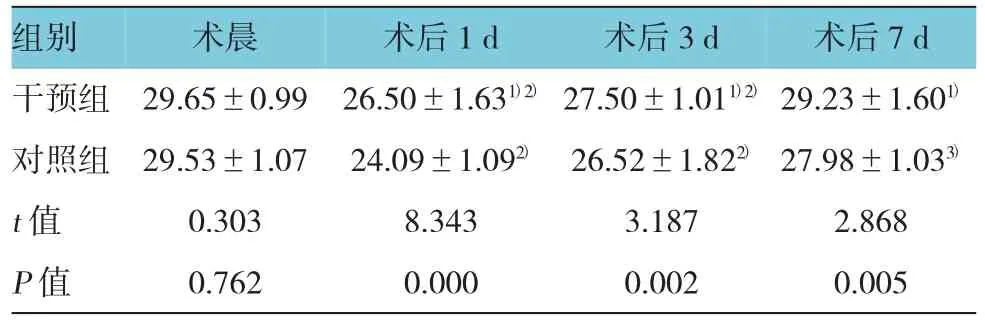
表3 兩組患者不同時間的MMSE評分比較(±s)
注:1)與對照組比較,P<0.01;2)與術晨比較,P<0.01;3)與術晨比較,P<0.05
組別 術晨 術后1 d 術后3 d 術后7 d干預組 29.65±0.99 26.50±1.631)2)27.50±1.011)2)29.23±1.601)對照組 29.53±1.07 24.09±1.092) 26.52±1.822)27.98±1.033)t值 0.303 8.343 3.187 2.868 P值 0.762 0.000 0.002 0.005
3 討論
CPB過程中,由于缺血、缺氧,激活炎癥級聯反應,炎癥因子大量表達與釋放,促進腦水腫形成、血腦屏障破壞及神經元變性壞死,造成腦損傷。S100-β蛋白是一種酸性鈣結合蛋白,主要分布于施旺細胞和神經膠質細胞內,正常情況下不能透過血腦屏障,神經系統損傷時則可進入腦脊液,并通過血腦屏障進入血液[6-8]。因此,S100-β蛋白作為腦損傷標志物具有重要的診斷價值。NSE是糖酵解途徑中的關鍵酶—烯醇化酶的一種。有研究顯示,其特異性存在于神經元和神經內分泌細胞中。腦損傷后,NSE能從細胞中釋放出來,通過受損的血腦屏障進入血液循環中,被認為是反映腦損傷的一種靈敏的監測指標[9-10]。S100-β與NSE兩者聯合檢測是迄今為止最可靠的腦損傷生化指標[6-7,9]。本研究結果提示,兩組患者S100-β和NSE蛋白水平在CPB開始后逐漸升高,復溫期達峰值,以后逐漸降低;干預組S100-β蛋白水平在T2、T3、T4時顯著低于對照組(P<0.05),在術中及術后24 h內,干預組NSE水平顯著低于對照組(P<0.05),提示TH可在一定程度上減少CPB心臟手術患者S100-β和NSE蛋白的釋放,減輕腦損傷的作用。
在體外循環患者炎癥反應所導致的腦損傷發生機制中,細胞因子及其他炎癥介質的釋放占突出地位。生理狀態下,IL-6主要來源于小腦中的Purkjuje細胞及海馬區的椎體細胞、顆粒細胞,而且腦內的小膠質細胞、星形細胞、血管內皮細胞等也能產生IL-6[6,11]。高濃度的IL-6通過趨化作用使中性粒細胞向病變區域大量聚積,釋放毒性氧自由基,并與其他炎癥細胞協同發揮細胞毒性作用,導致腦細胞水腫或壞死。CRP是目前最有價值的急性時相反應蛋白之一,其血清濃度的升高可間接反應損傷及炎癥反應的程度[11-12]。血清IL-6及CRP水平可作為炎癥反應程度及病情進展的重要生化指標。本研究結果提示,兩組患者IL-6和CRP水平在CPB開始后逐漸升高,IL-6在T4時達峰值,CRP在T3時達峰值,以后逐漸降低;在術中及術后24 h內,干預組IL-6 和CRP水平低于對照組(P<0.05)。術前口服優甲樂早期能顯著減少術中及術后炎癥因子IL-6及CRP的釋放,抑制腦內炎癥級聯反應,對CPB過程中的腦損傷有一定的保護作用。Lin等[13]對TH神經保護作用的分子機制的研究表明,TH通過刺激細胞膜上的Na+-H+交換體來減少細胞內H+蓄積,還能通過激動細胞膜的Ca2+-ATP酶的來降低細胞內Ca2+濃度,緩解神經元細胞內鈣超載,減少神經元凋亡。基礎研究表明,TH通過下調凋亡誘導蛋白——Bax蛋白表達,上調抗凋亡蛋白——Bcl-2蛋白表達來降低腦梗死[14],抑制缺血大腦星形膠質細胞和小膠質細胞的激活,增加神經營養因子表達,調節炎癥級聯反應相關酶類(包括iNOS和COX-2)。兩組患者術后MMSE評分較術前顯著降低,以術后1 d認知功能最差,之后患者認知功能開始逐漸恢復,術后干預組MMSE評分高于對照組(P<0.05)。術后7 d時,干預組MMSE評分與術晨比較,差異無統計學意義(P= 0.137),認知功能恢復至正常水平;但對照組MMSE評分仍低于術晨(P=0.002)。另外,兩組患者術后未出現昏迷及嚴重認知障礙,提示CPB心臟瓣膜置換術患者術后易發生輕度認知功能障礙,TH可促進術后早期認知功能恢復。
在CPB心臟術后,患者常伴有低T3綜合征[15],圍手術期口服TH替代治療,能夠有效預防術后低T3綜合征[16]。筆者的前期研究表明,術前1周短期服用優甲樂可顯著提高血FT3水平,患者的基礎代謝率也無明顯提高[17]。本研究表明,在術中及術后,干預組FT3水平高于對照組(P<0.05)。Malekpour等[18]研究表明,血清低T3水平會進一步加重腦損傷,并且患者的死亡率與血清低T3水平密切相關。結合術后兩組血清S100-β蛋白、NSE、IL-6、CRP檢測結果,術前短期適當補充TH能有效地提高術后血清FT3水平,抑制腦損傷炎癥因子釋放,促進腦功能恢復。
綜上所述,TH能夠改善低T3綜合征,降低CPB心臟瓣膜置換術患者圍術期腦損傷指標,減輕圍術期炎癥反應,改善患者早期術后認知功能,具有一定的腦保護作用。優甲樂是臨床常用藥,使用安全且價格低廉,值得進一步研究和推廣。由于CPB過程中腦損傷機制復雜,TH的腦保護機制有待進一步研究,遠期效果亟待大量臨床研究及更多的評價指標證實。
參考文獻:
[1] Bruggemans EF. Cognitive dysfunction after cardiac surgery: pathophysiological mechanisms and preventive strategies[J]. Neth Heart J, 2013, 21(2): 70-73.
[2] Carrascal Y, Guerrero AL. Neurological damage related to cardiac surgery: pathophysiology,diagnostic tools and prevention strategies. Using actual knowledge for planning the future[J]. Neurologist, 2010, 16(3): 152-164.
[3]陳群清,閆玉生.甲狀腺激素在心臟移植中的應用[J].中國胸心血管外科臨床雜志, 2005, 12(6): 426-428.
[4] Macdonald PS, Aneman A, Bhonagiri D, et al. A systematic review and meta-analysis of clinical trials of thyroid hormone administration to brain dead potential organ donors[J]. Crit Care Med, 2012, 40(5): 1635-1644.
[5] Mdzinarishvili A, Sutariya V, Talasila PK, et al. Engineering triiodothyronine (T3) nanoparticle for use in ischemic brain stroke[J]. Drug Deliv Transl Res, 2013, 3(4): 309-317.
[6] Bersani I, Auriti C, Ronchetti MP, et al. Use of early biomarkers in neonatal brain damage and sepsis: state of the art and future perspectives[J]. Biomed Res Int, 2015, 2015: 1-10.
[7] Yuan SM. Biomarkers of cerebral injury in cardiac surgery[J]. Anadolu Kardiyol Derg, 2014, 14(7): 638-645.
[8] Cheng F, Yuan Q, Yang J, et al. The prognostic value of serum neuron-specific enolase in traumatic brain injury: systematic reviewand meta-analysis [J]. PLoS One, 2014, 9 (9): DOI: 10.1371/journal.pone.0106680.
[9]韓文冬,張麗娟.七氟醚后處理對體外循環心內直視手術患者圍手術期腦保護作用[J].中國現代醫學雜志, 2012, 22(22): 96-99.
[10]付慶林,張新中,韓培立,等.銀杏葉提取物對體外循環腦損傷中黏附分子的干預作用[J].中國現代醫學雜志, 2009, 19(24): 3748-3752.
[11] Pearlman DM, Brown JR, Mackenzie TA, et al. Blood levels of S-100 calcium-binding protein B, high sensitivity C-reactive protein, and interleukin-6 for changes in depressive symptom severity after coronary artery bypass grafting: prospective cohort nested within a randomized, controlled trial[J]. PLoS One, 2014, 9(10): DOI: 10.1371/journal.pone.e111110.
[12] Worthmann H, Tryc AB, Dirks M, et al. Lipopolysaccharide binding protein, interleukin-10, interleukin-6 and C-reactive protein blood levels in acute ischemic stroke patients with post-stroke infection[J]. J Neuroinflammation, 2015, 12: 13.
[13] Lin HY, Davis FB, Luidens MK, et al. Molecular basis for certain neuroprotective effects of thyroid hormone [J]. Front Mol Neurosci, 2011, 4: 29.
[14] Genovese T, Impellizzeri D, Ahmad A, et al. Post-ischaemic thyroid hormone treatment in a rat model of acute stroke[J]. Brain Res, 2013, 1513: 92-102.
[15] Babazadeh K, Tabib A, Eshraghi P, et al. Non-thyroidal illness syndrome and cardiopulmonary bypass in children with congenital heart disease[J]. Caspian J Intern Med, 2014, 5(4): 235-242.
[16] Choi YS, Kwak YL, Kim JC, et al. Peri-operative oral triiodothyronine replacement therapy to prevent postoperative low triiodothyronine state following valvular heart surgery[J]. Anaesthesia, 2009, 64: 871-877.
[17]陳群清,莫文魁,陳麗萍,等.甲狀腺激素的應用對風濕性心臟病二尖瓣置換術后早期房顫復律作用的隨機研究[J].中華臨床醫師雜志, 2013, 24: 11153-11156.
[18] Malekpour B, Mehrafshan A, Saki F, et al. Effect of posttraumatic serum thyroid hormone levels on severity and mortality of patients with severe traumatic brain injury[J]. Acta Medica Iranica, 2012, 50(2): 113-116.
(童穎丹編輯)
Protective effect of thyroid hormone on neurological damage in cardiopulmonary bypass
Long-fei Jia, Qun-qing Chen, Yuan-zhou Wu, Shao-bin Li, Yu-sheng Yan, Jian Tong
(Department of Cardiothoracic Surgery, Zhujiang Hospital of Southern Medical University, Guangzhou, Guangdong 510280, China)
Abstract:Objective To explore the protective effect of thyroid hormone (TH) on neurological damage in cardiopulmonary bypass (CPB). Methods Totally 152 patients performed with heart valve replacement were randomly divided into treatment group (n = 76) and control group (n = 76). In the treatment group, 50 μg levothyroxine sodium (Euthyrox) was given daily from a week before surgery to the morning of surgery. Serum levels of S100-β protein, neuron specific enolase (NSE), interleukin 6 (IL-6), C-reactive protein (CRP) and free triiodothyronine (FT3) were detected at the time before opearation (T1), 30 min after beginning of CPB (T2), when CPB was ended (T3), 6 h (T4) and 24 h (T5) after CPB. The patientsˊcognitive function was assessed with mini-mental state examination (MMSE) before operation and 1, 3 and 7 d after operation. Results The concentrations of plasma S100-β protein at T2, T3and T4were significantly lower in the treatment group than those in the control group (P<0.05). During operation and within 24 h after operation the concentrations of plasma NSE, IL-6 and CRP were significantly lower in the treatment group than those in the control group(P<0.05), and the concentration of plasma FT3 was significantly higher in the treatment group than that in the control group (P<0.05). The MMSE score was higher in the treatment group than that in the control group within 1 w after operation (P<0.05). Conclusions Preoperative application of TH can effectively improve the perioperative serum TH level and produce certain cerebral protection by inhibiting the inflammatory factors in cardiopulmonary bypass.
Keywords:thyroid hormone; cardiopulmonary bypass; cerebral protection; low T3 syndrome; neurological damage
收稿日期:2015-09-22
文章編號:1005-8982(2016)03-0063-05
DOI:10.3969/j.issn.1005-8982.2016.03.013
中圖分類號:R654.1
文獻標識碼:A

