一種高效省時的利用磷酸鈣轉染DNA的改進方法
黃 進,傅吉強,張慶華*
(同濟大學a.生命科學與技術學院,b.醫學院,中國 上海 200092)
?
一種高效省時的利用磷酸鈣轉染DNA的改進方法
黃進a,傅吉強b,張慶華a*
(同濟大學a.生命科學與技術學院,b.醫學院,中國 上海200092)
摘要對傳統磷酸鈣轉染方法進行改進,即在經胰酶消化處理成懸浮狀態的293T細胞懸液中直接加入磷酸鈣轉染試劑,而不需待其貼壁后再加轉染試劑進行轉染.通過比較懸浮和貼壁狀態下293T細胞的轉染效率、細胞增殖和熒光強度等指標,發現這兩種轉染方法的各項指標沒有顯著性差異.結果表明,293T細胞在懸浮狀態下進行磷酸鈣轉染與傳統的貼壁轉染能夠達到同等效果,在用胰酶消化的單細胞懸液中直接加入磷酸鈣轉染試劑進行轉染,不影響細胞的轉染效果,節省了操作步驟,縮短了操作時間.
關鍵詞293T細胞;磷酸鈣;貼壁狀態;懸浮狀態;細胞轉染
An Efficient and Time-Saving Method for DNA Transfection Using Calcium Phosphate
HUANGJina,FuJi-qiangb,ZHANGQing-huaa*
(a.School of Life Science and Technology, b.School of Medicine, Tongji University, Shanghai 200092, China)
AbstractThe use of calcium phosphate for the transfection of adherent cells was a traditional and popular yet complicated and time-consuming method. In this paper, this traditional method is further improved through the direct addition of calcium phosphate transfection reagent into the trypsinized 293T cell suspension solution, instead of adding transfection reagent after the cells were adhered to the bottom. By comparison with such indicators as transfection efficiency, cell proliferation and fluorescence intensity of 293T cells in suspended status and adherent status, we found no significant difference between the two transfection methods with regard to these indicators. Based on the results from this work, the use of calcium phosphate in transfecting 293T cells in suspended status could be same efficient and effective as the traditional adherent transfection method. With the transfection efficiency unaffected, our method of directly adding calcium phosphate transfection reagent into the trypsinized single-cell suspension solution is not only experimentally simplified in procedure but also time-saving in operation.
Key words293T cells; calcium phosphate; adherent status; suspended status; cell transfection
目前有多種細胞轉染方法,例如脂質體轉染法[1]、基因鳥槍法、電穿孔法[2]、顯微注射法[3]和磷酸鈣共沉淀法等.脂質體轉染法雖然操作簡單,轉染效率較高,但脂質體價格昂貴,且細胞毒性較大;基因鳥槍法速度快,簡單易行,成本較低,但不適用于真核細胞;電穿孔法轉染效率高,但所需儀器較貴,對細胞損傷較大;顯微注射法整合效率高,不需載體,但需精密儀器,技術難度大,且價格昂貴;磷酸鈣轉染所需材料價格低廉,操作簡單,轉染效率高,適用范圍廣,且細胞毒性較低.所以,在很多DNA轉染細胞實驗中,多用磷酸鈣作為轉染試劑.
利用磷酸鈣將攜帶有外源基因的質粒DNA轉染到哺乳動物細胞,是一種操作簡單且應用廣泛的方法[4].磷酸鈣共沉淀是基于磷酸鈣-DNA復合物的轉染方法,在DNA的轉染過程中,磷酸鈣-DNA復合物黏附到細胞膜上并通過胞吞作用進入靶細胞[5],被轉染的DNA隨即整合到靶細胞的染色體中,從而產生有不同基因型和表型的穩定克隆.這種方法不僅適用于多種細胞,而且還具有生物相容性和降解性[6].磷酸鈣與DNA形成的復合物顆粒太大或太小都會影響細胞轉染效率.在磷酸鈣與DNA的混合過程中,雖然在大部分的弱堿性范圍內都會形成復合物顆粒,但只有在較短的孵育時間(例如1 min)、極小的pH范圍內形成的顆粒才能很好地被細胞攝取,從而獲得較高的轉染效率[7].
通常利用磷酸鈣轉染293T細胞是在鋪板并待其貼壁以后進行.但是在貼壁轉染時,只有暴露于培養基的上半部分細胞表面可以直接接觸到磷酸鈣-DNA復合物.進行大規模細胞轉染時,需要在轉染前一天進行細胞鋪板,操作繁瑣且耗時[8].而細胞在懸浮狀態下直接進行轉染時,細胞和磷酸鈣-DNA復合物都均勻分散于培養基中,293T細胞和磷酸鈣-DNA復合物同時沉降,在細胞貼壁的過程中,整個細胞表面(包括貼于培養皿的下半部分細胞表面)都會附著磷酸鈣-DNA復合物.所以相對來說,懸浮狀態下進行細胞轉染可以使細胞表面附著更多的磷酸鈣-DNA復合物,保證其能攝入足量的磷酸鈣-DNA復合物顆粒.因此,可以在貼壁細胞經胰酶消化成懸浮狀態之后、細胞鋪板之前的足量細胞懸液(例如鋪10個dish)中直接加入孵育好的磷酸鈣-DNA復合物,立即混勻,即進行懸浮轉染,然后依次鋪板.這種方法合并了細胞鋪板和細胞轉染過程,省去了貼壁轉染時逐個平皿滴加磷酸鈣-DNA復合物的過程(這個過程耗時長,磷酸鈣-DNA復合物顆粒很容易過大而影響轉染效果).所以,懸浮轉染比傳統的貼壁轉染操作更簡便、更省時且適合大規模操作[9].本研究基于磷酸鈣轉染細胞的以上特點,對比293T細胞在懸浮和貼壁狀態下的轉染效率、細胞增殖和熒光強度等指標,從而獲得了比傳統貼壁轉染更加簡便省時且高效的293T細胞磷酸鈣轉染方法,即懸浮轉染.
1材料與方法
1.1材料
1.1.1菌種與質粒大腸桿菌菌株Dpα,包裝質粒psPAX2,包膜蛋白質粒pMD2G,載體質粒pRRL-EF1α-eGFPLuc-WPRE,同濟大學附屬上海市肺科醫院臨床轉化中心實驗室保存.
1.1.2細胞株人腎胚胎(human embryonic kidney, HEK)293T細胞,同濟大學附屬上海市肺科醫院臨床轉化中心實驗室保存.
1.1.3試劑各種限制性內切酶購自美國New England Biolabs公司,達爾伯克改良伊格爾培養基(Dulbecco’s Modified Eagle’s Medium, DMEM) 購自美國Invitrogen Gibco公司,胎牛血清(Fetal Bovine Serum,FBS)購自美國Invitrogen Gibco公司,青霉素和鏈霉素溶液(以下簡稱雙抗)購自美國Hyclone公司,聚凝胺(Polybrene)購自美國Sigma-Aldrich公司,0.25%Typsin-EDTA購自美國Invitrogen Gibco公司,氯化鈣購自國藥集團.
1.2方法
1.2.1載體質粒pRRL-EF1α-eGFPLuc-WPRE的設計載體質粒pRRL-EF1α-eGFPLuc-WPRE(如圖1)有5′端呼吸道荷包病毒長末端重復序列5′RSV-LTR,剪接供體SD,病毒顆粒蛋白表達調節因子應答件RRE,剪接受體SA,中央多嘌呤序列cPPT,長啟動子EF1α,增強型的綠色熒光蛋白eGFP,熒光素酶Luciferase,土撥鼠肝炎病毒轉錄后調控元件WPRE和3′端長末端重復序列等系列元件組成.運用BamHⅠ和SpeⅠ等限制性內切酶和DNA重組技術將目的基因eGFP-Luciferase克隆到慢病毒載體質粒上.
1.2.2瞬時轉染取293T細胞鋪于6孔板中,每孔2×105個細胞,共分3組,每組3個重復樣孔,并編號,第1組為對照組,第2組為貼壁轉染組,第3組為懸浮轉染組,用含有雙抗(青霉素終濃度為0.833 mkat/L(即50 U/mL),鏈霉素終濃度為50 g/L)的完全DMEM培養基(含10%FBS)2 mL進行培養.24 h后,將第3組孔中細胞用200 μL胰酶消化1 min,然后加DMEM完全培養基終止,使細胞成懸浮狀態.第2組和第3組同時進行質粒的磷酸鈣轉染,首先每孔按照100 μL ddH2O,15 μL 2 mol/L CaCl2和2 μg載體質粒的量放于EP管中,并混勻,然后將等體積2×Hebs加入EP管中(需在液面以下加,邊加邊混勻,不超過20 s),靜置30 s,隨即將磷酸鈣-DNA復合物懸液貼液面均勻散開加入到相應孔中,然后將6孔板放入細胞培養箱進行培養.30 min后,在40倍光學顯微鏡下觀察6孔板培養基中沉淀大小及密度,然后再次將6孔板放回細胞培養箱培養.轉染12~16 h后,每孔用2 mL新鮮DMEM完全培養基換液處理.
1.2.3病毒包裝用三質粒系統轉染293T細胞制備皰疹性口炎病毒的包膜糖蛋白(vesicular stomatitis virus envelope glycoprotein, VSV-G)假型慢病毒顆粒[10].取293T細胞鋪于6孔板中,每孔1×106個細胞,共3組,每組3個重復樣孔,并編號,第1組為對照組,第2組為貼壁轉染組,第3組為懸浮轉染組,用含有雙抗的完全DMEM培養基(濃度同1.2.2)2 mL進行培養.24 h后,將第3組孔中細胞用200 μL胰酶消化1 min,然后加DMEM完全培養基終止,使細胞成懸浮狀態.將第2組和第3組進行質粒的磷酸鈣轉染,首先將每孔按照100 μL dd H2O,15 μL 2 mol/L CaCl2,0.75 μg psPAX2,0.5 μg pMD2G和2 μg載體質粒的量放于EP管中,并混勻,然后將等體積2×Hebs加入EP管中(需在液面以下加,邊加邊混勻,不超過20 s),靜置30 s,隨即將磷酸鈣-DNA復合物懸液貼液面均勻散開加入到相應孔中,然后將6孔板放入細胞培養箱進行培養.30 min后,在40倍光學顯微鏡下觀察6孔板培養基中沉淀大小及密度,然后再次將6孔板放回細胞培養箱培養.轉染12~16 h后,每孔用2 mL新鮮DMEM完全培養基換液處理.轉染48 h后,分別收集6孔板中每孔的培養基于1.5 mL EP管中,2 000 r/min離心5 min使細胞碎片沉于管底.
1.2.4病毒感染取293T細胞鋪于6孔板中,每孔1×106個細胞,共分3組,每組3個重復樣孔,并編號,第1組為對照組,第2組為貼壁包裝病毒感染組,第3組為懸浮包裝病毒感染組,用含有雙抗的完全DMEM培養基(濃度同1.2.2)2 mL進行培養.24 h后,吸去每孔的培養基,將1.2.3步驟收集的上清液依次貼孔壁緩慢加入到相應的孔中,組別應與1.2.3步驟中組別一一對應,即第1組每孔加1.5 mL對照組培養上清,第2組每孔加1.5 mL貼壁轉染組病毒上清,第3組每孔加1.5 mL懸浮轉染組病毒上清,然后將6孔板放入細胞培養箱繼續培養.
1.2.5細胞計數在質粒瞬時轉染48 h后,病毒包裝48 h后和病毒感染48 h后,分別用200 μL胰酶消化相應細胞,然后將10 μL細胞懸液與10 μL 0.4%臺盼蘭染液進行混合,取10 μL混合液滴加于血球計數板蓋玻片邊緣,使混合液緩緩滲入血球計數室內,在10倍光學顯微鏡下計數,比較第1組、第2組和第3組之間細胞增殖情況.
1.2.6流式細胞檢測在進行1.2.5步驟細胞計數的同時,收取足量細胞利用BD流式細胞儀在FITC通道中進行流式分析.
1.2.7熒光成像在細胞計數和流式分析前,將質粒瞬時轉染48 h后,病毒包裝48 h后和病毒感染48 h后的6孔板細胞置于熒光倒置顯微鏡下進行熒光成像檢測.
1.2.8統計學分析采用SPSS 20.0統計學軟件,實驗數據以均數±標準差表示,樣本以t檢驗分析其統計學意義,當P<0.05時,判定具有顯著性差異.
2結果
2.1磷酸鈣-DNA復合物沉淀顆粒觀察
293T細胞在貼壁狀態和懸浮狀態下瞬時轉染30 min后,在40倍光學顯微鏡下觀察磷酸鈣-DNA復合物顆粒的形成狀況(如圖2),發現兩種狀態下的細胞培養基中磷酸鈣-DNA復合物顆粒大小適中,分布均勻,并且顆粒在培養基中不停地顫動.當這些復合物顆粒附著于細胞表面以后,會以胞吞的形式被攝入胞內.
2.2貼壁和懸浮狀態下293T細胞的瞬時轉染效果比較
細胞轉染48 h以后,分別對兩種狀態下轉染的細胞進行流式分析(如圖3),每組進行3次獨立重復實驗.發現貼壁狀態下轉染的第2組轉染效率為91.3%±1.2%,在懸浮狀態下轉染的第3組轉染效率為89.5%±1.5%,第2組和第3組經統計學分析比較,P>0.05,沒有顯著性差異,說明在懸浮狀態下細胞轉染效率與貼壁狀態一致,兩組轉染效率均較高,達到了細胞轉染實驗所需要求.瞬時轉染48 h以后,對照組、貼壁轉染組和懸浮轉染組的細胞數分別為(1.24±0.18)×106/mL,(9.13±0.18)×105/mL和(9.25±0.35)×105/mL.每組進行3次獨立重復實驗,B組和C組經統計學分析比較,P>0.05,沒有顯著性差異.由于轉染試劑對細胞本身有毒性作用,導致實驗組細胞數目略低于對照組,但貼壁轉染組和懸浮轉染組細胞計數沒有統計學差異,說明在懸浮狀態下進行細胞轉染對細胞增殖沒有影響.將6孔板置于10倍熒光倒置顯微鏡下進行熒光成像(如圖4,彩圖見封三),可見貼壁轉染組和懸浮轉染組細胞陽性率均較高,且兩組熒光強度相近.通過流式分析發現,貼壁轉染組和懸浮轉染組熒光強度分別為(3.23±0.08)×106和(3.02±0.15)×106,懸浮狀態下進行細胞轉染的熒光強度與貼壁狀態下轉染細胞的熒光強度對比,P>0.05,沒有顯著性差異.根據以上結果得出,293T細胞在懸浮狀態下進行磷酸鈣轉染并不影響細胞的轉染效果,且轉染效率高,熒光強度好,滿足了細胞轉染實驗的要求.
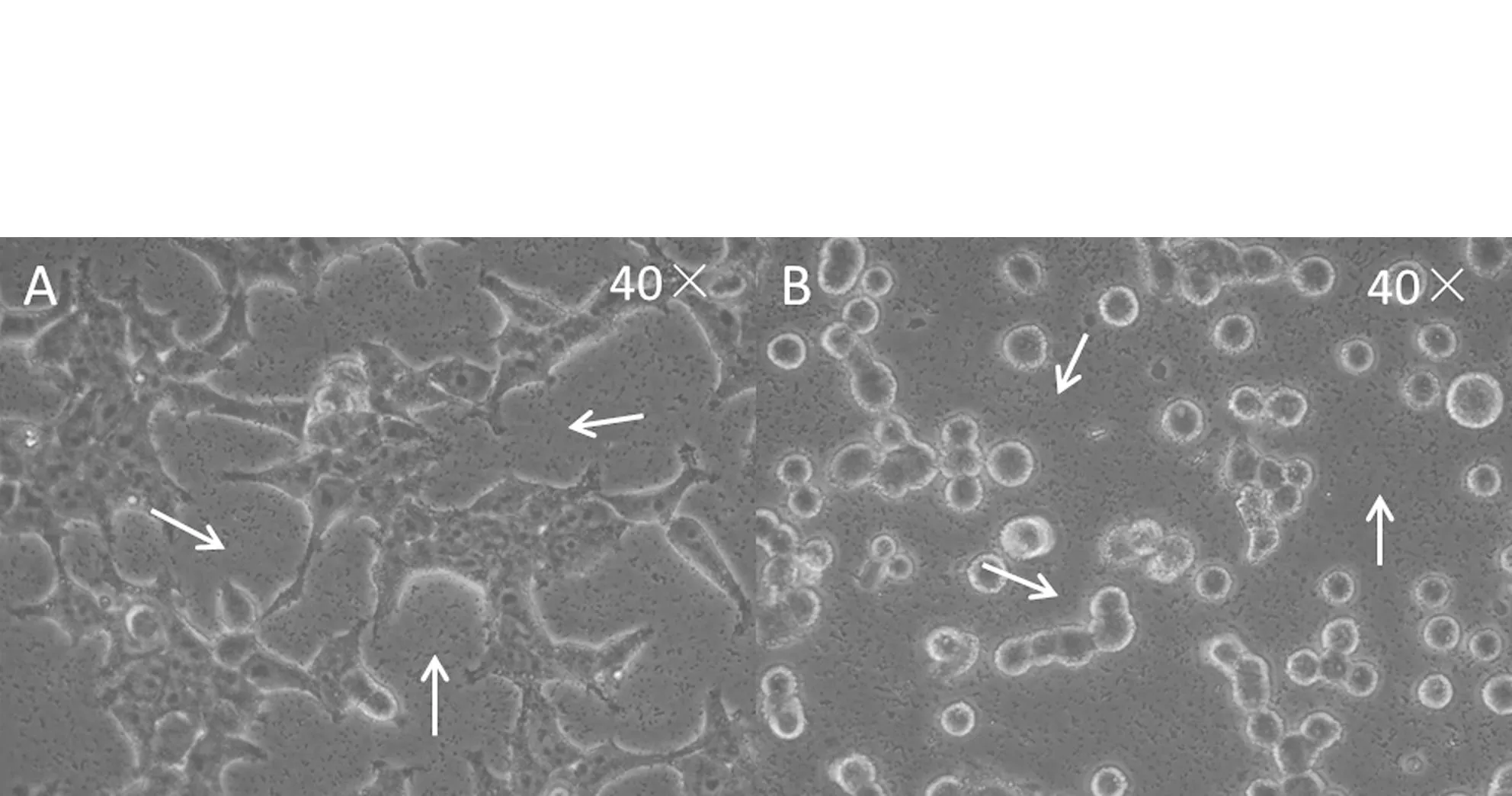
A:貼壁細胞;B:懸浮細胞A: adherent cells; B suspended cells圖2 兩種細胞狀態下磷酸鈣-DNA復合物顆粒形成狀況Fig.2 The distribution of calcium phosphate-DNA complex in two status of cells
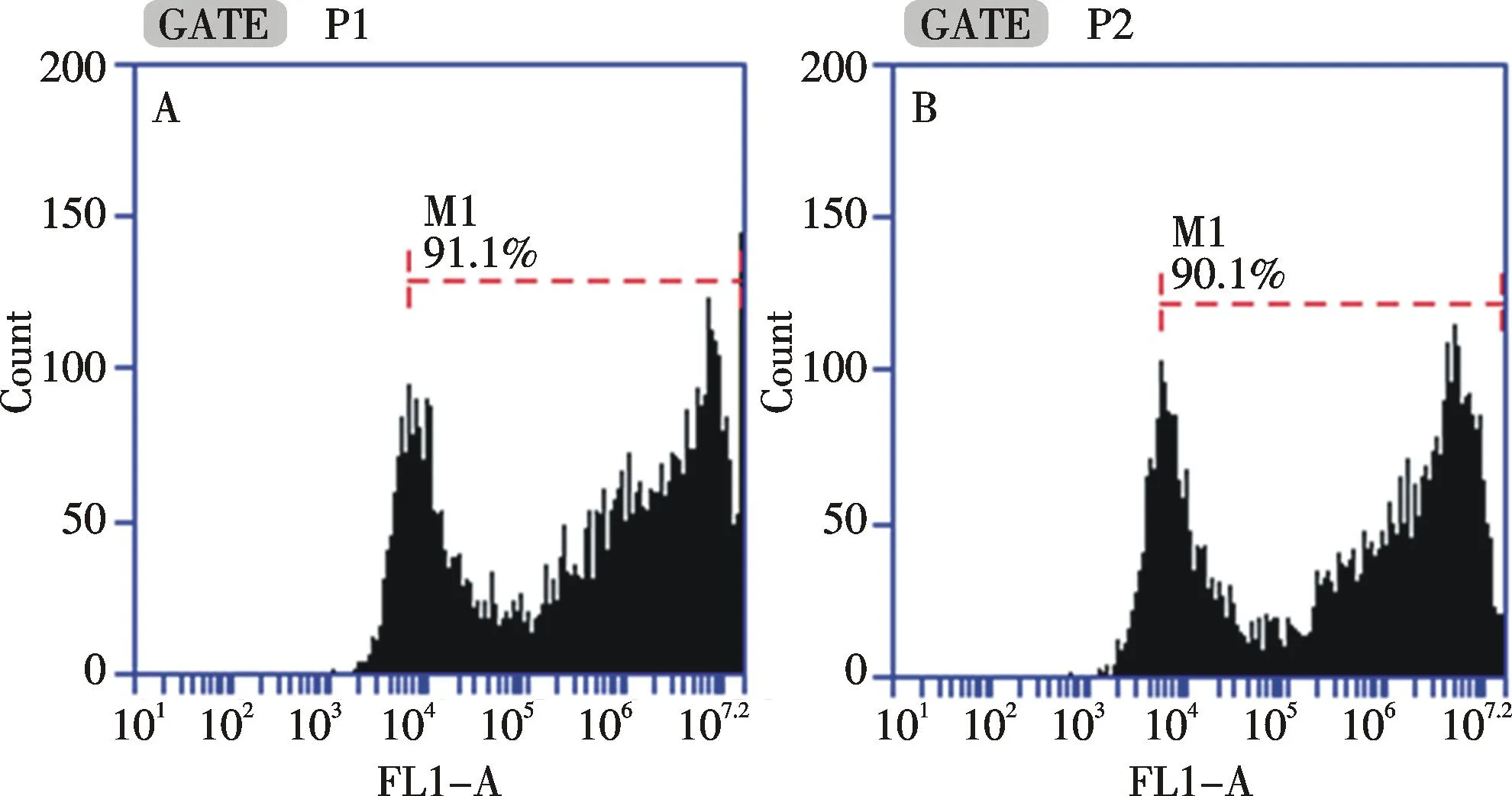
A:貼壁轉染組;B懸浮轉染組A: Cell transfection in adherent status; B: Cell transfection in suspended status圖3 兩種細胞狀態下的細胞瞬時轉染流式檢測Fig.3 Flow cytometry of cell transient transfection in two status

A:對照組明場圖;B:對照組熒光圖;C:貼壁轉染組明場圖;D:貼壁轉染組熒光圖;E:懸浮轉染組明場圖;F:懸浮轉染組熒光圖A: Bright filed image of the control group; B: Fluorescence image of the control group; C: Bright filed image of the adherent transfection group; D: Fluorescence image of the adherent transfection group; E: Bright filed image of the suspended transfection group; F: Fluorescence image of the suspended transfection group圖4 瞬時轉染48 h后的細胞熒光成像Fig.4 Fluorescence image after 48 h of transient transfection
2.3貼壁和懸浮狀態下的病毒包裝及病毒感染效果比較
以磷酸鈣為轉染試劑,在貼壁和懸浮狀態下進行三質粒系統的病毒包裝,每組進行3次獨立重復實驗.轉染48 h后,對細胞進行流式分析(如圖5)和計數.流式檢測發現,貼壁和懸浮狀態下轉染后的細胞轉染效率為94.6%±1.7%和96.5%±2.1%.通過細胞計數得到對照組、貼壁轉染組和懸浮轉染組的細胞數分別為(5.65±0.21)×106/mL,(3.55±0.07)×106/mL和(3.60±0.14)×106/mL,貼壁轉染組和懸浮轉染組細胞數經統計學分析,P>0.05,沒有顯著性差異.同時,收集病毒上清感染293T細胞,每組進行3次獨立重復實驗.感染48 h后,細胞感染效率分別為50.9%±1.3%和48.1%±1.6%(如圖6),對照組、貼壁包裝感染組和懸浮包裝感染組細胞數分別為(3.98±0.04)×106/mL,(4.00±0.07)×106/mL和(3.99±0.08)×106/mL.三組細胞數經統計學分析,P>0.05,沒有顯著性差異.每組進行3次獨立重復實驗.通過熒光成像檢測發現,貼壁包裝感染組和懸浮包裝感染組細胞陽性率均較高,熒光強度較高(如圖7,彩圖見封三).通過流式分析發現,貼壁包裝感染組和懸浮包裝感染組細胞熒光強度為(1.77±0.37)×105和(2.04±0.30)×105,兩組細胞熒光強度經統計學分析,P>0.05,沒有顯著性差異.根據以上結果,轉染48 h后,貼壁和懸浮狀態下進行病毒包裝的細胞轉染效率均達到90%以上,且沒有統計學差異;貼壁包裝和懸浮包裝得到的病毒感染效率均較高,細胞陽性率可達50%,且沒有統計學差異.因此,293T細胞在懸浮狀態下進行病毒包裝得到的病毒和貼壁狀態包裝得到的病毒感染效果一致.
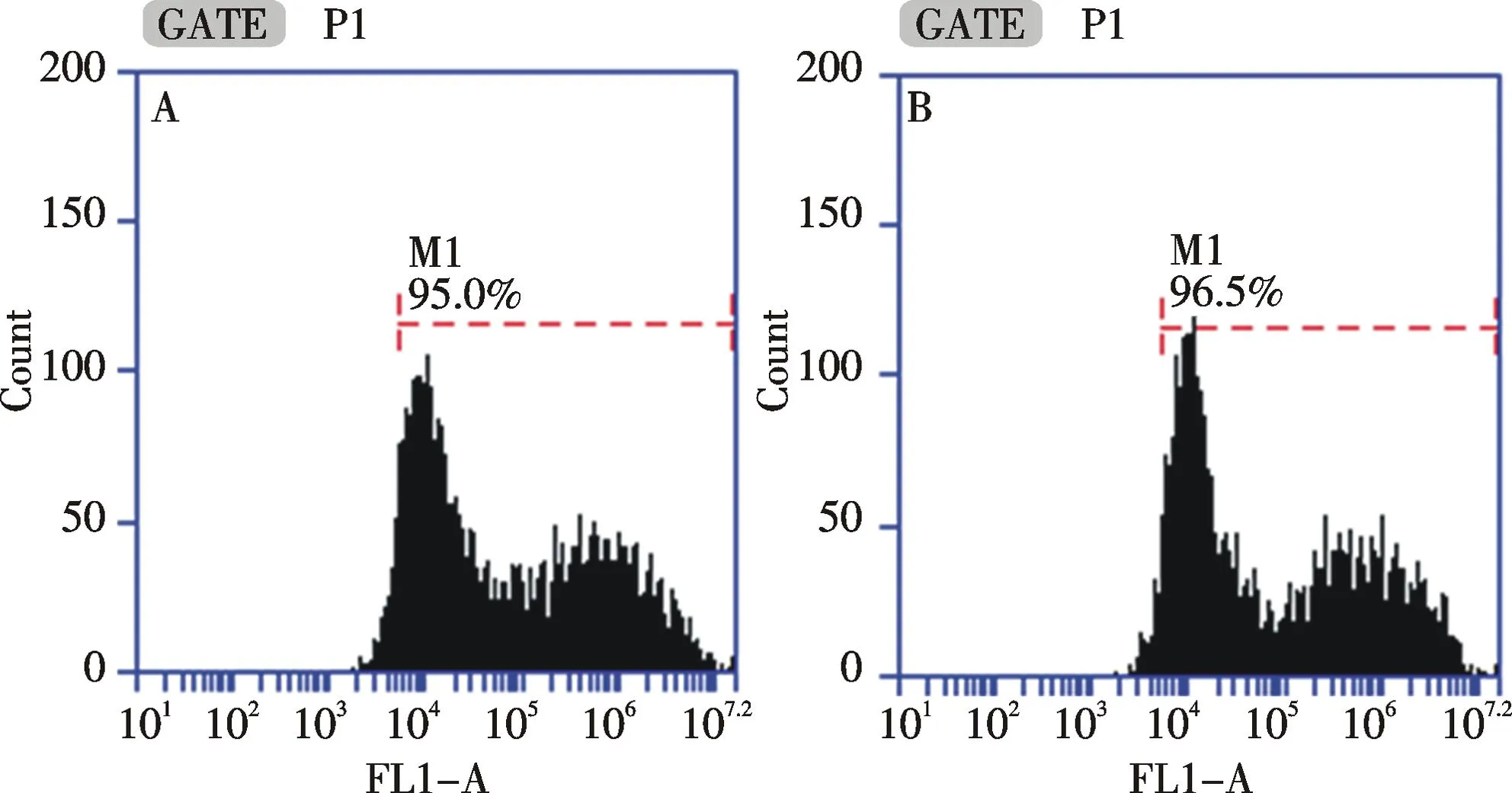
A:貼壁轉染組;B懸浮轉染組A: Cell transfection in adherent status; B: Cell transfection in suspended status圖5 兩種細胞狀態下的病毒包裝流式檢測Fig.5 Flow cytometry of virus packaging in two status
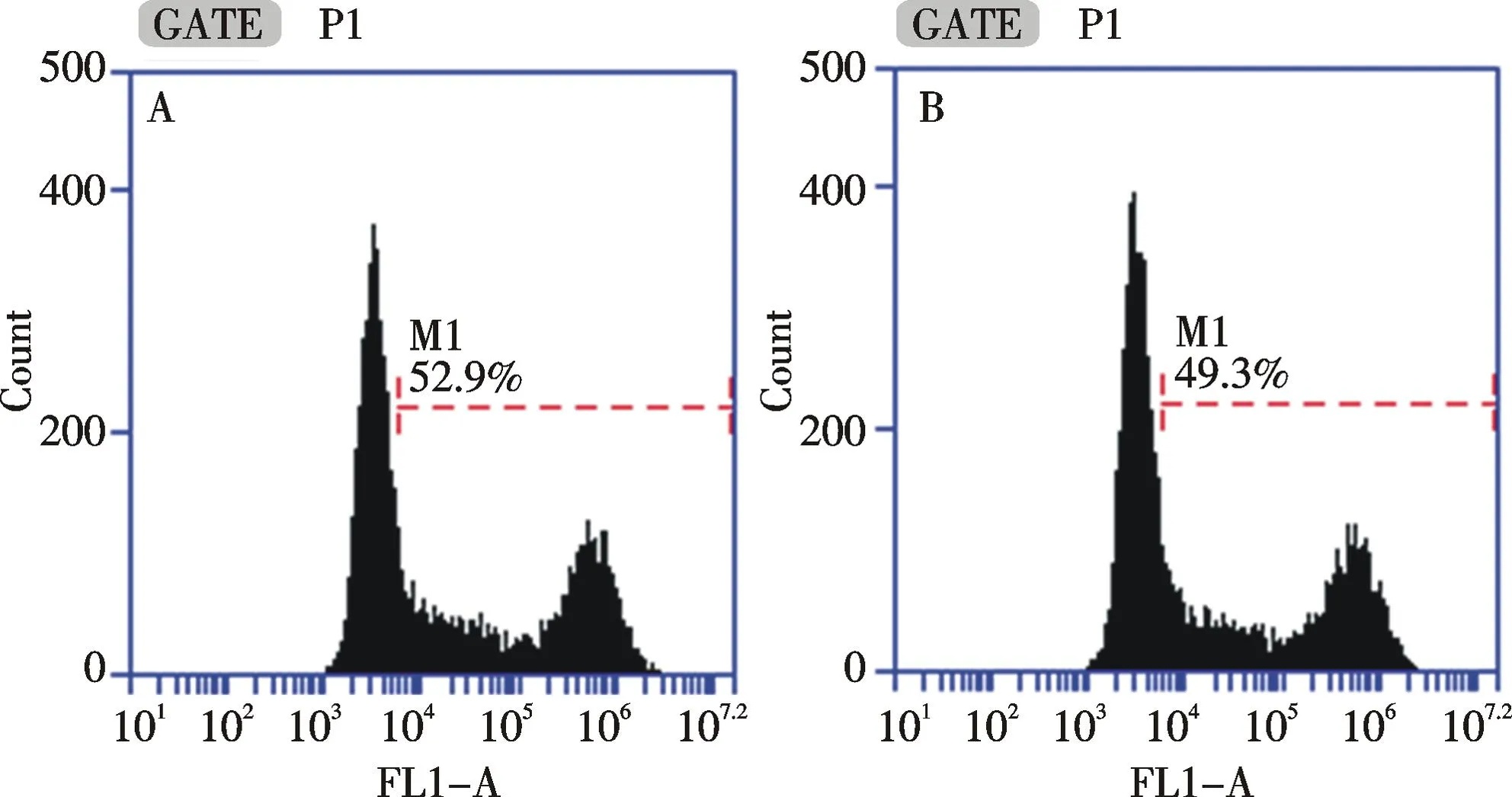
A:貼壁狀態下包裝得到的病毒液感染效率;B:懸浮狀態下包裝得到的病毒液感染效率A: Infection efficiency of viruses obtained in adherent status; B: Infection efficiency of viruses obtained in suspended status圖6 兩種細胞狀態下包裝得到的病毒液感染293T細胞48 h后的流式檢測Fig.6 Flow cytometry of 293T cells infected by viruses obtained in different status after 48 h

A:對照組熒光圖;B:貼壁包裝病毒感染熒光圖;C:懸浮包裝病毒感染熒光圖A: Fluorescence image of the control group; B: Fluorescence image of the infection of virus packaged in adherent status; C: Fluorescence image of the infection of virus packaged in suspended status圖7 病毒感染48 h后的細胞熒光成像Fig.7 Fluorescence image after 48 h of virus infection
3討論
磷酸鈣共沉淀法是Graham等[11]于1973年建立的,利用細胞的內吞作用將磷酸鈣-DNA復合物攝入細胞[12-13],雖然磷酸鈣轉染試劑對細胞也有一定毒性[14],但其毒性較弱,因此該法常作為常規方法用于多種細胞的基因轉染,且轉染效率高,可獲得短暫或長期表達.細胞的磷酸鈣轉染是一項相對復雜的過程,且中間操作環節不能有效控制,所以很容易導致細胞轉染效率時高時低.在轉染過程中,如果能有效掌握操作的關鍵點,比如溶液的pH值、顆粒的大小、質粒DNA的用量、培養基中的細胞數目等,將會極大地提高細胞的轉染效率[15].由于傳統磷酸鈣轉染貼壁細胞過程較為復雜,操作不當很容易使轉染效率降低.因此,本實驗將磷酸鈣轉染過程進行進一步優化與改進,將貼壁細胞處理成懸浮狀態,分別從細胞轉染效率、細胞增殖和熒光強度等方面評估細胞在貼壁和懸浮狀態下的轉染效果,對比發現在兩種狀態下細胞的轉染效果沒有明顯差別,且轉染效率高、熒光強度好,懸浮狀態轉染完全可以滿足實驗需要.所以,在磷酸鈣轉染293T細胞過程中,可以在細胞傳代鋪板的同時,直接在細胞懸浮狀態下進行轉染,這樣能有效縮短實驗周期,操作也更為簡便,且有利于進行大規模細胞轉染實驗.
參考文獻:
[1]RECILLAS-TARGA F. Multiple strategies for gene transfer, expression, knockdown, and chromatin influence in mammalian cell lines and transgenic animals[J]. Mol Biotechnol, 2006,34(3):337-354.
[2]POTTER H, HELLER R. Transfection by electroporation[M]. Neuroscience: Wiley Online Library, 2011.
[3]ROSEN J N, SWEENEY M F, MABLY J D. Microinjection of zebrafish embryos to analyze gene function[J]. J Vis Exp, 2009(25):1115.
[4]CHEN C, OKAYAMA H. High-efficiency transformation of mammalian cells by plasmid DNA[J]. Mol Cell Biol, 1987,7(8):2745-2752.
[5]GIGER E V, CASTAQNER B, RAIKKONEN J,etal. SiRNA transfection with calcium phosphate nanoparticles stabilized with PEGylated chelators[J]. Ad Healthc Mater, 2013,2(1):134-144.
[6]JORDAN M. Transient gene expression in mammalian cells based on the calcium phosphate transfection method[J]. Cell Eng, 2000,2:56-79.
[7]JORDAN M, WURM F. Transfection of adherent and suspended cells by calcium phosphate[J]. Methods, 2004,33(2):136-143.
[8]SONG W, LAHIRI D K. Efficient transfection of DNA by mixing cells in suspension with calcium phosphate [J]. Nucleic Acids Res, 1995,23(17):3609-3611.
[9]GIRARD P, JORDAN M, TSAO M,etal. Small-scale bioreactor system for process development and optimization[J]. Biochem Eng J, 2001,7(2):117-119.
[10]DEMAISON C, PARSLEY K, BROUNS G,etal. High-level transduction and gene expression in hematopoietic repopulating cells using a human immunodeficiency[correction of immunodeficiency] virus type1 based lentiviral vector containing an internal spleen focus forming virus promoter[J]. Hum Gene Ther, 2002,13(7):803-813.
[11]GRAHAM F L, VAN DER EB A J. Transformation of rat cells by DNA of human adenovirus 5[J].Virology, 1973,54(2):536-539.
[12]ALAM J, COOK J L. Reporter genes: application to the study of mammalian gene transcription[J]. Anal Biochem, 1990,188(2):245-254.
[13]CHEN C A, OKAYAMA H. Calcium phosphate-mediated gene transfer: a highly of ficient transfection system for stably transforming cells with plasmid DNA[J]. Biotechniques, 1988,6(7):632-38.
[14]FENG L, GUO M, ZHANG S,etal. Optimization of transfection mediated by calcium phosphate for plasmid rAAV-LacZ (recombinant adeno-associated virus-beta-galactosidase reporter gene)production in suspension-cultured HEK-293 (human embryonic kidney 293) cells[J]. Biotechnol Appl Biochem, 2007,46(Pt2):127-135.
[15]JORDAN M, KOHNE C, WURM F M. Calcium-phosphate mediated DNA transfer into HEK-293 cells in suspension: control of physicochemical parameters allows transfection in stirred media.Transfection and protein expression in mammalian cells[J]. Cytotechnology, 1998,26(1):39-47.
(編輯WJ)
中圖分類號Q813.1
文獻標識碼A
文章編號1000-2537(2016)01-0018-06
*通訊作者,E-mail:qinghua_zhang@shbiochip.com
基金項目:國家自然科學基金資助項目(81272325);上海市浦江人才計劃資助項目(12PJ1433700)
收稿日期:2015-04-28
DOI:10.7612/j.issn.1000-2537.2016.01.004

