局部晚期胃癌根治術后放射治療研究進展
張佳佳 王鑫 金晶
?
局部晚期胃癌根治術后放射治療研究進展
張佳佳王鑫金晶
摘要術后同步放化療是局部晚期胃癌根治術后重要的輔助治療手段。對于局部晚期胃癌根治術后淋巴結清掃小于D2范圍者,術后同步放化療可以提高局部和長期的療效,為指南推薦的術后輔助治療標準方案。D2術后是否需同步放化療仍存在爭議。來自亞洲的3項Ⅲ期隨機分組臨床試驗表明D2術后同步放化療安全可行并可能使部分患者獲益;術后同步放化療的作用仍需設計良好、檢驗效率充分的隨機對照臨床試驗進一步明確。下一步研究的重點將側重于篩選可從同步放化療中獲益的局部區域復發高危人群、進一步優化放療靶區范圍、探索應用新的放療技術等方面。
關鍵詞局部晚期胃癌D2清掃術放射治療研究進展
Research progress on postoperative radiation therapy in locally advanced gastric adenocarcinoma
Jiajia ZHANG, Xin WANG, Jing JIN
Correspondence to: Jing JIN; E-mail: jingjin1025@163.com
Department of Radiation Oncology, Cancer Hospital, National Cancer Center, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China
Abstract Chemoradiotherapy is an important part in the adjuvant regimen for locally advanced gastric cancer after radical resection. Adjuvant chemoradiotherapy has demonstrated a clear local control and survival advantage for locally advanced patients with less than D2 lymph node dissection. Thus, chemoradiotherapy is recommended as standard of care in the postoperative setting. However, the role of radiotherapy for patients with more extensive D2 lymph node dissections remains controversial. Three phase III randomized clinical trials in Asia show that adjuvant chemoradiotherapy after D2 dissection is safe and feasible and may benefit certain groups of patients. The benefit of radiotherapy in the case of more extensive surgery still warrants well-designed, fully powered randomized controlled clinical trials for verification. More studies are needed to focus on the identification of patient subgroups that are at high risk for locoregional failure and may benefit from adjuvant chemoradiotherapy. Further optimization of target volume in the radiotherapy and exploration of new modalities of radiation techniques are also necessary.
Keywords:locally advanced gastric adenocarcinoma, D2 lymph node dissection, radiotherapy, research progress
胃癌是最常見的消化道腫瘤之一。據2015年最新發布的世界癌癥數據,在男性常見腫瘤中,胃癌位居第4位,死亡率居于第3位;胃癌位居女性常見腫瘤中第5位,死亡率居于第5位,在亞洲國家尤其高發[1]。根治性手術切除是其唯一的治愈手段,但對于局部晚期胃癌,單純手術療效較差、復發率較高,需要多學科的綜合治療。大量研究表明,術后輔助治療可降低局部區域復發率、改善患者生存。對于可手術切除的胃癌患者,術后局部區域復發率不同文獻報道約20%~40%,在二次手術及尸檢患者中,局部復發率可高達80%~93%,占所有復發患者的80%~85%,局部區域復發為術后失敗的主要模式[2-5]。為了加強局部區域控制和改善長期生存,人們對術后放射治療的作用進行了積極探索。2001年美國INT0116研究報告公布,奠定了同步放化療(chemoradiotherapy,CRT)作為局部晚期胃癌根治術后標準輔助治療方案的循證基礎,但隨著D2清掃術相繼被亞洲、歐美國家推薦為可手術切除局部晚期胃癌的標準術式,D2清掃術后是否行同步放化療引起了廣泛爭議。本研究就局部晚期胃癌根治術后放療的證據和研究進展進行綜述,以期起到拋磚引玉的作用。
1 D1與D2清掃術
隨著對胃周解剖及淋巴引流規律的深入認識,D2清掃術在亞洲被廣泛推薦為可手術切除胃癌根治術的標準術式。但在西方國家,兩項關于淋巴結清掃范圍的大型隨機對照臨床研究(英國MRC和Dutch研究)前期結果均顯示無論圍手術期死亡率還是術后并發癥發生率,接受D2手術者均顯著高于接受D1手術者(46% vs. 28%;13% vs. 7%),而總生存無顯著差異[6]。有研究證實了D2較D1手術的局部區域復發率和胃癌相關死亡率均更低(表1),手術并發癥的增加可能與聯合臟器切除相關[6],故東西方學者首次在D2標準胃癌根治術上達成共識:對于可手術切除的局部晚期胃癌患者,D2清掃術推薦在有經驗、有資質、規模較大的醫療中心開展;如非脾臟受累,不推薦聯合脾臟切除。
2 D1清掃術后放療
過去近40年間,大量臨床試驗對胃癌輔助治療的最佳模式進行了積極的探索。早期的Ⅲ期研究結果不盡人意,一項納入14個1980年以后臨床研究的薈萃分析亦未能顯示術后輔助治療可使患者獲益。2001年美國INT(Intergroup)0116研究[7]發布了其生存結果,打破了胃癌輔助治療的低迷局面,并確立了術后同步放化療在局部晚期胃癌輔助治療中的重要地位。該研究為大型隨機對照Ⅲ期臨床試驗,結果顯示術后同步放化組的3年總生存率及無復發生存率均顯著高于單純手術組(50% vs. 41%,P=0.005;48% vs. 31%,P<0.001);局部復發率和區域復發率在同步放化療組分別為2%和22%;在單純手術組分別為8%和39%,提示同步放化療能清除局部區域復發的亞臨床病灶。該研究表明胃癌術后同步放化療可以提高局部晚期胃癌患者的長期生存率、降低復發率。自該研究結果公布后,術后同步放化療成為美國胃癌術后輔助治療的標準方案。2012年INT0116研究10年隨訪結果顯示同步放化療組延續了其生存獲益,兩組疾病無進展生存和長期生存具有顯著差異[8]。
目前已有4篇薈萃分析表明,胃癌根治術后放療可以給患者帶來生存獲益(表2),其中規模最大的為Ohri等對針對13個隨機對照臨床試驗共2 811例患者的分析報道,對可手術切除胃癌患者行輔助放療可將DFS和OS提高20%,未來研究重點需側重于進一步改進放療靶區設計及放療實施方式、篩選復發高危人群和探索最佳綜合治療方案[9]。
基于現有循證醫學證據,NCCN指南推薦對于胃癌淋巴結清掃小于D2范圍者行術后同步放化療以提高局部和長期的療效。

表1 Dutch研究15年結果更新 %Table 1 Results of a 15-year follow-up Dutch study %
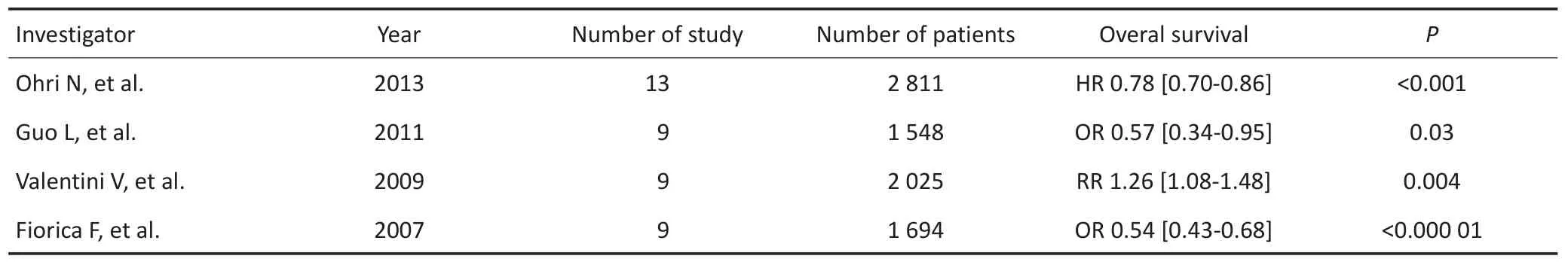
表2 胃癌根治術后放療薈萃分析Table 2 Meta-analysis of postoperative radiotherapy in gastric cancer patients
3 D2清掃術后放療
在歐美國家,暫無關于D2清掃術后放化療的大型前瞻性隨機分組研究證據。INT0116研究10年更新結果中,多變量分析表明淋巴結清掃程度(D1 vs. D2)并不是一個治療(同步放化療vs.單純手術)交互因素,提示D1、D2亞組均可從術后同步放化療中獲益[8]。2012年美國SEER數據庫11 630例大宗數據分析顯示無論清掃淋巴結總數大于15枚還是小于15枚,淋巴結陽性所有患者均獲益于術后放療;淋巴結陰性的患者未能從術后放療獲益[10]。
在亞洲,來自韓國一項大宗多中心回顧性分析納入了990例胃癌D2清掃術后患者(淋巴結陽性者占91%),術后同步放化療較單純手術顯著提高5年OS和RFS(P<0.05),且放療野內的局部區域復發率低于單純手術組(14.9% vs. 21.7,P<0.005)[11]。隨著日本ACTS-GC研究和CLASSIC研究這2項大型前瞻性Ⅲ期隨機研究結果的公布,D2術后輔助化療被證實可使Ⅱ/Ⅲ期胃癌患者生存獲益,5年OS從50%~60%提高到60%~70%[12-14],故目前研究熱點主要集中在D2術后單純輔助化療與同步放化療的比較。
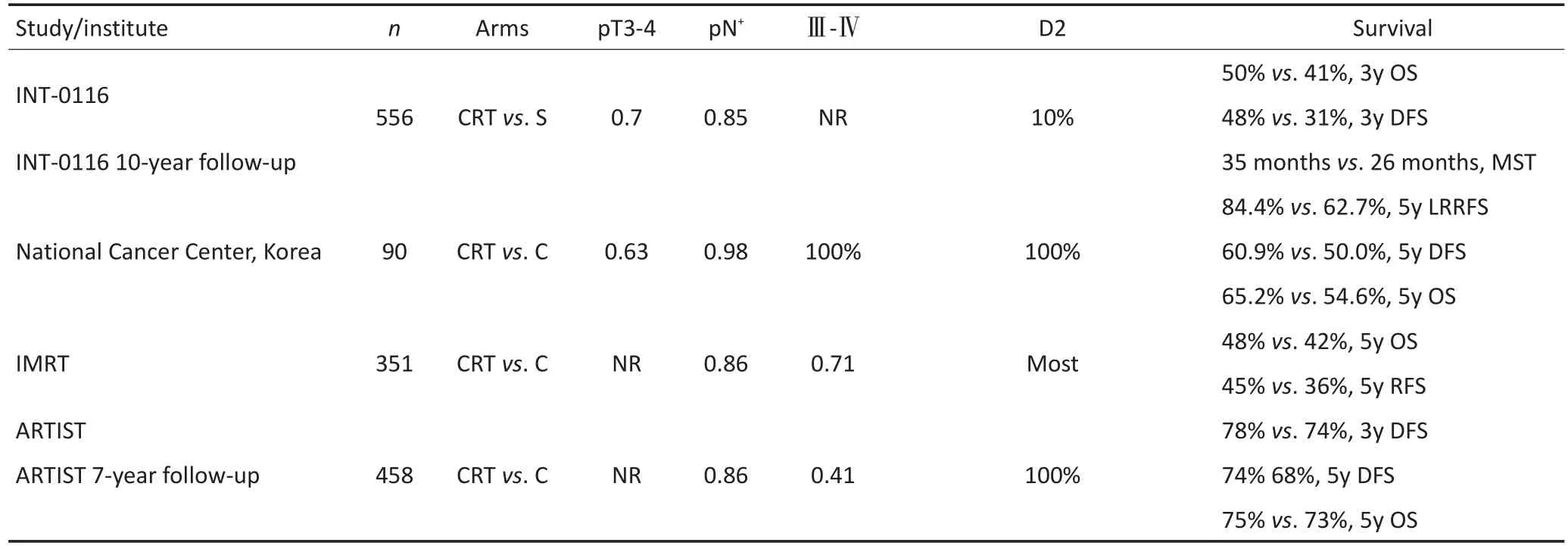
目前關于D2術后同步放化療vs單純化療的前瞻性隨機分組研究共有3項。韓國國家癌癥中心開展的前瞻性Ⅲ期研究共納入90例Ⅲ~Ⅳ期D2術后患者(因入組緩慢提前關閉),結果顯示術后同步放化療組5年無局部區域復發生存率(locoregional re?currence-free survival,LRRFS)較單純化療組明顯提高,5年無進展生存率兩組無顯著差異;其亞組分析顯示Ⅲ期患者LRRFS獲益更為明顯(93.2% vs. 66.8%,P=0.014)。中國多中心IMRT研究中,術后同步放化療以IMRT為放療技術,中位隨訪5年后術后同步放化療組無進展生存顯著優于化療組,但總生存獲益兩組相當。ARTIST研究是目前對比D2根治術后同步放化療和單純化療療效規模最大的Ⅲ期隨機對照試驗,其7年隨訪結果表明術后同步放化療和單純化療均可使患者受益,兩組5年DFS和OS在整體人群中無顯著差異(P>0.05);在亞組分析中,Lau?ren分型為腸型(P=0.01)、淋巴結陽性(P=0.04)的患者可能從術后放療中獲益。胃癌根治術后放療隨機Ⅲ期臨床研究證據見表3。
需要注意的是,盡管ARTIST研究是一個陰性結果的研究,但是該研究中約60%患者為早期病例(ⅠB或Ⅱ期),淋巴結陰性患者占15%,彌漫型胃癌比例較INT 0116研究中明顯增加(60% vs. 39%),以上因素均可能削弱了術后放療的作用[15-16]。目前正在進行的ARTISTⅡ研究(NCT0176146)和我中心即將開展的局部晚期胃癌術后放化療的研究將入組淋巴結陽性的D2清掃術后胃腺癌患者,比較術后化療與術后化療基礎上的同步放化療,以進一步明確術后放療的作用和可能受益的人群,結果令人期待。
綜上所述,當胃癌根治性手術淋巴結清掃范圍達D2范圍時,術后同步放化療與術后單純化療相比,目前暫缺乏有力的前瞻性臨床試驗結果支持其具有生存方面的優勢,但淋巴結轉移陽性及腸型胃癌患者有從術后同步放化療中獲益的趨勢。要明確胃癌D2清掃術后同步放化療的作用及可能從術后同步放化療中獲益的人群,仍需設計良好、檢驗效率充分的隨機對照臨床試驗進行研究。
4 術后放療靶區范圍
由于胃癌原發腫瘤部位、分期不同,各站淋巴結轉移幾率并不一致,同時還受到不同手術類型、周圍正常組織器官照射劑量限制及不同放療技術的影響,因此,關于胃癌術后靶區勾畫目前并無統一標準。基于胃癌根治術后局部區域復發模式、部位及復發率的分析是優化靶區范圍的重要途徑。
4.1術后局部區域復發率的變化
在小于D2清掃術時代,對于可手術切除的胃癌患者,術后局部區域復發率不同文獻報道約20%~40%,在二次手術及尸檢患者中,局部復發率可高達80%~93%,占所有復發患者的80%~85%,腹腔種植轉移占17%~50%,而遠地轉移相對少見,為17%~54%,故局部區域復發為術后失敗的主要模式[2-5]。王鑫等[5]回顧性分析了2002年至2004年在指明接受胃癌根治性手術( 隨著D2術式的普及和化療方案的進步,局部晚期胃癌根治性術后局部區域復發率進一步下降,不同文獻報道約5.6%~12.0%[17-19],因而部分學者對D2清掃術后同步放化療的必要性產生了質疑。Chang等[20]對382例胃癌D2術后病理為N3的患者進行了回顧性分析,結果顯示即使經過廣泛淋巴結清掃和強化輔助化療,仍出現較高的區域復發風險(23.8%),提示對該部分患者術后同步放化療以提高局部區域控制的可能。ARTIST研究中,淋巴結陽性患者具有從術后同步放化療中獲益的傾向,故淋巴結狀態或將成為研究D2術后放療價值的重要切入點。 4.2靶區范圍的革新 4.2.1殘胃是否照射2008年韓國一個回顧性研究結果顯示,避免對殘胃進行照射可顯著降低3~4度嘔吐和腹瀉的發生率,而對總體預后并無影響;照射與不照射殘胃的局部區域復發率也無統計學差異(10.8%和5.3%)[21]。王鑫等[5]的分析結果顯示,對于局部晚期胃癌根治術后患者,單純殘胃復發率僅占復發患者的5.5%。因此,筆者建議術后胃癌放療的靶區不包括全部殘胃,以降低放療相關急性不良反應,保證治療計劃的順利進行。 4.2.2高危區域淋巴結的選擇性照射ARTIST研究通過前期對局部區域復發模式和規律的分析,對放療的靶區進行了改進,淋巴結照射區僅包括第7~9組及12~16組淋巴結,進一步降低了腸道的照射劑量,不良反應與單純化療相比無顯著差異,治療完成率提高至82%。Chang[20]等對91例D2術后淋巴結轉移為N3患者的復發分析顯示區域淋巴結復發部位多在D2清掃范圍之外(第12p~16組淋巴結),復發高危部位依次為腹主動脈旁(第16a/b組),肝十二脂腸韌帶(第12組),腸系膜上血管周圍(第14組),胰后(第13組)和腹腔干(第9組),提示D2術后靶區范圍可考慮不包括胃周淋巴結(第1~6組)和脾門(第10~11組)。區域淋巴結的復發風險還受疾病的分期、手術水平、清掃程度等多種因素的影響,故應根據本單位的局部區域復發資料因地制宜地開展。 4.3目前靶區勾畫指南存在的問題 Smalley[22]和Tepper[23]等于2002年分別發表了胃癌術后靶區設計的建議,主要依據“原發腫瘤部位不同,淋巴結轉移規律也不同”的原理,對幾種手術方式后的靶區分別進行了定義,是最早的胃癌靶區勾畫指南。但該指南為基于二維時代圖像前后對穿野設計,不良反應多見,在INT0116研究中,3級、4級胃腸道毒性發生率分別為41%、32%,治療完成率僅64%,并且1/3患者死亡或野內復發[7]。因此,在現代照射技術、外科手術及清掃水平下優化靶區勾畫范圍,對減輕不良反應和提高局部區域控制非常重要。 基于91例D2術后淋巴結轉移為N3患者的復發分析,Yoon等[24]進一步提出了以血管結構為參照的靶區勾畫范圍建議。不過,這是基于N3、而且是標準D2術后得到的結果,對于其他分期和非標準D2手術,術后局部區域復發的分布目前尚不十分清楚。 此外,美國麻省總醫院于2013年發表了胃癌術后淋巴結區示意圖,為第一個根據胃癌不同術式(近端胃部分切除、遠端胃部分切除和全胃切除)、在不同CT層面上勾畫出淋巴結1~16組的圖示[25],但該篇文章并未給出胃癌術后應如何設計照射范圍的建議。 綜上所述,未來應在積極開展更多胃癌局部區域復發規律相關研究的基礎上,明確不同復發高危人群的復發風險和失敗部位,指導靶區范圍的優化,完善胃癌術后靶區勾畫指南。 放療實施技術是影響放療相關不良反應的另一重要因素。INT0116研究中僅64%的患者按計劃完成治療,其前后對穿野的設計主要應用于二維放療時代,術后放療急性毒性反應多見。近年來,隨著三維適型放射治療(3-dimensional conformal radiation therapy,3D-CRT)、調強放射治療(intensity-modulat?ed radiation therapy,IMRT),容積調強弧形治療技術(volumetric modulated arc therapy,VMAT),螺旋斷層放療等新技術的發展,精確治療成為可能;更優化的靶區劑量分布有利于保護正常組織器官、減輕早期和晚期不良反應。目前亞洲的3個Ⅲ期隨機對照研究顯示,在現代放療技術條件下,治療完成率得到提高,不良反應與單純化療相當(表4),術后同步放化療安全可行。在靶區范圍優化的基礎上聯合新的、先進的、精確的放療手段,進一步降低放療相關不良反應,提高局部區域控制、改善生存情況,是發展局部晚期胃癌術后放療的重要方面。 表4 胃癌根治術后放療隨機Ⅲ期治療方案及相關毒性反應Table 3 Evidence from phase III randomized trials of postoperative radiotherapy in gastric cancer patients 表3 胃癌根治術后放療隨機Ⅲ期研究證據Table 4 Intervention and toxicity in phase III randomized trials of postoperative radiotherapy in gastric cancer patients 術后同步放化療是局部晚期胃癌小于D2范圍患者的標準輔助治療方案。對于D2清掃術后患者,同步放化療可提高局部區域控制,對部分患者可能有長期生存的獲益;仍需設計良好、檢驗效率充分的隨機對照臨床試驗以進一步明確D2清掃術后同步放化療的作用。胃癌術后放療靶區范圍亟需基于目前清掃術水平和不同復發高危人群的復發規律分析進行優化和完善。不良反應方面,在現代放療技術及靶區優化基礎上,術后同步放化療安全可行。 隨著精準醫學時代的到來,新型胃癌分子分型的提出、地區差異的深入認識為今后的胃癌個體化治療開創了全新的領域。應利用新一代生物學技術、針對不同人群特點,篩選局部區域復發高危患者、基于復發規律優化靶區、不斷發展先進放療技術。放療作為局部治療手段在胃癌個體化治療時代的作用令人期待。 參考文獻 [1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2):87-108. [2] Gunderson LL. Gastric cancer-patterns of relapse after surgical resection[J]. Semin Radiat Oncol, 2002, 12(2):150-161. [3] Landry J, Tepper JE, Wood WC, et al. Patterns of failure following curative resection of gastric carcinoma[J]. Int J Radiat Oncol Biol Phys, 1990, 19(6):1357-1362. [4] Roviello F, Marrelli D, de Manzoni G, et al. Prospective study of peritoneal recurrence after curative surgery for gastric cancer[J]. Br J Surg, 2003, 90(9):1113-1119. [5] Wang X, Jin J, Li YX, et al. Recurrence pattern in locally advanced gastric cancer and its implication on postoperative radiotherapy[J]. Chinese Journal of Radiation Oncology,2011, 2011,20(2):133-141.[王鑫,金晶,李曄雄,等.局部晚期胃癌根治術復發部位分析及對術后放療意義的探討[J].中華放射腫瘤學雜志,2011,20(2): 133-141.] [6] Songun I, Putter H, Kranenbarg EM, et al. Surgical treatment of gastric cancer: 15-year follow-up results of the randomised nationwide Dutch D1 D2 trial[J]. Lancet Oncol, 2010, 11(5):439-449. [7] Macdonald JS, Smalley SR, Benedetti J, et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction[J]. N Engl J Med, 2001, 345(10):725-730. [8] Smalley SR, Benedetti JK, Haller DG, et al. Updated analysis of SWOG-directed intergroup study 0116: a phaseⅢtrial of adjuvant radiochemotherapy versus observation after curative gastric cancer resection[J]. J Clin Oncol, 2012, 30(19):2327-2333. [9] Ohri N, Garg MK, Aparo S, et al. Who benefits from adjuvant radiation therapy for gastric cancer? A meta-analysis[J]. Int J Radiat Oncol Biol Phys, 2013, 86(2):330-335. [10] Shridhar R, Dombi GW, Weber J, et al. Adjuvant radiation therapy increases overall survival in node- positive gastric cancer patients with aggressive surgical resection and lymph node dissection: a SEER database analysis[J]. Am J Clin Oncol, 2012, 35(3):216-221. [11] Kim S, Lim DH, Lee J, et al. An observational study suggesting clinical benefit for adjuvant postoperative chemoradiation in a population of over 500 cases after gastric resection with D2 nodal dissection for adenocarcinoma of the stomach[J]. Int J Radiat Oncol Biol Phys, 2005, 63(5):1279-1285. [12] Noh SH, Park SR, Yang HK, et al. Adjuvant capecitabine plus oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): 5-year followup of an open- label, randomised phase 3 trial[J]. Lancet Oncol, 2014, 15(12):1389-1396. [13] Bang YJ, Kim YW, Yang HK, et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase 3 open-label, randomised controlled trial[J]. Lancet, 2012, 379(9813): 315-321. [14] Sakuramoto S, Sasako M, Yamaguchi T, et al. Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine[J]. N Engl J Med, 2007, 357(18):1810-1820. [15] Lee J, Lim do H, Kim S, et al. PhaseⅢtrial comparing capecitabine plus cisplatin versus capecitabine plus cisplatin with concurrent capecitabine radiotherapy in completely resected gastric cancer with D2 lymph node dissection: the ARTIST trial[J]. J Clin Oncol, 2012, 30(3):268-273. [16] Park SH, Sohn TS, Lee J, et al. PhaseⅢTrial to Compare Adjuvant Chemotherapy With Capecitabine and Cisplatin Versus Concurrent Chemoradiotherapy in Gastric Cancer: Final Report of the Adjuvant Chemoradiotherapy in Stomach Tumors Trial, Including Survival and Subset Analyses[J]. J Clin Oncol, 2015, 33(28):3130-3136. [17] Kim TH, Park SR, Ryu KW, et al. Phase 3 trial of postoperative chemotherapy alone versus chemoradiation therapy in stageⅢ-Ⅳgastric cancer treated with R0 gastrectomy and D2 lymph node dis-section[J]. Int J Radiat Oncol Biol Phys, 2012, 84(5):e585-592. [18] Dikken JL, Jansen EP, Cats A, et al. Impact of the extent of surgery and postoperative chemoradiotherapy on recurrence patterns in gastric cancer[J]. J Clin Oncol, 2010, 28(14):2430-2436. [19] Zhu WG, Xua DF, Pu J, et al. A randomized, controlled, multicenter study comparing intensity- modulated radiotherapy plus concurrent chemotherapy with chemotherapy alone in gastric cancer patients with D2 resection[J]. Radiother Oncol, 2012, 104(3):361-366. [20] Chang JS, Lim JS, Noh SH, et al. Patterns of regional recurrence after curative D2 resection for stageⅢ(N3) gastric cancer: implications for postoperative radiotherapy[J]. Radiother Oncol, 2012, 104(3): 367-373. [21] Nam H, Limdo H, Kim S, et al. A new suggestion for the radiation target volume after a subtotal gastrectomy in patients with stomach cancer [J]. Int J Radiat Oncol Biol Phys, 2008, 71(2):448-455. [22] Smalley SR, Gunderson L, Tepper J, et al. Gastric surgical adjuvant radiotherapy consensus report: rationale and treatment implementation[J]. Int J Radiat Oncol Biol Phys, 2002, 52(2):283-293. [23] Tepper JE, Gunderson LL. Radiation treatment parameters in the adjuvant postoperative therapy of gastric cancer[J]. Semin Radiat Oncol, 2002, 12(2):187-195. [24] Yoon HI, Chang JS, Lim JS, et al. Defining the target volume for postoperative radiotherapy after D2 dissection in gastric cancer by CT-based vessel-guided delineation[J]. Radiother Oncol, 2013, 108(1): 72-77. [25] Wo JY, Yoon SS, Guimaraes AR, et al. Gastric lymph node contouring atlas: A tool to aid in clinical target volume definition in 3-dimensional treatment planning for gastric cancer[J]. Pract Radiat Oncol, 2013, 3(1):e11-19. (2015-09-06收稿) (2015-12-21修回) (編輯:周曉穎) 張佳佳專業方向為胃腸道腫瘤的放射治療。E-mail:zhangjiajia2020@163.com ·讀者·作者·編者· 作者簡介 通信作者:金晶jingjin1025@163.com doi:10.3969/j.issn.1000-8179.2016.01.985 作者單位:北京協和醫院,中國醫學科學院,腫瘤醫院放射治療科,國家癌癥中心(北京市100021)5 現代放療技術進展

6 總結與展望


