吐溫-20和吐溫-80對稻瘟病菌孢子萌發的影響
冉 莉,朱紫薇,楊 超,許有嬪,李沛華,賀 閩,王 靜,陳學偉,李偉滔
(四川農業大學水稻研究所,四川 成都 611130)
吐溫-20和吐溫-80對稻瘟病菌孢子萌發的影響
冉 莉,朱紫薇*,楊 超,許有嬪,李沛華,賀 閩,王 靜,陳學偉,李偉滔**
(四川農業大學水稻研究所,四川 成都 611130)
為了研究吐溫-20和吐溫-80對稻瘟病菌孢子萌發的影響,從而明確稻瘟病菌噴霧接菌時孢懸液的配置方法和保存時長。本試驗通過配置不同濃度的吐溫-20和吐溫-80的孢懸液,將其放置不同的時間,然后通過顯微鏡觀察吐溫-20和吐溫-80對體型不同的稻瘟病菌孢子萌發的影響。結果發現稻瘟病菌孢子在水、吐溫-20和吐溫-80的溶液中均可萌發,且在吐溫-20和吐溫-80的溶液可以生成兩條或多條芽管。吐溫-20和吐溫-80均能抑制稻瘟病菌孢子的萌發,但與吐溫-80相比,吐溫-20對孢子萌發的抑制作用較小。與孢子體型較大的稻瘟病菌Zhong10-8-14相比,體型較小的Guy11的孢子對吐溫-20和吐溫-80的抑制作用更敏感。由此表明,吐溫-20更適合用來制作稻瘟病菌的孢懸液。新鮮配置的孢懸液,只要吐溫-20的濃度不高于0.50 %,且放置時間不超過2 h,孢子的萌發率不會顯著降低,依然可以用來進行噴霧接菌試驗。
稻瘟病菌;萌發;吐溫-20;吐溫-80
稻瘟病是由子囊菌(Magnaportheoryzae)引發的水稻重大病害之一[1]。它能夠侵染從幼苗期到成熟期各個時期的水稻植株,從而引發苗瘟、葉瘟、莖瘟和穗瘟等,嚴重影響水稻產量和品質[2-3]。而水稻是世界重要的糧食作物,因此,為了保障糧食安全,水稻稻瘟病的研究一直以來被病理學家和育種家所重視。
水稻稻瘟病菌致病性的癥狀鑒定與分析是研究稻瘟病的基礎[4],而稻瘟病菌孢子的萌發是稻瘟病菌致病的前提。在實驗條件下,噴灑在水稻葉片上的孢子均勻度和孢子萌發率嚴重影響了分子生物學實驗的精確度[5-6]。因此,為了使孢子均勻分布在孢懸液中,并在噴灑稻瘟病菌孢子后能夠使其很好的粘附于葉片上。例如在制作白僵菌(Beauveriabassiana)和綠僵菌(Metarhiziumanisopliae)孢子的孢懸液時通常添加吐溫-80,當吐溫-80的濃度高于0.10 %時,白僵菌孢子的萌發率顯著降低[9]。而當高于0.20 %時,綠僵菌孢子的萌發率才顯著降低[7]。在稻瘟病菌的接菌試驗中,通常加入吐溫-20和吐溫-80等表面活性劑[4,7-10]。但是,目前尚未有報道吐溫-20和吐溫-80等表面活性劑是否影響稻瘟病菌孢子的萌發率。此外,在制作稻瘟病菌孢懸液后,通常情況下會及時噴灑在水稻葉片上,以防止稻瘟病菌孢懸液放久后影響接菌效果。但是,配置的新鮮的孢懸液具體能夠存放多久,也未有相關的報道。
本研究中使用吐溫-20和吐溫-80兩種試劑,研究它們對稻瘟病菌孢子萌發的影響。由于明膠的熔點較低,因此,本研究并未使用明膠進行相關研究。通過本研究,意在通過試驗明確吐溫-20和吐溫-80是否影響稻瘟病菌孢子的萌發,并比對兩者中哪種試劑更適宜配置孢懸液。同時,明確新鮮孢懸液的保存時間,為稻瘟病菌的噴菌試驗提供可靠的技術指導。
1 材料與方法
1.1 稻瘟病菌生理小種
10個稻瘟病菌生理小種:B15、B13、Guy11、A25、HN02、HN01、FJ10、ZB25、HN41和Zhong10-8-14,均由四川農業大學水稻研究所保存。
1.2 孢懸液的制備與顯微觀察
稻瘟病菌生理小種使用濾紙片保存法保存在-20 ℃冰箱中,使用前剪取一小片濾紙,放置在配置好的完全培養基上(Complete Medium,CM),然后放置在培養箱中,溫度調至26 ℃,光12 h/暗12 h。待生長12~14 d后,用滅菌水將孢子從培養皿上洗下來,過濾后放于光學顯微鏡下鏡檢,用血球計數板計數,將孢子濃度調至1×105/mL。之后根據試驗要求,分別制備終濃度為0.00 %、0.05 %、0.10 %、0.20 %和0.50 %的吐溫-20和吐溫-80的孢懸液。將這些不同濃度的孢懸液放置在26 ℃培養箱中。放置的時間分別為0 min、10 min、30 min、1 h、2 h和5 h。之后,用移液槍吸取5 μl不同濃度和放置不同時間的孢懸液,滴在基本培養基上(Minimal Medium,MM)。將其放置4 h后,利用Zeiss光學顯微鏡觀察孢子的萌發情況。試驗重復4次。
1.3 培養基的配方
CM:D-Glucose(10 g/L)、Peptone(2 g/L)、Yeast Extract(1 g/L)、Casamino Acids(1 g/L)、NaNO3(6 g/L)、KCl(0.5 g/L)、MgSO4(0.5 g/L)、KH2PO4(1.5 g/L)、Vitamin(0.1 %)、Agar(15 g/L)和微量元素(0.1 %)。將pH值調至 6.5。
MM:Dextrose(10 g/L)、NaNO3(6 g/L)、KCl(0.5 g/L)、MgSO4(0.5 g/L)、KH2PO4(1.5 g/L)、Biotin(0.00025 %)、Thiamine(0.1 %)、Agar(15 g/L)和微量元素(0.1 %)。將pH值調至 6.5。
1.4 數據分析
利用Excel 2010和SPSS 13.0分析孢子的萌發率。萌發率( %)=視野下萌發的孢子數量/視野下總的孢子數量×100 %,試驗重復4次。
2 結果與分析
2.1 稻瘟病菌孢子在水、吐溫-20和吐溫-80溶液中的萌發
Guy11通常作為研究稻瘟病菌致病性的一個生理小種[5,11-12]。因此,用Guy11作為研究對象,研究稻瘟病菌孢子是否能夠在水、吐溫-20和吐溫-80溶液中萌發。將Guy11的孢子配置的孢懸液放置30 h后,置于顯微鏡下觀察,發現孢子在水、吐溫-20和吐溫-80的孢懸液(0.2 %)中均能夠萌發,但是并沒有形成附著胞(圖1A)。這說明稻瘟病菌孢子附著胞的形成是需要一定的接觸載體。此外,我們發現,稻瘟病菌孢子在水中萌發后產生一條芽管,而在吐溫-20孢懸液中能夠產生兩條芽管,在吐溫-80孢懸液中甚至能夠產生多余兩條的芽管(圖1A)。由此表明,吐溫-20和吐溫-80能夠刺激稻瘟病菌孢子產生更多的芽管。
2.2 篩選大小不同的稻瘟病菌孢子
不同稻瘟病菌生理小種的孢子的大小也不盡相同,吐溫試劑對它們孢子萌發的影響也可能不同。隨機選用了10個稻瘟病菌生理小種,它們孢子的長度從26.3~46.3 μm不等(圖1B和 1C)。這些大小不同的孢子對吐溫-20和吐溫-80的反應是否也不同呢?鑒于此,筆者篩選孢子長度較長的Zhong10-8-14和孢子長度較短的Guy11用作后續試驗的生理小種。
2.3 吐溫-20和吐溫-80對孢子萌發率的影響
孢子生長出芽管為萌發(圖1D)。以孢子較小的Guy11為研究對象,在配置的不同濃度的吐溫-20孢懸液中,不同濃度的孢懸液放置時間為0 min、10 min、30 min、1 h和2 h時,Guy11孢子萌發率均約為95 %。放置時間為5 h時,萌發率下降約至80 %(圖1E)。在配置的不同濃度的吐溫-80孢懸液中,當吐溫-80的濃度低于0.20 %時,放置時間為0 min、10 min、30 min和1 h時,Guy11的萌發率均約為 90 % ,當吐溫-80的濃度為0.20 %和0.50 %時,放置時間為2和5 h時,萌發率下降至約70%(圖1F)。結果表明,吐溫-20和吐溫-80均能夠抑制Guy11的孢子萌發,吐溫-80強于吐溫-20的抑制作用。
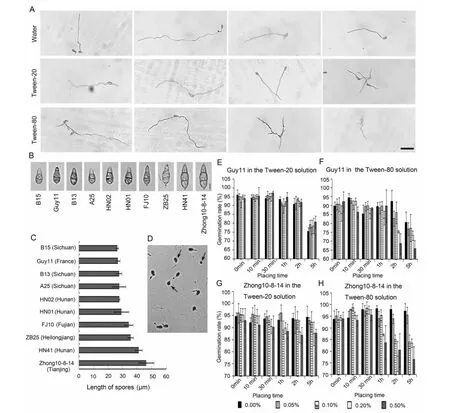
A:Guy11孢子在水和表面活性劑中30 h時的萌發,標尺是50 μm。B:稻瘟病菌孢子的顯微照片,標尺是 10 μm 。C:稻瘟病菌孢子長度的柱形圖,n=6。D:Guy11孢子萌發的顯微照片。箭頭顯示未萌發的孢子。E:Guy11的孢子在吐溫-20孢懸液中的萌發率。F:Guy11的孢子在吐溫-80孢懸液中的萌發率。G:Zhong10-8-14的孢子在吐溫-20孢懸液中的萌發率。H:Zhong10-8-14的孢子在吐溫-80孢懸液中的萌發率,n=4A, the germination of Guy11 in water and surfactants when the placing time is 30h. Bar is 50 μm. B, the micrographs of M. oryzae spore. Bar is 10 μm. C, the chart of the lengths of M. oryzae spores. n=6. D, the germination of Guy11 spores observed using microcopy. Arrows show that the spores do not germinate. The germination rates of Guy11 in the Tween-20 (E) and Tween-80 (F) at the different concentrations and placing times, n=4. The germination rates of Zhong10-8-14 in the Tween-20 (G) and Tween-80 (H) at the different concentrations and placing times, n=4圖1 吐溫-20和吐溫-80對稻瘟病菌孢子萌發和萌發率的影響Fig.1 Germination and germination rate of M. oryzae spores in the Tween-20 and Tween-80 solutions
以孢子較大的Zhong10-8-14為研究對象,配置的吐溫-20的孢懸液無論放置哪個時間段,在0.00 %、0.05 %和0.10 %的濃度下,孢子萌發率均約為 95 %,當濃度提升到0.20 %和0.50 %時,孢子的萌發率降低至約90 %(圖1G)。當配置成不同濃度吐溫-80的孢懸液后,放置時間在1 h內,濃度為0.00 %、0.05 %和0.10 %時,孢子萌發率均約為95 %,而當放置時間為2和5 h時,濃度為0.20 %和0.50 %的萌發率降至約80 %(圖1H)。結果表明吐溫-20和吐溫-80均能夠抑制Zhong10-8-14孢子的萌發,而吐溫-80強于吐溫-20的抑制作用。
通過比較吐溫-20和吐溫-80對稻瘟病菌孢子萌發率的影響,發現體型較小的Guy11對吐溫-20和吐溫-80更敏感。與吐溫-80相比,吐溫-20更適合制作孢懸液。新鮮配置的吐溫-20的孢懸液,當吐溫-20的濃度小于0.50 %時,較大或較小的稻瘟病菌孢子均能夠在26 ℃存放2 h而萌發率不會顯著降低。
3 討論與結論
本研究較為系統的研究了表面活性劑吐溫-20和吐溫-80對稻瘟病菌孢子萌發的影響。稻瘟病菌孢子能夠在水或者吐溫溶液中萌發,這與 黑曲霉(Aspergillusniger)不能在水中萌發[13-14]完全不同。盡管稻瘟病菌與黑曲霉均為病原真菌,且都屬于半知菌亞門,但是其孢子的萌發機制存在一定的差異。這可能與其各自的不同侵染機制有關。此外,試驗還發現吐溫-20和吐溫-80能夠刺激稻瘟病菌孢子產生多條芽管,這增加了稻瘟病菌孢子選擇更多的侵染位點,對稻瘟病菌孢子成功入侵宿主提供了更好的保障,因此,在制作稻瘟病菌孢懸液的過程中,加入吐溫試劑,不僅有利于孢子均勻分布和更好的附著在葉片表面,而且還有可能增加稻瘟病菌孢子的成功侵染水稻的機率。
前期研究發現稻瘟病菌孢子能夠在玻璃紙上萌發且形成附著胞[12]。本研究發現稻瘟病菌孢子在沒有固體介質時,并沒有發現附著胞的形成。由兩方面結果推斷,稻瘟病菌附著胞的形成需要固體介質。
伯格曼法則中哺乳動物和鳥類的體型大小明顯受到環境的影響[15-16]。本試驗中,體型較小的孢子對吐溫-20和吐溫-80抑制孢子萌發的作用更敏感,這與動物中的伯格曼法則相似。由此表明稻瘟病菌和其它真菌也可能存在伯格曼法則。
稻瘟病菌孢子能夠在水、吐溫-20和吐溫-80的溶液中萌發,但不形成附著胞。吐溫-20和吐溫-80能夠誘導稻瘟病菌孢子產生更多的芽管。體型較小的孢子對吐溫-20和吐溫-80抑制孢子萌發的作用更敏感。與吐溫-80相比,吐溫-20更適合用來制作稻瘟病菌的孢懸液。新鮮制作的孢懸液,當吐溫-20的濃度不超過0.50 %時,能夠存放2 h,而孢子萌發率不會顯著下降。這為稻瘟病菌的噴菌試驗提供了明確的指導。
[1]Dean R, Vankan J L, Pretorius ZA, et al. The top 10 fungal pathogens in molecular plant pathology[J]. Molecular Plant Pathology, 2012, 13:414-430.
[2]Li W T, He M, Wang J, et al. Zinc finger protein (ZFP) in plants-a review[J]. Plant Omics Journal, 2013(6):474-480.
[3]Fernandez J, Wilson R A. Cells in cells:morphogenetic and metabolic strategies conditioning rice infection by the blast fungusMagnaportheoryzae[J]. Protoplasma, 2014, 251:37-47.
[4]Jia Y, Valent B, Lee F N. Determination of host responses toMagnaporthegriseaon detached rice leaves using a spot inoculation method[J]. Plant Disease, 2003, 87:129-133.
[5]Dagdas Y F, Yoshino K, Dagdas G, et al. Septin-mediated plant cell invasion by the rice blast fungus,Magnaportheoryzae[J]. Science, 2012, 336:1590-1595.
[6]Schena M, Shalon D, Davis R W, et al. Quantitative monitoring of gene expression patterns with a complementary DNA microarray[J]. Science, 1995, 270:467-470.
[7]史 嬋, 陳薇蘭, 王 靜, 等. 三份重要水稻資源的稻瘟病抗性鑒定及不同評價指標間的相關性分析[J]. 植物保護學報, 2014, 41(4):390-395.
[8]李增智, 宣 言, 劉玉珍. 幾種表明活性劑及營養物對蟲生真菌孢子萌發的影響[J]. 安徽農業大學學報, 1996, 23(3):355-359.
[9]Li W T, Chen W L, Yang C, et al. Identification and network construction of zinc finger protein (ZFP) genes involved in the rice-Magnaportheoryzaeinteraction[J]. Plant Omics Journal, 2014(7):540-548.
[10]任巧云, 殷 宏, 關貴全, 等. 不同濃度吐溫-80與白僵菌分生孢子的相容性測定[J]. 安徽農業科學, 2009, 37(18):8555-8687.
[11]Kankanala P, Czymmek K, Valent B. Roles for rice membrane dynamics and plasmodesmata during biotrophic invasion by the blast fungus[J]. The Plant Cell, 2007, 19:706-724.
[12]Mentlak T A, Kombrink A, Shinya T, et al. Effector-mediated suppression of chitin-triggered immunity byMagnaportheoryzaeis necessary for rice blast disease[J]. The Plant Cell, 2012, 24:322-335.
[13]Ynagita T. Biochemical aspects of the germination of conidia spores ofAspergillusniger[J]. Archives of Microbiology, 1957, 26:329-344.
[14]Trinci A P J. Exponential growth of the germ tubes of fungal spores[J]. Journal of General Microbiology, 1971, 67:345-348.
[15]Meiri S, Dayan T. On the validity of Bergmann's rule[J]. Journal of Biogeography, 2003(30):331-351.
[16]Millien V, Kathleen Lyons S, Olson L, et al. Ecotypic variation in the context of global climate change:revisiting the rules[J]. Ecology Letters, 2006, 9:853-869.
(責任編輯 李 潔)
Effects of Tween-20 and Tween-80 on Germination ofMagnaportheoryzaeSpores
RAN Li, ZHU Zi-wei*, YANG Chao, XU You-pin, LI Pei-hua, HE Min, WANG Jing, CHEN Xue-wei, LI Wei-tao**
(Rice Research Institute, Sichuan Agricultural University, Sichuan Chengdu 611130, China)
To determine whether Tween-20 and Tween-80 affect the spore germination ofMagnaportheoryzae(M.oryzae) or not, which can guide how to make up of spore suspension and how long we may store the spore suspension, we configured different concentrations of solution using Tween-20 or Tween-80 and placed them in different times. Then detect the influence of Tween-20 and Tween-80 on spores ofM.oryzaeusing microscope. Spores ofM.oryzaecan germinate in water, Tween-20 and Tween-80 solution, and one spore may produce two or more germ tubes in the surfactant solutions, Tween-20 and Tween-80. The germination ofM.oryzaespores was more sensitive in Tween-80 than in Tween-20. The race Zhong10-8-14 with bigger size was more sensitive than the race Guy11 with smaller size for Tween-20 and Tween-80. Therefore, Tween-20 is more suitable for using as the surfactant of spore suspension. It was no problem to spray spore suspension ofM.oryzaewith no more than 0.50 % Tween-20 in 2 h because the germination rate ofM.oryzaespores did not obviously decrease.
Magnaportheoryzae; Germination; Tween-20; Tween-80
1001-4829(2016)10-2379-04
10.16213/j.cnki.scjas.2016.10.023
2015-10-27
國家自然科學基金項目(31501627, 31301626);四川省教育廳重點項目(15ZA0020);四川省教育廳國際合作計劃(2014HH0066)
冉 莉(1992-),女,重慶巫溪人,碩士,主要從事水稻真菌病害的研究,E-mail:ranli8023@163.com,*為共同第一作者,**為通訊作者,E-mail:weitao-li@live.cn。
S435.11
A

