生物發光共振能量轉移技術在蛋白酶活性檢測中的應用
陳成娟,王偉
?
生物發光共振能量轉移技術在蛋白酶活性檢測中的應用
陳成娟,王偉
作者單位:100050 北京,中國醫學科學院北京協和醫學院藥物研究所天然藥物活性物質與功能國家重點實驗實驗室/國家衛生和計劃生育委員會天然藥物生物合成重點實驗室
生物發光共振能量轉移(BRET)是 20 世紀中葉在海洋生物,例如維多利亞水母和軟體珊瑚蟲海腎中發現的一種自然現象[1],能量從生物發光蛋白如熒光素酶(供體)轉移到熒光物質(受體)。在軟體珊瑚蟲海腎中海腎熒光素酶將腔腸素氧化,發出波長為 480 nm 的光,與近距離的海腎綠色熒光蛋白之間發生一個非輻射的能量轉移,發出 509 nm的光[1-3]。實際上,共振能量轉移理論早在 1948 年就已經被 F?rster 提出并被稱為共振能量轉移(F?rster resonance energy transfer,FRET)[4]。根據供體不同,共振能量轉移分為以熒光物質如熒光蛋白[5]、有機分子[6-7]、納米無機熒光材料等為供體的 FRET 以及熒光素酶或者發光蛋白為供體的 BRET[8]。共振能量轉移發生時,供體發出的部分光轉移到受體熒光蛋白,受體發出波長更長的光。共振能量轉移只有在受體分子的吸收光譜與供體分子的發射光譜有效重疊后才能發生。其發生取決于供體分子與受體分子的距離(一般在 1 ~ 10 nm)和兩者的相對方向[9-10]。BRET 首次報道是用于檢測細菌節律鐘蛋白 KaiB 相互作用[8],隨后被廣泛用于研究蛋白-蛋白相互作用(多數是蛋白偶聯受體的二聚化和寡聚化的相關研究)[11-13]以及活體成像[14-16]等,同時 BRET 在蛋白酶檢測及藥物篩選中也發揮了巨大的作用[17]。
1 BRET 體系的特點
BRET 不需外源光激發,其背景極低,靈敏度高。與FRET 相比,BRET 能量供體為催化腔腸素發射熒光的熒光素酶,不需要外源光源激發熒光供體,更利于能量的定量轉移,并且避免了 FRET 中強光源激發引起的很多副反應[18],如光漂白[9],直接激發受體,激發環境中的發光物質,損傷組織,光源光強被組織吸收而弱化等;同時 BRET 的另一個優勢是可以分別對能量供體和受體進行定量[19]。BRET分析技術應用于生物體內生理活動的分析時不會對細胞組織造成有害影響,且可以實時監測,信號產生迅速,適合于高通量的篩選實驗[20]。因此,在一些需要低背景和高靈敏的實驗中,BRET 顯示出巨大優勢,在相關研究中發揮了重要的作用,解決了一些重要的分析問題,展現出良好的發展前景[21]。
2 BRET 體系中的能量供受體對及 BRET 衍生的技術
BRET 體系的供體是熒光素酶或發光蛋白,受體有熒光蛋白[22]、無機納米材料及有機染料[23]。近年來,隨著新型熒光素酶和熒光物質的發現和研究,越來越多的熒光素酶和熒光材料被用于 BRET 體系。
海腎熒光素酶(renilla luciferase,Rluc)是經典的 BRET供體,以腔腸素(coelenterazine,CLZ)為底物,發射峰在480 nm 處的藍色-綠色可見光范圍。Rluc 是分子量為 36 kD的單體蛋白,其 N-端、C-端均暴露在外,易于標記。近年來,腔腸素的多種衍生物被開發出來。其中腔腸素 400a,又稱深藍 C,經 Rluc 催化發射出主峰在 395 nm 的光。不同的 CLZ 衍生物底物最大發射波長不同,在高通量篩選實驗中有著不同的特點。這使得 Rluc 在 BRET 技術中得到非常靈活的應用,能適應不同吸收波長的受體。
最早發展的 BRET 是以 Rluc 為供體,CLZ 為底物,增強型黃色熒光蛋白(enhanced yellow fluorescent protein,EYFP)為受體,可觀察到兩個最大發射峰,分別在 480 nm 和 527 nm,這種 BRET 體系被稱為BRET1[22]。近年來開發的一些 YFP 突變體,如 YFP venus 也被應用到 BRET體系,取得了較好的結果[24]。
BRET2相比 BRET1最大的優勢就是它的峰分辨率更高,更加靈敏。由于 Rluc 的發射峰與 YFP 的發射峰較為接近,重疊較嚴重,從而影響了實驗的靈敏度,為此開發的BRET2體系彌補了這個缺點[25]。野生型 GFP 的突變體EGFP(F64L)最大吸收峰在 400 nm 左右,發射峰在 510 nm處。因此,Rluc 與 EGFP 構成的 BRET2體系,以 CLZ 400a 為底物時,發射出 395 nm和 510 nm 的特征峰,光譜分辨率大大提高,信噪比相應地得到提高。然而,CLZ400a發光很弱,比 CLZ 低 100 多倍。因此盡管 BRET2更加靈敏,但信號強度很弱,在很多實際應用中受到限制。美國斯坦福大學的 Gambhir 研究組將 CLZ400a 的類似物引入到 BRET2體系中使 BRET2載體被檢測的時間延長到6 h[26],且將 BRET2中的 Rluc 供體替換成其突變體 RLuc8 (RlucA55T/C124A/S130A/K136R/A143M/M185V/M253L/S 287L),使 BRET2體系檢測靈敏度得到顯著改善[27]。RLuc8發光強度是 Rluc 的 4 倍,能使 BRET 體系的信號增強大約 5 倍[28],使用 RLuc8 作為 BRET 供體,EYFP 作為受體的 BRET1體系光輸出增強 25 倍[29]。
盡管現有的 BRET1和 BRET2系統進行了如上所述的改進,但由于活體組織對在 600 nm 以下的發射光有強吸收,當應用于活體組織時仍然存在很強的光子衰減現象,這就導致該系統缺乏靈敏度和光譜分辨率低[30]。為滿足小動物活體成像的需求,BRET 的發展趨勢是選擇合適的供受體,使 BRET 體系發射 600 nm 以上的紅光或遠紅光。Gambhir 團隊在此基礎上開發了一系列新的 BRET 系統,即紅移的生物發光共振能量轉移系統,已成功應用于活體動物蛋白質-蛋白質相互作用的成像[31]。根據供體與受體以及所選用底物的差異分為 BRET3、BRET3.1、BRET4.1、BRET5、BRET6、BRET6.1等 6 類,供體是 Rluc 的突變體(RLuc8 或 RLuc8.6),受體是紅色熒光蛋白的突變體(mOrange、TagRFP、TurboFP635),底物為 CLZ 或其合成的衍生物(CLZ-v)。當供體與受體不同時,其激發波長與發射波長的峰值也不相同。研究結果表明,其中 BRET3和 BRET6.1的能量轉移效率相對較高。BRET3中 RLuc8 作為 BRET供體,紅色熒光蛋白(DsRed2)的突變體 mOrange 作為BRET 的受體,用 CLZ 或 CLZ 的類似物 Enduren 作為底物。RLuc8-mOrange 的結合導致受體的發射處于橙色光譜區域(564 nm),同時在光強度方面也提高了數倍,具有較高的時間和空間分辨率,通過與光譜成像結合,在活的單細胞以及小動物模型的淺表和深部的組織結構中都能夠對BRET 信號進行成像。BRET6和 BRET6.1系統都是使用突變體 RLuc8.6 作為 BRET 供體,TurboFP635 作為受體,兩者分別催化底物 CLZ 和 CLZ-v 而產生相同的紅光(635 nm)。由于該融合蛋白優良的光譜分辨率和紅移的發射波長,因此無論在活的單細胞還是小動物模型的淺表甚至是深部的組織結構成像等方面都是有發展潛力的 BRET 系統。人們可以根據 BRET 方法各自的優缺點選擇合適的BRET。
3 BRET 在蛋白酶活性檢測中的應用
蛋白酶是生物體內一類重要的大分子,其功能的正常發揮維持著生命體正常的生理活動。許多病毒蛋白酶、細菌毒素等活性的發揮對正常的機體造成傷害,是重要的藥物靶標[32-35]。因此,分析監測蛋白酶活性,對于探究生命體生理活動機制和研發相關蛋白酶抑制劑等研究具有重要指導意義。BRET 嚴格依賴距離的特性為構建蛋白酶傳感器提供了理論的可行性。Helen Dacres 研究組在 2008 年研究發現運用 BRET2實時檢測凝血酶濃度靈敏性比運用 FRET 高50 倍,這也直接說明 BRET2比 FRET 更適合用來檢測蛋白酶活性[36]。典型的設計(圖1)是在供受體間連接一段易被蛋白酶特異切割的短肽,保持供受體距離足夠近而發生共振能量轉移,活性蛋白酶特異地識別并剪切 BRET 融合體系的連接肽,供受體不再受約束而彼此分開,BRET 作用減弱或消失。通過觀察 BRET 能量轉移的變化就能測定活性蛋白酶的活性和表達量。下面以實驗所運用 BRET 技術為分類標準綜述該技術在蛋白酶檢測中的應用(表1)。
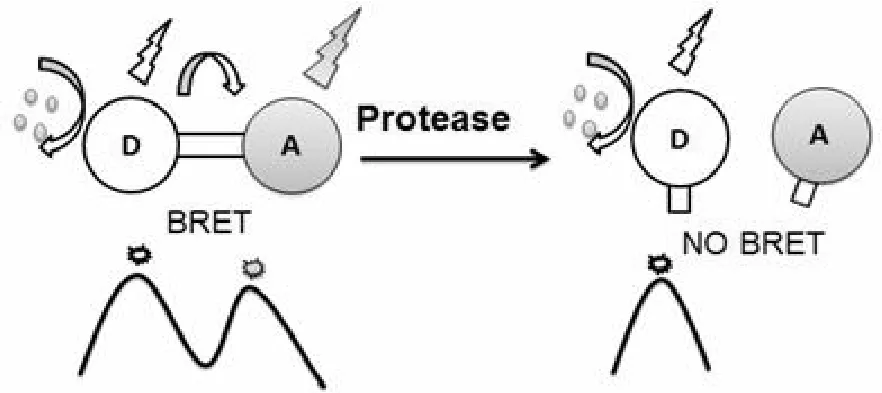
圖1 BRET 蛋白酶傳感器典型設計示意圖[37]
3.1CRET(Chemiluminescence resonance energy transfer)Waud 等[38]首次將 BRET 用于蛋白酶的活性檢測,將水母素作為能量的供體,GFP 或 EGFP 作為能量的受體,在酶學水平檢測了 α-凝血酶的活性,在細胞水平檢測了半胱氨酸蛋白酶-3(caspase-3)的活性。該文中能量供體選用水母素而非 BRET 系統中常用的海腎熒光素酶,并將此BRET 系統命名為 CRET。

表1 BRET 在蛋白酶活性檢測中的應用
3.2BRET1
Dacres 研究組分別構建了凝血酶和 caspase-3 的BRETl(Rluc/YFP)和 BRET2(Rluc/GFP2)傳感器,體外檢測了凝血酶和 caspase-3。對于凝血酶的檢測限達到了pmol/L 級,方法簡單且靈敏度高[39]。通過同種蛋白酶的兩種 BRET 傳感器的檢測結果比較,BRET2的靈敏度是BRET1體系的 2.9 倍,檢測限低 2.5 倍。證實了 BRET2體系比 BRETl更加靈敏,這也正是 BRET2應用更為廣泛的原因。
3.3BRET2
Hu 等[40]應用密碼子人源化的 Rluc(hRluc)和 GFP2(hGFP2)構建的 BRET2體系檢測 HIV-1 蛋白酶活性及其抑制劑的生物活性。構建原理是在 hRluc 和 hGFP2中間插入含有蛋白酶特異切割位點的肽段 p2/p7。在含有 HIV-1蛋白酶基因及缺失該基因的細胞內表達這種融合蛋白時,含有 HIV-1 蛋白酶基因的細胞中 BRET2信號降低,而缺失該基因的細胞中 BRET 信號保持穩定。向含有 HIV-1 蛋白酶基因的細胞加入 HIV-1 蛋白酶抑制劑 saquinavir 或amprenavir,或者改變蛋白酶切割位點序列都能抑制蛋白酶的活性而使 BRET 現象保持穩定。這種蛋白酶 BRET2生物傳感器測定法可適于高通量篩選新的 HIV-1 蛋白酶抑制劑,同時它也可用于篩選針對其他病毒蛋白酶的抗病毒化合物。
Oka 等[37]應用 BRET2系統在細胞水平檢測貓杯狀病毒(feline calicivirus,FCV)蛋白酶活性。該病毒常被用作不可培養的杯狀病毒的研究模型。實驗中熒光強度隨病毒的滴度而變化,該方法可以作為篩選 FCV 蛋白酶抑制劑的模型。
2012 年,Dacres 等[41]改進了凝血酶 BRET2傳感器,使用 Rluc 的兩個突變體 Rluc-2 和 Rluc-8 作為 BRET2的供體,構建了新的凝血酶 BRET2(Rluc2/GFP2和RLuc8/GFP2)傳感器,進一步提高了凝血酶檢測的限度。
3.4QD/BRET 系統
量子點(quantum dot,QD)是近年來研究很熱的新型納米熒光材料,直徑在 1 ~ 100 nm,具有量子產率高,穩定性好,吸收光譜寬,Stokes 位移大,發射波長可調等優點,被廣泛應用于生物分析領域[51-55],在作為BRET 受體方面也有研究報道。Rao 研究組 2006 年利用 RLuc8 與表面帶有活性羧基基團的 QD655 通過氨基-羧基形成酯鍵共價偶聯,構建了一種發射光紅移的 BRET 探針,具有光譜分辨率高,發射紅色光的優點,成功進行了較深組織和活體的示蹤[56-57]。使用紫外或藍色光區的激發光就能激發 QDs,發射光遍及藍色到紅色光區。因此,QD 作為 BRET 受體具有巨大的應用潛力。QD 作為受體最大的限制因素是它不能與 Rluc 等熒光素酶在基因水平上進行偶聯,在體內應用方面很受限制。2007 年 Rao 研究組報道了 RLuc8/QD 體系應用于基質金屬蛋白酶-2(matrix metalloproteinase-2,MMP-2)的分析[42]。RLuc8 的一端融合了一段帶有 MMP-2特異識別序列 GGPLGVRG 的 6xHis 標簽,表面帶有羧基的 QD655(發射光為 655 nm)能通過 Ni2+與 RLuc8 蛋白分子偶聯。用一定濃度的 MMP-2 處理帶有該標簽的RLuc8 時,連接肽被切割,RLuc8 分子與 His 標簽分離,與 His 標簽結合的 QD655 無法靠近 RLuc8,不能發生BRET 作用;而未經 MMP-2 處理,帶有 His 標簽的RLuc8 在 Ni2+的作用下與 QD 偶聯,發生 BRET 作用。通過 BRET 比值的計算就能測得 MMP-2 的濃度。由于該工作是在蛋白酶活反應之后再與受體 QD655 通過His-Ni2+-COOH 之間的配位鍵連接,結合力不夠強,背景較高。此后,2008 年他們再次改進了該體系,使用內含肽來共價連接 Rluc 與 QD[43-44]。未反應的 Rluc 能夠很容易地從體系中除去,降低了背景。這種 Rluc/QD 體系不僅檢測了緩沖液中的蛋白酶 MMP-2,還成功檢測了小鼠血清中的 MMP-2。通過使用不同發射光的 QD 還可實現同時檢測多種蛋白酶。例如,選擇 QD655 和QD705 分別構建Rluc/QD 體系,每種體系含有一種蛋白酶特異的酶切位點。可使用包含兩種蛋白酶特異識別位點的 BRET 體系混合物,同時檢測了兩種蛋白酶。這個方法對于 BRET 體系在多重檢測中的應用做了嘗試。2010 年他們利用納米金顆粒(gold nanoparticle,AuNPs)能夠淬滅熒光分子的這一熒光性質,設計了一種新型的 MMP-2 檢測傳感器 RLuc8/Au NPs體系[45]。中科院張先恩研究組利用富勒烯的兩個衍生物與人源化的 Gaussia 熒光素酶(hGluc)偶聯,用于分析α-凝血酶的活性,檢測限達到 14 pmol/L[46]。
Chen 等[47]構建了一種新的 pRluc/AuNPs 凝血酶無創檢測傳感器,并在添加尿液的溶液中檢測了凝血酶,傳感器檢測凝血酶的響應時間為 10 min 左右,檢測限為 80 pmol/L。
3.5溶液環境改進的 BRET 系統
由于 BBRT 中供體、基底及受體的敏感性,BRET 效率對溶液環境極其敏感。但目前關于溶液的各種組分是如何影響 BRET 的效率,又是如何影響檢測蛋白酶的活性分析,一直以來都沒有系統的研究報道。Li 等[48]利用 hGluc 作為供體,EYFP 作為受體,系統研究了溶液環境對 BRET 效率的影響。結果發現溶液環境包括緩沖溶液的組成、pH、二價離子等均能顯著影響 BRET 的效率。基于以上結果,他們優化得到一種靈敏高、低成本的基于 BRET 技術的蛋白酶檢測新體系,能使 BRET 效率提高到最好,從而極大地提高了 BRET 傳感器檢測腸激酶的性能,能將蛋白酶的檢測靈敏度提高 10 倍及檢出限提高 7 倍。這個系統能用于提高其他 BRET 傳感器對蛋白酶檢測的性能,特別是對于一些活性受環境影響較大的蛋白酶。Li 等[49]還構建了一種新的hGluc-tdTomat BRRT 系統,該系統具有非常好的光譜分辨率,△λ 達 110 nm,在體外純緩沖液中檢測腸激酶的檢測限為 2.1 pmol/L,含有 3% 血清的溶液中檢測限為 3.3 pmol/L。
2014 年,Wu 等[50]將 BRET2凝血酶傳感器再次進行改進,與微流檢測系統結合代替傳統的靜態微孔檢測。新的傳感系統稱作 BRETH(經典的 BRET2系統,CLZ 做底物)生物探針,并對該 BRETH生物探針 BRET 比率的影響因素即檢測的位置、流速、探針的濃度進行了定量分析。該BRETH凝血酶生物探針最低檢測限是 27 pmol/L,而靜態的微孔檢測最低檢測限為 310 pmol/L。
利用 BRET 技術分析蛋白酶的活性可用于蛋白酶活性抑制劑和蛋白酶靶標的篩選,由于很多與疾病相關的生理過程均有蛋白酶的參與,因此蛋白酶抑制劑的開發是疾病控制與治療的重要發展方向。結合上述報道的應用實例,利用BRET2體系分析 HIV-1 蛋白酶的活性,通過觀察活性物質作用下酶活的變化引起的 BRET 信號變化,能夠確定其是否具有 HIV-1 蛋白酶的抑制活性。通過這種方法,鑒定了已報道的兩種抑制劑,證實了一種新的抑制劑。此外,Rluc/QD 體系在檢測蛋白酶 MMP-2 的良好表現使其具有進一步篩選 MMP-2 抑制劑的巨大潛力。
4 BRET 技術的展望
基于生物發光的 BRET 技術己經被證明是一種有效的、多功能的生物分析工具,適用于研究蛋白-蛋白相互作用、細胞及活體影像、蛋白酶活性監測、藥物篩選等眾多領域。在研究機體重要生理過程,揭秘生命體重要生理事件,闡明其分子機制,開發藥物等應用中,BRET 技術作為一種重要的分析工具,發揮了越來越重要的作用,為生物醫學的進步做出了巨大貢獻。BRET 技術針對醫學、制藥和環境的目標分析物進行的超靈敏檢測和高通量篩選,順應了現代科學對分析技術的發展和要求。
盡管 BRET 有著背景極低,靈敏度高等顯著的優點,現有的 BRET 技術同樣也存在一些缺陷。應用最廣泛的BRET 體系所依賴的熒光素酶 Rluc 其量子產率較低,約束了進一步發展高效、高靈敏的 BRET 體系。此外,應用較多的 BRET 體系其發射光位于 600 nm 以下的藍色到橙色光區,不利于進行細胞及活體研究。新型的 BRET 體系應該具備發光強度高,酶活穩定性高,發光穩定的供體,譜分辨率較高。為適應體內研究,新型 BRET 體系應具備 600 nm以上的紅色發射光,可基因水平操作。
隨著科學的日新月異,大量新型熒光素酶和熒光物質得到了開發和應用,這些都成為未來 BRET 技術發展的技術儲備。隨著科學技術的不斷進步,分析技術的不斷完善,BRET 技術也將不斷得到完善和發展,必將在科學研究的廣闊領域里發揮越來越重要的作用。
參考文獻
[1] Davenport D, Nicol JAC. Luminescence in Hydromedusae. Proc Royal Soc London B: Biol Sci, 1955, 144(916):399-411.
[2] Morin JG, Hastings JW. Energy transfer in a bioluminescent system. J Cell Physiol, 1971, 77(3):313-318.
[3] Lorenz WW, McCann RO, Longiaru M, et al. Isolation and expression of a cDNA encoding Renilla reniformis luciferase. Proc Natl Acad Sci U S A, 1991, 88(10):4438-4442.
[4] F?rster T. Zwischenmolekulare energiewanderung und fluoreszenz. Annalen Der Physik, 1948, 437(1-2):55-75.
[5] Lewis JC, Daunert S. Dual detection of peptides in a fluorescence binding assay by employing genetically fused GFP and BFP mutants. Anal Chem, 1999, 71(19):4321-4327.
[6] Milligan G. Applications of bioluminescence- and fluorescence resonance energy transfer to drug discovery at G protein-coupled receptors. Eur J Pharm Sci, 2004, 21(4):397-405.
[7] Xia ZY, Rao JH. Biosensing and imaging based on bioluminescence resonance energy transfer. Curr Opin Biotechnol, 2009, 20(1):37-44.
[8] Xu Y, Piston DW, Johnson CH. A bioluminescence resonance energy transfer (BRET) system: application to interacting circadian clock proteins. Proc Natl Acad Sci U S A, 1999, 96(1):151-156.
[9] Tsien RY, Bacskai BJ, Adams SR. FRET for studying intracellular signalling. Trends Cell Biol, 1993, 3(7):242-245.
[10] Wu P, Brand L. Resonance energy transfer: methods and applications. Anal Biochem, 1994, 218(1):1-13.
[11] Pfleger KD, Seeber RM, Eidne KA. Bioluminescence resonance energy transfer (BRET) for the real-time detection of protein-protein interactions. Nat Protoc, 2006, 1(1):337-345.
[12] Pfleger KD, Eidne KA. Illuminating insights into protein-protein interactions using bioluminescence resonance energy transfer (BRET). Nat Methods, 2006, 3(3):165-174.
[13] Stoddart LA, Johnstone EK, Wheal AJ, et al. Application of BRET to monitor ligand binding to GPCRs. Nat Methods, 2015, 12(7):661-663. [14] Xia Z, Rao J. Biosensing and imaging based on bioluminescence resonance energy transfer. Curr Opin Biotechnol, 2009, 20(1):37-44.
[15] De A, Jasani A, Arora R, et al. Evolution of BRET biosensors from live cell to tissue-scale in vivo imaging. Front Endocrinol (Lausanne), 2013, 4:131.
[16] Schaub FX, Reza MS, Flaveny CA, et al. Fluorophore-nanoLuc BRET reporters enable sensitive in vivo optical imaging and flow cytometry for monitoring Tumorigenesis. Cancer Res, 2015, 75(23):5023-5033.
[17] Bacart J, Corbel C, Jockers R, et al. The BRET technology and its application to screening assays. Biotechnol J, 2008, 3(3):311-324.
[18] Tsien RY. The green fluorescent protein. Annu Rev Biochem, 1998, 67(1):509-544.
[19] Xu Y, Kanauchi A, Piston D, et al. Resonance energy transfer as an emerging technique for monitoring protein-protein interactions in vivo: BRET vs. FRET//Van Dyke K, Van Dyke C, Woodfork K. Luminescence biotechnology: instruments and applications. Boca Raton, Florida: CRC Press, 2001:529-538.
[20] Arai R, Nakagawa H, Tsumoto K, et al. Demonstration of a homogeneous noncompetitive immunoassay based on bioluminescence resonance energy transfer. Anal Biochem, 2001, 289(1):77-81.
[21] Boute N, Jockers R, Issad T. The use of resonance energy transfer in high-throughput screening: BRET versus FRET. Trends Pharmacol Sci, 2002, 23(8):351-354.
[22] Jensen AA, Hansen JL, Sheikh SP, et al. Probing intermolecular protein-protein interactions in the calcium-sensing receptor homodimer using bioluminescence resonance energy transfer (BRET). Eur J Biochem, 2002, 269(20):5076-5087.
[23] Yamakawa Y, Ueda H, Kitayama A, et al. Rapid homogeneous immunoassay of peptides based on bioluminescence resonance energy transfer from firefly luciferase. J Biosci Bioeng, 2002, 93(6):537-542.
[24] Dacres H, Michie M, Wang J, et al. Effect of enhanced Renilla luciferase and fluorescent protein variants on the F?rster distance ofBioluminescence resonance energy transfer (BRET). Biochem Biophys Res Commun, 2012, 425(3):625-629.
[25] Bertrand L, Parent S, Caron M, et al. The BRET2/arrestin assay in stable recombinant cells: a platform to screen for compounds that interact with G protein-coupled receptors (GPCRS). J Recept Signal Transduct Res, 2002, 22(1-4):533-541.
[26] Levi J, De A, Cheng Z, et al. Bisdeoxycoelenterazine derivatives for improvement of bioluminescence resonance energy transfer assays. J Am Chem Soc, 2007, 129(39):11900-11901.
[27] De A, Loening AM, Gambhir SS. An improved bioluminescence resonance energy transfer strategy for imaging intracellular events in single cells and living subjects. Cancer Res, 2007, 67(15):7175-7183.
[28] Loening AM, Fenn TD, Wu AM, et al. Consensus guided mutagenesis of Renilla luciferase yields enhanced stability and light output. Protein Eng Des Sel, 2006, 19(9):391-400.
[29] Hoshino H, Nakajima Y, Ohmiya Y. Luciferase-YFP fusion tag with enhanced emission for single-cell luminescence imaging. Nat Methods, 2007, 4(8):637-639.
[30] Arai R, Nakagawa H, Kitayama A, et al. Detection of protein-protein interaction by bioluminescence resonance energy transfer from firefly luciferase to red fluorescent protein. J Biosci Bioeng, 2002, 94(4): 362-364.
[31] Dragulescu-Andrasi A, Chan CT, De A, et al. Bioluminescence resonance energy transfer (BRET) imaging of protein-protein interactions within deep tissues of living subjects. Proc Natl Acad Sci U S A, 2011, 108(29):12060-12065.
[32] Budd RC. Activation-induced cell death. Curr Opin Immunol, 2001, 13(3):356-362.
[33] Carragher NO. Calpain inhibition: a therapeutic strategy targeting multiple disease states. Curr Pharm Des, 2006, 12(5):615-638.
[34] Gammon ST, Villalobos VM, Roshal M, et al. Rational design of novel red-shifted BRET pairs: Platforms for real-time single-chain protease biosensors. Biotechnol Prog, 2009, 25(2):559-569.
[35] Fingleton B. Matrix metalloproteinases as valid clinical targets. Curr Pharm Des, 2007, 13(3):333-346.
[36] Dacres H, Dumancic MM, Horne I, et al. Direct comparison of fluorescence- and bioluminescence-based resonance energy transfer methods for real-time monitoring of thrombin-catalysed proteolytic cleavage. Biosens Bioelectron, 2009, 24(5):1164-1170.
[37] Oka T, Takagi H, Tohya Y, et al. Bioluminescence technologies to detect calicivirus protease activity in cell-free system and in infected cells. Antiviral Res, 2011, 90(1):9-16.
[38] Waud JP, Bermúdez Fajardo A, Sudhaharan T, et al. Measurement of proteasesusingchemiluminescence-resonance-energy-transfer chimaeras between green fluorescent protein and aequorin. Biochem J, 2001, 357(Pt 3):687-697.
[39] Dacres H, Dumancic MM, Horne I, et al. Direct comparison of bioluminescence-based resonance energy transfer methods for monitoring of proteolytic cleavage. Anal Biochem, 2009, 385(2):194-202.
[40] Hu K, Clément JF, Abrahamyan L, et al. A human immunodeficiency virus type 1 protease biosensor assay using bioluminescence resonance energy transfer. J Virol Methods, 2005, 128(1-2):93-103.
[41] Dacres H, Michie M, Trowell SC. Comparison of enhanced bioluminescence energy transfer donors for protease biosensors. Anal Biochem, 2012, 424(2):206-210.
[42] Yao H, Zhang Y, Xiao F, et al. Quantum dot/bioluminescence resonance energy transfer based highly sensitive detection of proteases. Angew Chem Int Ed Engl, 2007, 46(23):4346-4349.
[43] Xia Z, Xing Y, So MK, et al. Multiplex detection of protease activity with quantum dot nanosensors prepared by intein-mediated specific bioconjugation. Anal Chem, 2008, 80(22):8649-8655.
[44] Xing Y, So MK, Koh AL, et al. Improved QD-BRET conjugates for detection and imaging. Biochem Biophys Res Commun, 2008, 372(3): 388-394.
[45] Kim YP, Daniel WL, Xia Z, et al. Bioluminescent nanosensors for protease detection based upon gold nanoparticle-luciferase conjugates. Chem Commun (Camb), 2010, 46(1):76-78.
[46] Yu J, Guan M, Li F, et al. Effects of fullerene derivatives on bioluminescence and application for protease detection. Chem Commun (Camb), 2012, 48(89):11011-11013.
[47] Chen L, Bao Y, Denstedt J, et al. Nanostructured bioluminescent sensor for rapidly detecting thrombin. Biosens Bioelectron, 2016, 77:83-89.
[48] Li F, Yu J, Zhang Z, et al. Buffer enhanced bioluminescence resonance energy transfer sensor based on Gaussia luciferase for in vitro detection of protease. Anal Chim Acta, 2012, 724:104-110.
[49] Li F, Yu J, Zhang Z, et al. Use of hGluc/tdTomato pair for sensitive BRET sensing of protease with high solution media tolerance. Talanta, 2013, 109:141-146.
[50] Wu N, Dacres H, Anderson A, et al. Comparison of static and microfluidic protease assays using modified bioluminescence resonance energy transfer chemistry. PLoS One, 2014, 9(2):e88399.
[51] Bruchez M Jr, Moronne M, Gin P, et al. Semiconductor nanocrystals as fluorescent biological labels. Science, 1998, 281(5385):2013-2016. [52] Chan WC, Nie S. Quantum dot bioconjugates for ultrasensitive nonisotopic detection. Science, 1998, 281(5385):2016-2018.
[53] Alivisatos P. The use of nanocrystals in biological detection. Nat Biotechnol, 2004, 22(1):47-52.
[54] Gao X, Cui Y, Levenson RM, et al. In vivo cancer targeting and imaging with semiconductor quantum dots. Nat Biotechnol, 2004, 22(8):969-976.
[55] Medintz IL, Uyeda HT, Goldman ER, et al. Quantum dot bioconjugates for imaging, labelling and sensing. Nat Mater, 2005, 4(6):435-446.
[56] So MK, Loening AM, Gambhir SS, et al. Creating self-illuminating quantum dot conjugates. Nat Protoc, 2006, 1(3):1160-1164.
[57] So MK, Xu C, Loening AM, et al. Self-illuminating quantum dot conjugates for in vivo imaging. Nat Biotechnol, 2006, 24(3):339-343.
·綜述·
收稿日期:2015-11-17
通信作者:王偉,Email:wwang@imm.ac.cn
基金項目:國家自然科學基金(30772677、81072562);“重大新藥創制”國家科技重大專項(2012ZX09301002)
DOI:10.3969/j.issn.1673-713X.2016.01.010

