脈絡膜微循環障礙在糖尿病視網膜病變中的作用
李科軍,趙智華,趙曉彬,樊芳,賈志旸(河北省人民醫院,石家莊050000)
?
脈絡膜微循環障礙在糖尿病視網膜病變中的作用
李科軍,趙智華,趙曉彬,樊芳,賈志旸(河北省人民醫院,石家莊050000)
摘要:目的觀察不同階段糖尿病視網膜病變(DR)患者的脈絡膜微循環情況,探討脈絡膜微循環障礙在DR發病中的作用。方法選擇2型糖尿病患者50例,按照DR病變階段分為無DR(NDR)組16例、非增殖型DR(NPDR)組20例、增殖型DR(PDR)組14例。另選擇患有不影響眼部微循環的眼部疾病患者20例作為對照組。各組均行同步眼底熒光素血管造影(FFA)觀察臂-視網膜中央動脈充盈時間,行吲哚青綠血管造影(ICGA)觀察臂-脈絡膜動脈充盈時間,行球后血管血流狀態的彩色多普勒(CDFI)檢測睫狀后動脈的收縮期峰值血流速度(PSV)、舒張末期血流速度(EDV)、阻力指數(RI)。結果各組臂-視網膜中央動脈充盈時間差異無統計學意義(P均>0.05)。NDR組、NPDR組及PDR組臂-脈絡膜動脈充盈時間均長于對照組(P均<0.05)。NDR組、NPDR組及PDR組PSV、EDV均低于對照組,RI均高于對照組(P均<0.05)。PDR組PSV、EDV均低于NPDR組,RI高于NPDR組(P均<0.05)。NPDR組、PDR組臂-脈絡膜動脈充盈時間與睫狀后動脈PSV呈負相關(r=-0.844,P<0.01)。結論脈絡膜微循環障礙的出現早于DR發病,是導致DR發生、發展的重要原因。
關鍵詞:糖尿病視網膜病變;脈絡膜;睫狀后動脈
糖尿病病變可累及全身各個系統,導致多個部位出現微血管性病變,累及視網膜微血管則可引起糖尿病視網膜病變(DR)。脈絡膜微循環供血占眼球血供的90%,是眼球血供的主要來源。目前,對脈絡膜微循環障礙在DR發生、發展中的作用尚不明確。2013年1月~2014年12月,我們觀察了不同階段DR患者的脈絡膜微循環變化情況,探討脈絡膜微循環障礙在DR發病中的作用,為DR的防治提供依據。
1資料與方法
1.1臨床資料選擇同期在我院確診的2型糖尿病患者50例,男26例、女24例,年齡21~70(50.2±10.2)歲,病程1~20(6.8±3.7)年,空腹血糖6.2~14.8(8.8±2.4)mmol/L,眼壓14~21 mmHg。根據2001年美國糖尿病視網膜病變早期治療研究協助組(ETDRS)制訂的《糖尿病視網膜病變分期標準》,將患者分為無DR(NDR)組16例、非增殖型DR(NPDR)組20例、增殖型DR(PDR)組14例。排除玻璃體積血及纖維增殖性玻璃體視網膜病變者。另選擇患有不影響眼部微循環的眼部疾病患者20例作為對照組,男11例、女9例,年齡29~59(49.5±7.1)歲,眼壓13~21 mmHg,無糖尿病、高血壓、心腦血管疾病及血液病等。兩組年齡、性別差異無統計學意義。
1.2脈絡膜微循環檢查項目①臂-視網膜中央動脈充盈時間:各組均行同步眼底熒光素血管造影(FFA),由造影早期至晚期共30 min,觀察臂-視網膜中央動脈充盈時間。②臂-脈絡膜動脈充盈時間:各組均行吲哚青綠血管造影(ICGA),由造影早期至晚期共30 min,觀察臂-脈絡膜動脈充盈時間。③睫狀后動脈血流動力學參數:各組均行球后血管血流狀態的彩色多普勒(CDFI)檢查,于球后3~5 mm視神經暗區兩側探測睫狀后動脈,將取樣容積置于血管中獲取最大血流頻譜,檢測睫狀后動脈的收縮期峰值血流速度(PSV)、舒張末期血流速度(EDV)、阻力指數(RI)。
2結果
2.1各組臂-視網膜中央動脈充盈時間比較對照組、NDR組、NPDR組、PDR組臂-視網膜中央動脈充盈時間分別為(12.52±1.05)、(13.66±2.63)、(13.58±2.75)、(14.05±1.91)s,各組臂-視網膜中央動脈充盈時間差異無統計學意義。
2.2各組臂-脈絡膜動脈充盈時間比較對照組、NDR組、NPDR組及PDR組臂-脈絡膜動脈充盈時間分別為(11.62±1.01)、(14.10±2.70)、(14.78±3.39)、(15.38±1.82)s,NDR組、NPDR組及PDR組臂-脈絡膜動脈充盈時間均長于對照組(P均<0.05)。NDR組、NPDR組、PDR組臂-脈絡膜充盈時間差異無統計學意義。
2.3各組睫狀后動脈血流動力學參數比較NDR組、NPDR組及PDR組PSV、EDV均低于對照組,RI均高于對照組(P均<0.05)。PDR組PSV、EDV均低于NPDR組,RI高于NPDR組(P均<0.05)。見表1。
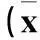
表1 各組睫狀后動脈血流動力學參數比較±s)
注:與對照組比較,*P<0.05;與NPDR組比較,#P<0.05。
2.4臂-脈絡膜動脈充盈時間與睫狀后動脈血液流速的相關性 NPDR組、PDR組患者的臂-脈絡膜動脈充盈時間與睫狀后動脈PSV呈負相關(r=-0.844,P<0.01),與EDV無相關性(r=-0.403,P>0.05)。
3討論
微血管病變是糖尿病的主要并發癥之一,主要累及視網膜、腎、心肌等組織,導致微循環障礙、微血管瘤形成和微血管基底膜增厚。研究發現,糖尿病患者的脈絡膜毛細血管基底膜增厚,毛細血管管腔狹窄及管腔閉塞,這與本研究中PCA的流速下降及RI升高一致[1]。隨著病程進展,由于視網膜脈絡膜病變更加廣泛,出現色素上皮細胞活化,Bruch膜破裂、缺血,進一步導致了脈絡膜循環的缺損,更加重了視網膜的缺血缺氧,使VEGF合成增加,發生增殖性視網膜脈絡膜病變[1]。
脈絡膜微循環是體內血液循環最豐富的組織之一,正常時為視網膜外層以及黃斑區供血[1]。當出現血流量變化時,視網膜循環可根據局部代謝因素自動調節血流量,以防止視網膜內層供血不足,而脈絡膜則無自動調節功能。因此,在眼部血供減少時,視網膜內層血供可得到優先保證,而供應視網膜外層的脈絡膜并不能相應調整血供,導致視網膜外層血流明顯減緩、血供減少。本研究發現,各組臂-視網膜中央動脈充盈時間差異無統計學意義,而NDR組、NPDR組及PDR組臂-脈絡膜動脈充盈時間均長于對照組,提示在糖尿病患者中臂-視網膜中央動脈充盈時間相對于正常人無明顯變化,而臂-脈絡膜動脈充盈時間較正常人明顯延長,表明糖尿病患者的視網膜中央動脈已經進行自動調節,保證了視網膜內層的血液循環,而脈絡膜的血液流速減緩,視網膜外層的血供減少,最終導致了糖尿病視網膜脈絡膜病變的發生。
發生于脈絡膜微循環的血流動力學異常變化是導致DR發生、發展的主要原因,可能與脈絡膜微循環障礙后視網膜的氧和液體供應減少有關。研究發現,脈絡膜動脈充盈遲緩在DR的病變進展中發揮重要作用[9]。無DR的糖尿病患者已存在脈絡膜微循環動力學變化及微血管病灶,出現如脈絡膜動脈搏動性血流降低、毛細血管基底膜增厚、毛細血管管腔狹窄及管腔閉塞等改變[3,4]。隨著DR病程進展,脈絡膜微循環病變進一步加重,視網膜色素上皮細胞活化,Bruch膜破裂、缺血,加重了視網膜缺血缺氧,使VEGF合成增加,出現新生血管增殖,最終從NPDR進展至PDR[5~7]。本研究發現,NDR組、NPDR組及PDR組臂-脈絡膜動脈充盈時間均長于對照組,提示糖尿病患者未發生DR時脈絡膜微循環已出現血流減慢,隨著病變進展,出現脈絡膜微循環病變進一步加重,導致視網膜缺血缺氧,從而加重至PDR階段。
脈絡膜血液循環由眼動脈發出的睫狀后動脈供給[8]。睫狀后動脈最終分支為10~20支睫狀后短動脈及睫狀后長動脈,其中睫狀后短動脈供應赤道以內的后極部脈絡膜。動脈流速高低反映該組織的充盈及灌注情況[4]。RI反映血管的順應性[10]。研究發現,應用血管緊張素轉換酶抑制劑(ACEI)可使血管特別是脈絡膜動脈的緊張性降低,改善血-視網膜屏障功能,減少蛋白滲漏,從而明顯延緩DR的進展[11,12]。本研究發現,NDR組睫狀后動脈的PSV及EDV均低于對照組、RI高于對照組,結合ICGA所示NDR組臂-脈絡膜動脈充盈時間均長于對照組,考慮尚未發生視網膜病變的NDR患者就已出現脈絡膜微循環障礙及睫狀后動脈血流動力學異常,導致脈絡膜微循環灌注不良。本研究發現,PDR組PSV及EDV均低于NPDR組、RI高于NPDR組,NPDR組、PDR組患者的臂-脈絡膜動脈充盈時間與PSV呈負相關,提示隨著糖尿病病程的進展,脈絡膜微循環的血流狀態進一步惡化,出現灌注不良及血管緊張性加重,使得PDR患者的睫狀后動脈微血管病變重于NPDR患者,從而加重視網膜缺血,可能是導致DR進展的重要機制。
總之,DR患者存在脈絡膜微循環障礙,而且在視網膜病變發生之前已存在,可能是導致DR進展的重要原因。早期針對脈絡膜微循環障礙進行相應治療,可能有助于對DR的預防及治療。
參考文獻:
[1] Cao J, Mcleod DS, Lutty GA, et al. Choroicapillaries degenaration and related pathologic changes in human diabetes eyes[J]. Arch Ophthalmol, 1998,116(5):589-597.
[2] Dimitrova G, Kato S, Tamaki Y, et al. Choroidal circulation in diabetic patient[J]. Eye, 2001,15(5):602-607.
[3] Weinberger D, Kramer M, Priel E, et al. Indocyanine green angiographic findings in nonproliferative diabetic retinopathy[J]. Am J Ophthalmol, 1998,126(2):238-247.
[4] Mackinwon JR, Mckillop G, Brien CO, et al. Colour Doppler imaging of the ocular circulation in diabetic retinopathy[J]. Acta Ophalmol Scand, 2000,78(4):386-389.
[5] Amore PA. Mechanisms of retinal and choroidal neovascularization[J]. Invest Ophthalmol Vis Sci, 1994,35(12):3974-3979.
[6] Ferrara D, Waheed NK, Duker JS.Investigating the choriocapillaris and choroidal vasculature with new optical coherence tomography technologies[J]. Prog Retin Eye Res, 2015,10 (15):82-88.
[7] Hua R, Liu L, Wang X, et al. Imaging evidence of diabetic choroidopathy in vivo: angiographic pathoanatomy and choroidal-enhanced depth imaging[J]. PLoS One, 2013,8(12):83494.
[8] Muir ER, Rentería RC, Duong TQ. Reduced ocular blood flow as an early indicator of diabetic retinopathy in a mouse model of diabetes[J]. Invest Ophthalmol Vis Sci, 2012,53(10):6488-6494.
[9] Lutty GA. Effects of diabetes on the eye[J]. Invest Ophthalmol Vis Sci, 2013,54(14):81-87.
[10] Legarth J, Nolsoe C. Doppler blood flow velocity waveforms and relations to peripheral resistence in the branchial artery[J]. J Ultrosound Med, 1990,9(3):449-453.
[11] Feke GT, Yoshida A,Ogasawara H, et al.Retinal blood flow increases following short-term Aspirin usage in type Ι diabetes with no or minimal retinopathy[J]. Ophthalmic Res, 1996,28(2):10-116.
[12] Shirogami C, Shiraga F, Matsuo T. Risk factors for diabetic choroidopathy in patients with diabetic retinopathy[J]. Grafes Arch Clin Exp Ophthalmol, 2002,240(6):436-442.
(收稿日期:2015-12-09)
中圖分類號:R774.1;R587.2
文獻標志碼:B
文章編號:1002-266X(2016)14-0044-03
doi:10.3969/j.issn.1002-266X.2016.14.015
通信作者:賈志旸(E-mail: jiazhiyang20759@sina.com)
基金項目:河北省中醫藥管理局中醫藥類科研計劃項目(2014043)。

