CYP2C8代謝紫杉醇產物6α—羥基紫杉醇的LC—MS/MS檢測
黃潔瓊
【摘 要】本文以紫杉醇為底物,建立其CYP2C8代謝產物6α-羥基紫杉醇的LC-MS/MS方法,為CYP2C8酶活性的研究提供可靠、靈敏、快速的檢測分析方法。采用電噴霧離子源(ESI),三級四級桿串聯質譜,多級反應監測進行定量,正離子掃描,選取離子對為6α-羥基紫杉醇892.3→308.1;內標多西紫杉醇830.3→549.4。利用Agela Venusil XBP C18 色譜柱(50×2.1mm;5μm)實現代謝物分離,柱溫40℃,流速為0.3mL/min,流動相為A相(水∶乙腈=95∶5)與B相(水∶乙腈=5∶95)梯度混合。代謝物6α-羥基紫杉醇與內標實現基線分離,峰形良好,而且不存在代謝與內標之間的干擾,且6α-羥基紫杉醇在5-500ng/ml的范圍為線性關系良好;該方法快速靈敏可用于CYP2C8活性檢測。
【關鍵詞】紫杉醇;CYP2C8;LC-MS
細胞色素P450酶(CYP450)是存在于細胞內質網上的蛋白質超家族,它對多種內源性、外源性物質在體內的氧化反應起著重要的作用,是藥物動力學和反應的變化的一個主要原因。在推定的57個有功能的人類細胞色素P450中,只有屬于CYP1、CYP2、CYP3這三個家族的大約十幾個酶對藥物的代謝起主要作用,其中包括CYP1A2、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP3A4、CYP3A5等[1]。其中,CYP2C8是CYP2C家族中最晚發現的一個成員,大約占CYP2C家族的26%。CYP2C8主要分布在肝臟,占肝CYP代謝酶總量的7%;其在肝臟外的組織中也存在少量的分布[2]。CYP2C8參與催化大約5%的臨床藥物,并且存在著明顯的基因多態性,對藥物的代謝清除有著明顯的影響。
紫杉醇是一種抗微管細胞藥物,被廣泛應用于治療卵巢癌、肺癌、乳腺癌、胃癌、頭頸部癌等惡性腫瘤[3]。紫杉醇在人體內能夠被CYP3A4和CYP2C8代謝,分別生成p-3-羥基紫杉醇和6α-羥基紫杉醇[4-5]。在人肝微粒體中,6α-羥基紫杉醇的生成量高于p-3-羥基紫杉醇,這表明CYP2C8在紫杉醇體內代謝過程中發揮著重要作用[6]。為了研究CYP2C8酶活性則必須要建立快速、可靠、靈敏的檢測酶活性方法。本文以紫杉醇為底物,建立其CYP2C8代謝產物6α-羥基紫杉醇的LC-MS/MS方法,為CYP2C8酶活性的研究提供可靠,靈敏,快速的檢測分析方法。
1 試劑和儀器
1.1 試劑
甲醇(Merck,德國);乙腈(Merck,德國);紫杉醇及其代謝物6α-羥基紫杉醇(BD,美國);多西紫杉醇(sigma,美國)。
1.2 儀器
液相色譜系統為日本Shimadzu液相色譜系統,包括LC-20AD輸液泵,SIL-20A自動進樣器以及Shimadzu CTO-20A柱溫箱;質譜系統為美國Applied Biosystems公司API 4000 Q TRAP三重四級桿串聯質譜儀,配備電噴霧電離源(Turbo Ionspray)以及Analyst 1.4.2數據采集軟件。
2 底物代謝物LC-MS/MS方法的構建
(1)用甲醇或乙腈將紫杉醇及其代謝產物6α-羥基紫杉醇稀釋至約1000ng/mL;
(2)激活Mass only,修改參數,以10μL/min進入質譜儀;
(3)記錄相應參數:底物及代謝產物的母離子Q1、子離子Q3、去溶劑電壓DP,撞擊能量CE;
(4)激活LC/MS,修改參數。選擇合適流動相,分別用甲醇或乙腈配制低高兩個濃度的代謝產物單樣及低、高兩個濃度的代謝產物和內標的混合液進樣,調整相應參數使得底物,代謝產物及內標實現基線分離并使其系列濃度擁有良好的線性;
(5)清洗管路。
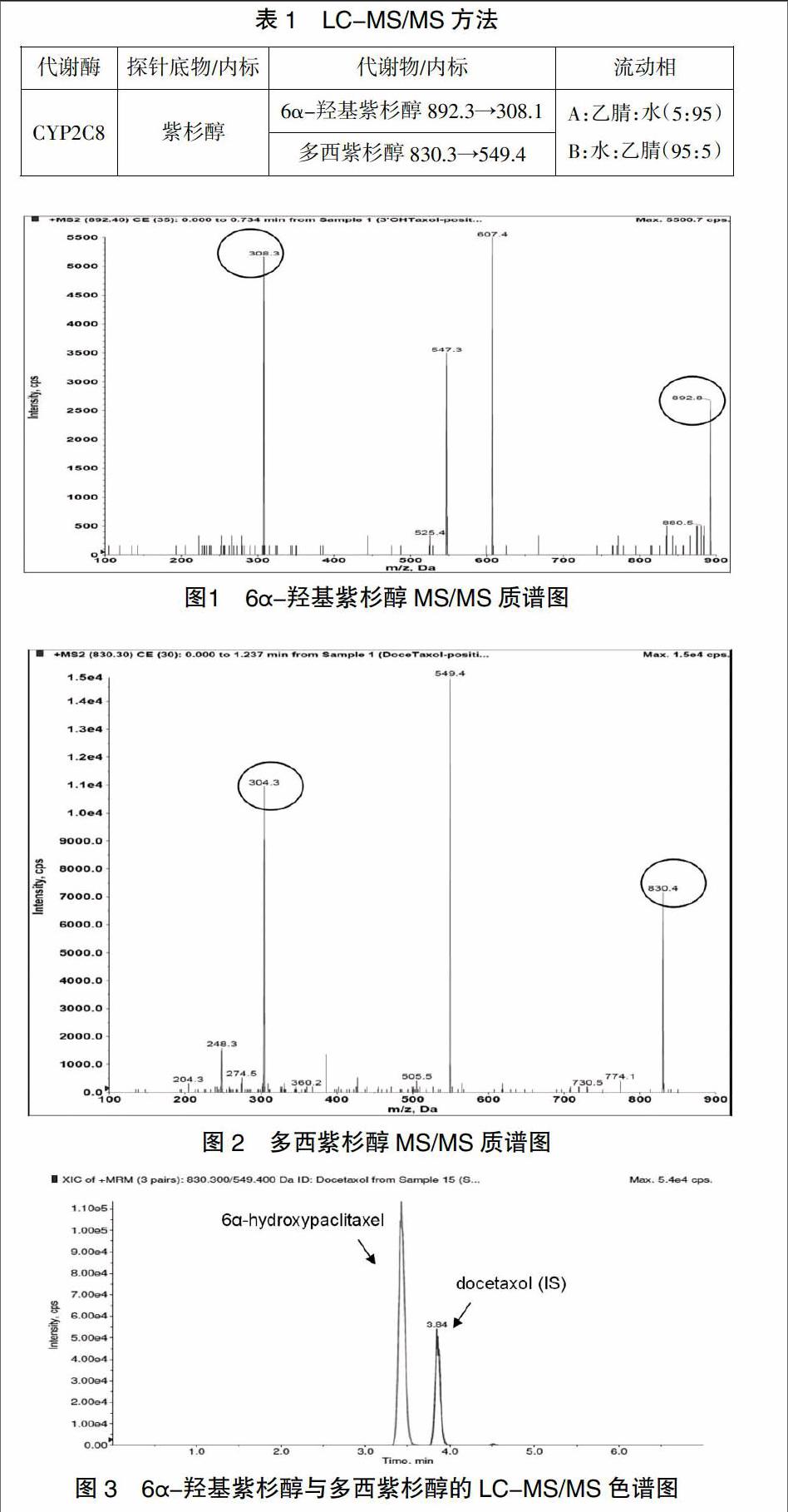
3 結果
通過液相串聯質譜對紫杉醇的代謝產物6α-羥基紫杉醇建立專屬靈敏的LC-MS/MS方法,進行定量檢測。采用正離子模式,選擇離子對m/z 892.4→324.1(圖1)和m/z 830.3→549.4(圖2)分別測定6α-羥基紫杉醇和多西紫杉醇(內標)的含量;色譜圖如圖3所示,方法總結見表1。代謝物與內標實現基線分離,峰形良好,而且不存在代謝與內標之間的干擾,6α-羥基紫杉醇在5-500ng/ml的范圍為線性關系良好。該方法快速靈敏可用于CYP2C8活性檢測。
4 結論
本文選取紫杉醇為CYP2C8代謝酶的探針底物,并建立了其主要代謝物6α-羥基紫杉醇的LC-MS方法,代謝物與內標峰形良好,分離度好,且不存在相互干擾,可為評價CYP2C8代謝酶的活性提供靈敏、快速、特征專屬的檢測方法。
【參考文獻】
[1]謝章明.人CYP3A4與POR及cytb_5共表達條件的優化以及表達產物在藥物相互作用研究中的應用[D].浙江大學,2013.
[2]Klose TS, Blaisdell JA, Goldstein JA. Gene structure of CYP2C8 and extrahepatic distribution of the human CYP2Cs[J]. Journal of Biochemical & Molecular Toxicology, 1999,13(6):289-295.
[3]郭培鳳,郭云利.紫杉醇應用相關不良反應觀察[J].醫學信息,2014(2):643.
[4]Monsarrat B, Mariel E, Cros S, et al. Taxol metabolism. Isolation and identification of three major metabolites of taxol in rat bile[J]. Drug Metabolism & Disposition, 1990, 18(6):895-901.
[5]Walle T, Kumar GN, McMillan JM, et al. Taxol metabolism in rat hepatocytes[J]. Biochemcal Pharmacology, 1993,46(9):1661-1664.
[6]Taniguchi R, Kumai T, Matsumoto N, et al. Utilization of human liver microsomes to explain individual differences in paclitaxel metabolism by CYP2C8 and CYP3A4[J]. Journal of Pharmacological Sciences, 2005,97(1):83-90.
[責任編輯:王楠]

