高密度CO2對凡納濱對蝦肌球蛋白疏水性的影響
郭明慧,鄧倩琳,劉書成,鄧楚津,吉宏武,李承勇,高 靜(廣東海洋大學食品科技學院//廣東省水產品加工與安全重點實驗室//廣東普通高等學校水產品深加工重點實驗室,廣東 湛江 524088)
?
高密度CO2對凡納濱對蝦肌球蛋白疏水性的影響
郭明慧,鄧倩琳,劉書成,鄧楚津,吉宏武,李承勇,高靜
(廣東海洋大學食品科技學院//廣東省水產品加工與安全重點實驗室//廣東普通高等學校水產品深加工重點實驗室,廣東湛江 524088)
摘要:為揭示高密度 CO2(Dense Phase Carbon Dioxide,DPCD)誘導肌球蛋白形成凝膠的機制,利用ANS探針法和熒光法,分別測定在壓力5~30 MPa、溫度50~70 ℃、時間10~50 min等不同處理條件下肌球蛋白表面疏水性和酪氨酸內源熒光值,探討DPCD對凡納濱對蝦肌球蛋白高級結構的影響。研究表明:與未處理的肌球蛋白相比,DPCD處理能使肌球蛋白的表面疏水性和酪氨酸內源熒光值顯著增加(P<0.05);在相同溫度下,DPCD處理的肌球蛋白的表面疏水性和酪氨酸內源熒光值顯著高于水浴熱處理的(P<0.05);DPCD處理壓力、溫度升高以及時間延長,均能使肌球蛋白的表面疏水性和酪氨酸內源熒光值顯著增加(P<0.05)。DPCD能夠誘導肌球蛋白疏水基團暴露,使緊密的高級結構發生松散。
關鍵詞:高密度CO2;肌球蛋白;表面疏水性;酪氨酸
蝦糜制品(蝦肉丸和蝦肉腸)是蝦類高附加值產品之一。蝦糜制品是利用蝦肉中蛋白質發生變性和聚集而形成的凝膠類制品。肌球蛋白不僅是蝦肉中含量最高的蛋白,而且是形成具有三維網絡彈性凝膠的主要蛋白,對蝦糜制品的品質(彈性、多汁性、口感等)具有重要影響[1-3]。在蛋白質形成凝膠過程中,蛋白質暴露的疏水基團越多,疏水性越強,蛋白質就越易發生聚集[4];另外,蛋白質的疏水性也是影響分子間相互作用的主要因素[5]。因此,測定蛋白質疏水性的變化可以初步反映蛋白質發生變性聚集的可能性。高密度CO2(dense phase carbon dioxide,DPCD)處理是一種非熱加工技術,它能夠在滅菌保證食品安全的同時,最小程度地影響食品原有風味和色澤等[6]。利用DPCD技術對食品進行殺菌鈍酶的同時,也會誘導食品蛋白質發生一定程度的變性[7]。本課題組前期研究表明:DPCD能夠誘導蝦肉糜形成凝膠;與熱誘導凝膠相比,DPCD誘導的凝膠具有較高的凝膠強度和更為致密的凝膠網絡結構,并且保留了更多的水分和營養成分[8-9]。
本研究以凡納濱對蝦(Litopenaeus vannamei)肌球蛋白為研究對象,利用ANS探針法和熒光法分別測定肌球蛋白表面疏水性和酪氨酸內源熒光值在不同處理條件下(壓力5~30 MPa、溫度50~70 ℃、時間10~50 min)的變化,初步探討DPCD對凡納濱對蝦肌球蛋白高級結構的影響,旨在為研究DPCD誘導蝦肉糜形成凝膠的機制提供基礎數據。
1 材料和方法
1.1材料
凡納濱對蝦(Litopenaeus vannamei),購于湛江東風水產批發市場,加氧保活運至實驗室。用自來水清洗后,選取完整、大小均一個體,去頭、殼、腸腺,待用。
1.2試劑與儀器
試劑:快速Lowry法蛋白含量測定試劑盒,購于上海荔達生物科技有限公司;8-苯氨基-1-萘磺酸(ANS),購于美國Sigma公司;5-三磷酸腺苷二鈉鹽(ATP)、二硫代蘇糖醇(DTT)、牛血清蛋白標準購于廣州市齊云生物技術有限公司;其他化學試劑均為分析純。CO2氣體純度為99.9%,購于湛江氧氣廠。
儀器與設備:HA221-50-10-C型超臨界裝置(南通市華安超臨界萃取有限公司);UX2200H電子天平(日本島津儀器有限公司);UV-2550紫外可見分光光度計(日本島津);PHS-3C型精密pH計(上海雷磁儀器廠);CR22GⅡ型高速冷凍離心機(日本日立公司);HH-8數顯恒溫水浴箱(常州澳華儀器有限公司);RF-5301PC熒光分光光度計(日本島津儀器有限公司);5417R冷凍離心機(德國Eppendorf公司)。
1.3試驗方法
1.3.1肌球蛋白的提取參照Stafford等[10]的方法,將鮮活的凡納濱蝦對蝦去頭去尾去腸線,肌肉切碎后置于絞肉機中攪碎。稱取一定量的蝦肉,加入5倍20 mmol/L PBS緩沖液(pH 7.0),均質后離心(5 500 g,10 min),取沉淀再重復上述過程2次。向所得沉淀中加入2倍提取液(0.45 mol/L KCl,5 mmol/L ATP,7.5 mmol/L MgCl2,0.15 mmol/L DTT,pH 6.4)攪拌15 min后離心(10 000 g,10 min)。4層紗布過濾后,取濾液與9倍體積的預冷蒸餾水混合靜置10 min,離心(6 000 g,10 min)得沉淀,加入1/5倍3 mol/L KCl-0.6 mmol/L DTT-0.12 mol/L Tri-Maleate緩沖液(pH 7.5),于4℃靜置12 h,加入1/10倍0.11 mol/L ATP-55 mmol/L MgCl2-5.5 mmol/L EGTA溶液(pH 7.5)后,于4℃靜置12 h,加硫酸銨飽和溶液,采用硫酸銨飽和度為40%~45%來分離純化肌球蛋白。離心后取沉淀于0.6 mol/L KCl-0.1 mmol/L DTT-20 mmol/L PBS(pH 7.0)緩沖液中透析至無SO42-檢出,期間更換透析液。取透析后的溶液于100 000 g轉速下超速離心1 h后所得溶液即為肌球蛋白溶液。以上操作均在4℃條件下進行,所用緩沖液需先預冷至4℃。
1.3.2高密度CO2處理將質量濃度為1.0 mg/mL肌球蛋白溶液,分別取5 mL于10 mL試管中,瓶口覆蓋一層透氣性好的有機濾膜(防止蛋白質在處理過程中隨二氧化碳氣體流失)。間歇式DPCD處理基本流程參考文獻[11],具體如下:實驗開始時,首先打開制冷及冷卻循環,設置處理釜所需溫度,將樣品放入處理釜中,密封,開啟高壓泵泵入CO2氣體,待壓力上升至所需壓力,關閉高壓泵,封閉處理釜進出口的閥門,維持處理釜內的壓力和溫度,靜態處理一段時間后,卸壓并取出樣品,完成一次處理,再進行下一步分析。壓力和溫度的精確度分別是±0.4 MPa和±0.5 ℃。
設定DPCD處理的因素和水平。壓力處理:固定溫度60 ℃,時間30 min,設置壓力水平為5、10、15、20、25、30 MPa;溫度處理:固定時間30 min,壓力15 MPa,設置溫度水平為50、55、60、65、70 ℃;時間處理:固定溫度60 ℃,壓力15 MPa,設置時間水平為10、20、30、40、50 min。
1.3.3表面疏水性測定以8-苯胺基-1-萘磺酸銨(ANS)為熒光探針法[12]。根據已測得的蛋白含量,將可溶性蛋白在0.01~0.5 mg/mL范圍內稀釋成一定梯度。取各不同濃度溶液2 mL,加入20 μL 10 mmol/L ANS-20 mmol/L PB 緩沖液(pH 7.0),混勻,靜置10 min后測其熒光強度。采用Gemini EM -KAD熒光酶標儀在374 nm的激發波長和485 nm的發射波長下測定。以不加ANS的樣品溶液為空白對照。以蛋白質濃度為橫坐標,熒光強度為縱坐標作圖,曲線的初始斜率即為蛋白分子的表面疏水性。
1.3.4酪氨酸內源熒光測定將蛋白質濃度稀釋為0.05 mg/mL。采用Gemini EM-KAD熒光酶標儀在激發波長為280 nm條件下,以1 nm/s的掃描速度記錄各條件下肌球蛋白在300~400 nm之間的發射圖譜,取熒光掃描圖譜中的峰值為該條件下熒光強度。以含有0.6 mol/L KCl的緩沖溶液為空白對照。
1.3.5數據處理每個試驗重復3次,數據用“平均值±標準差”表示。數據處理用JMP7.0軟件進行方差分析(ANOVA)和Tukey’s HSD法多重比較。
2 結果與分析
2.1DPCD處理壓力對肌球蛋白疏水性的影響
蛋白質是由一定氨基酸順序卷曲成特定的空間結構,多數構成蛋白質的非極性氨基酸側鏈分布在分子內部形成疏水內核,而極性氨基酸分布在表面的親水環境中。用ANS探針法能夠較準確的反應蛋白質的表面疏水性變化[13]。蛋白質的內源熒光主要是含有芳香族氨基酸的色氨酸、酪氨酸和苯丙氨酸在激發光下產生熒光,其熒光光譜圖對環境極為敏感。在蛋白質結構研究中,通常用色氨酸和酪氨酸作為內源探針來檢測其微環境的變化,來間接判斷蛋白質三級結構的構象變化。酪氨酸是非極性氨基酸,其熒光強度的增強或減弱,代表了內部疏水區域中酪氨酸殘基的暴露狀況,以及蛋白質結構的松散程度[14]。
從圖1可見,與未處理的肌球蛋白相比,DCPD處理可以使肌球蛋白分子的表面疏水性顯著增加(P< 0.05),而且隨著處理壓力的增加,肌球蛋白分子表面疏水性也顯著增大(P < 0.05)。壓力在0~10 MPa范圍時,肌球蛋白分子表面疏水性顯著增加(P < 0.05);壓力在10~25 MPa范圍變化時,肌球蛋白分子表面疏水性變化不顯著(P > 0.05);壓力超過30 MPa時,肌球蛋白分子表面疏水性又顯著增加(P <0.05)。
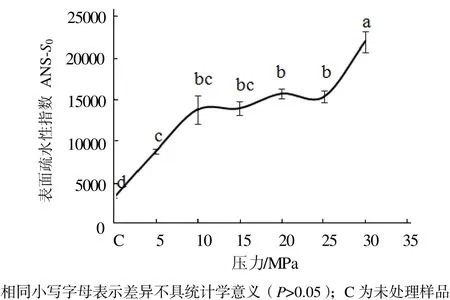
圖1 壓力對肌球蛋白表面疏水性指數的影響Fig.1 Effect of pressure on the surface hydrophobicity of myosin proteins
從圖2可見,與未處理的肌球蛋白相比,DPCD處理可以使肌球蛋白的酪氨酸內源熒光值顯著增加(P < 0.05),而且隨著處理壓力的增加,肌球蛋白的酪氨酸內源熒光值也顯著增加(P < 0.05)。壓力在0~5 MPa范圍內,酪氨酸熒光值增加顯著(P < 0.05);壓力在5~10 MPa范圍內,酪氨酸熒光值變化不顯著(P > 0.05);壓力在10~30 MPa范圍內,酪氨酸熒光值變化顯著(P < 0.05)。何軒輝[15]認為蛋白質受不同壓力的影響時,酪氨酸內源熒光值的變化反應了蛋白質結構疏松與緊促之間的相互轉化。因此,肌球蛋白分子經過DPCD處理后,其酪氨酸內源熒光值增加,可能是肌球蛋白分子逐漸由緊促向疏松發生轉變。
出現圖1和圖2的現象,可能是因為當壓力在0~10 MPa范圍內時,CO2由氣態逐漸向超臨界狀態轉變,其理化性質(如密度等)發生顯著變化[16],使其CO2與肌球蛋白發生強烈相互作用,從而暴露出較多的疏水基團,高級結構發生松散;當壓力在10~25 MPa范圍內時,CO2均維持在超臨界狀態,其理化性質的變化可能不明顯,從而使CO2與肌球蛋白的相互作用并無顯著變化,疏水基團和高級結構處于一定的水平。曹瑩瑩等在研究高壓處理肌球蛋白時也發現肌球蛋白分子表面疏水性隨壓力的增加而增加[17]。

圖2 壓力對肌球蛋白酪氨酸內源熒光值的影響Fig.2 Effect of pressure on the intrinsic tyrosine fluorescence of myosin proteins
2.2DPCD處理溫度對肌球蛋白疏水性的影響
從圖3可見,與未處理的肌球蛋白相比,DPCD處理和水浴熱處理都能使肌球蛋白的表面疏水性顯著增加(P < 0.05),而且在相同溫度下DPCD處理組的表面疏水性均顯著高于水浴熱處理組(P < 0.05)。從圖4可見,與未處理的肌球蛋白相比,DPCD處理和水浴熱處理均能使肌球蛋白分子的酪氨酸內源熒光值顯著增加(P < 0.05),而且在相同溫度下DPCD處理組的酪氨酸內源熒光值要顯著大于水浴熱處理組的(P < 0.05)。
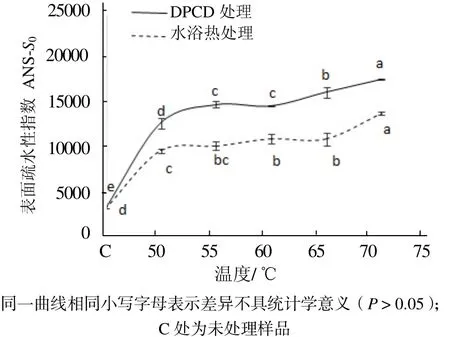
圖3 溫度對肌球蛋白表面疏水性指數的影響Fig.3 Effect of temperature on the surface hydrophobicity of myosin proteins
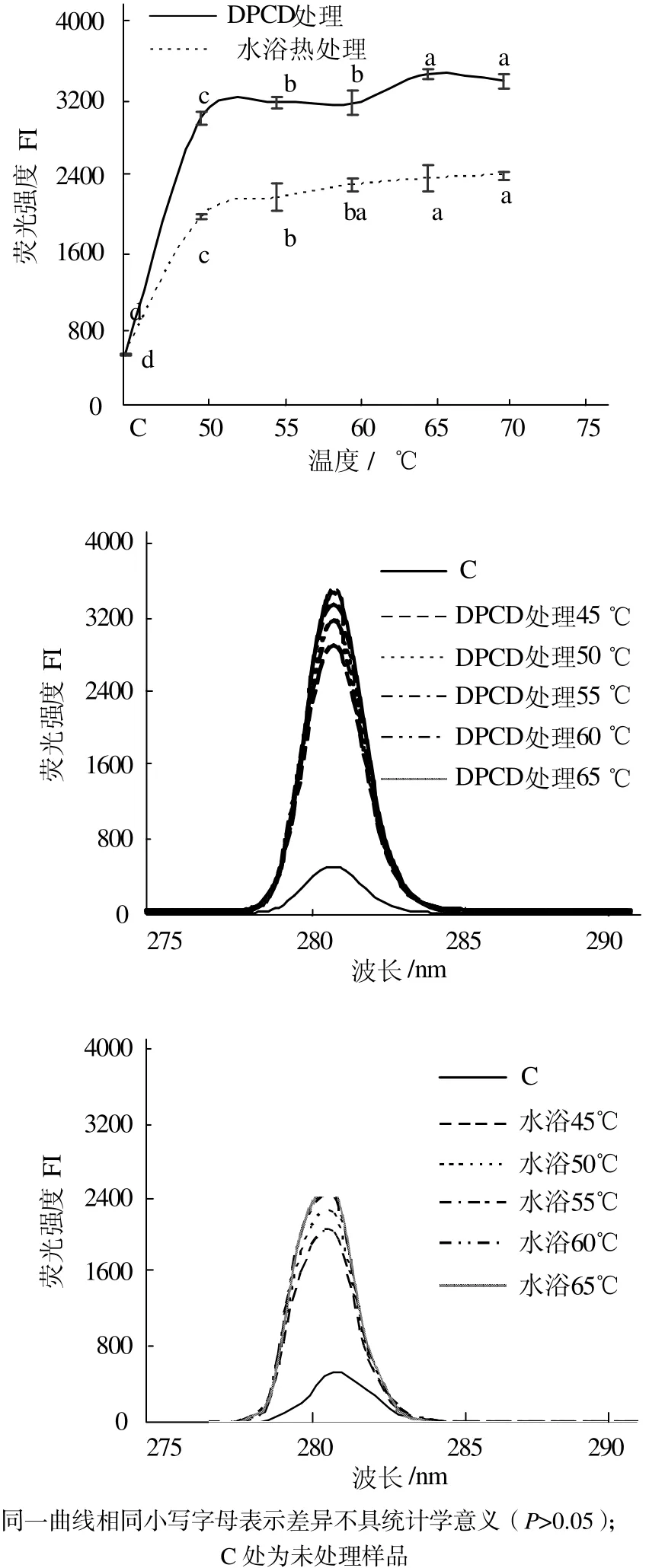
圖4 溫度對肌球蛋白酪氨酸內源熒光值的影響Fig.4 Effect of temperature on the intrinsic tyrosine fluorescence of myosin proteins
由圖3和圖4可知,在50~70 ℃范圍內DPCD處理和水浴熱處理都能使肌球蛋白發生變性,疏水基團暴露,但是DPCD處理組使肌球蛋白的變性程度更大,疏水基團暴露更多。這可能是因為在DPCD處理過程中除了熱效應使肌球蛋白疏水基團暴露之外,還可能存在CO2的分子效應使肌球蛋白發生更大程度的變性,使其高級結構更加疏松。實驗結果與劉海梅[18]和吳燁[19]等研究熱處理對肌球蛋白表面疏水性影響的結果一致。在50~70 ℃范圍內,無論是DPCD處理還是水浴熱處理,肌球蛋白的表面疏水性和酪氨酸內源熒光值都隨著溫度升高而緩慢增加(P < 0.05),這可能是熱效應的結果。因為在15 MPa、50~70 ℃范圍內,CO2的理化性質變化比較小(例如從0.994 43 g/mL降到0.984 23 g/mL),所以肌球蛋白表面疏水性和酪氨酸內源熒光值的變化可能受熱效應的影響比較大,而受CO2分子效應的影響較小。
2.3DPCD處理時間對肌球蛋白疏水性的影響
從圖5可見,與未處理的肌球蛋白相比,DPCD處理和水浴熱處理10 min后都可以使肌球蛋白分子的表面疏水性顯著增加(P < 0.05);DPCD處理組在20~30 min內變化不顯著,在40 min時又顯著增高(P < 0.05),50~60 min變化不顯著(P > 0.05);水浴組在20~40 min內變化不顯著,直到加熱到50 min時才顯著增大(P < 0.05)。在相同處理時間下,DPCD處理的肌球蛋白分子的表面疏水性均顯著高于水浴熱處理組(P < 0.05)。
從圖6可見,與未處理的肌球蛋白相比,DPCD處理和水浴熱處理10 min后都可以使肌球蛋白分子的酪氨酸內源熒光值顯著增加(P < 0.05);在10~50 min范圍內肌球蛋白分子的酪氨酸內源熒光值都隨處理時間增加而增加(P < 0.05);在相同處理時間下,DPCD處理的肌球蛋白分子的酪氨酸內源熒光值都顯著高于水浴熱處理組(P < 0.05)。

圖5 處理時間對肌球蛋白表面疏水性指數的影響Fig.5 Effect of treatment time on the surface hydrophobicity of myosin proteins
由圖5和圖6可知,短時間的DPCD處理和水浴熱處理都能快速使肌球蛋白疏水基團發生暴露,疏水性增加,結構變得疏松,說明肌球蛋白對熱和DPCD都是比較敏感的。在固定溫度(60 ℃)和壓力(15 MPa)下,雖然CO2的理化性質是穩定的,但隨著處理時間增加,CO2與肌球蛋白分子接觸的機會更多,因此,肌球蛋白的疏水基團也會暴露增加,高級結構變得更加疏松。在相同處理時間下,與熱處理相比,DPCD處理使肌球蛋白的疏水基團暴露更多,高級結構變得更加疏松,說明肌球蛋白對DPCD更加敏感。
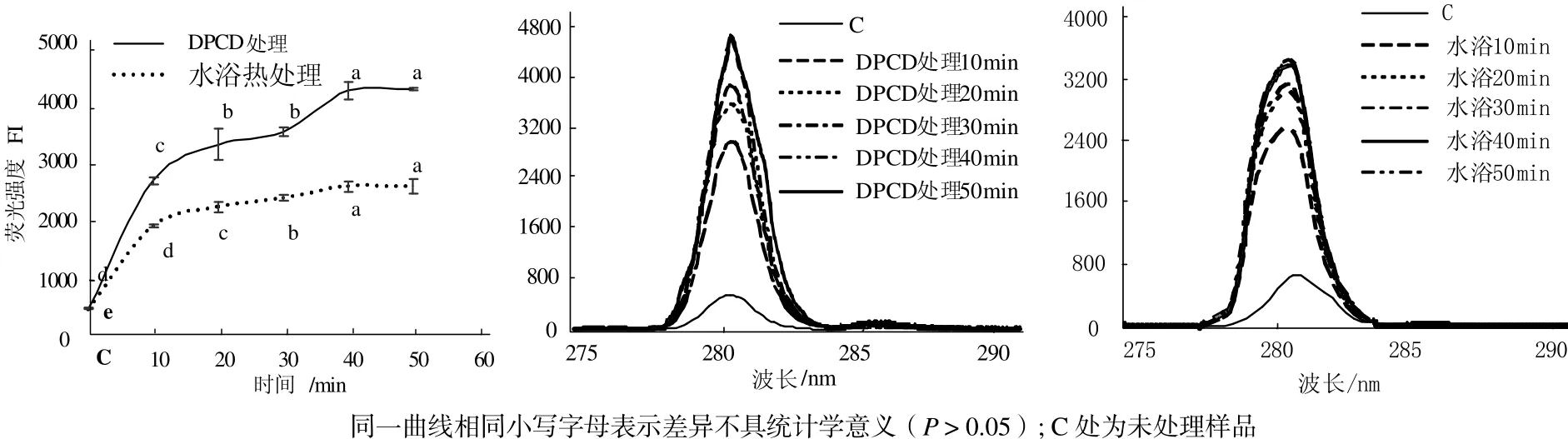
圖6 處理時間對肌球蛋白酪氨酸內源熒光值的影響Fig.6 Effect of treatment time on the intrinsic tyrosine fluorescence of myosin proteins
肌球蛋白的疏水基團主要集中在頭部,尾部含有7個疏水基團[20]。經過DPCD處理后,肌球蛋白的疏水性增加,這是因為:1)處理后的蛋白質結構變得松散,ANS分子更容易與蛋白質的疏水部位相互結合[21];2)巰基在轉化成二硫鍵的過程中,形成了具有高密度的氨基酸殘基的空間拓撲結構,被疏水氨基酸殘基包圍,形成局部疏水中心[22];3)肌球蛋白分子在受熱過程中,蛋白分子尾部的雙螺旋結構解開,更多的疏水性側鏈和殘基暴露出來,致使肌球蛋白分子表面疏水性增大[23];4)蛋白質在壓力、溫度和CO2的共同作用下構象發生了變化,形成一些芳香的疏水性氨基酸,從而使表面疏水性升高[14,24-25];(5)Leung,K等認為CO2是具有疏水性的,并認為疏水性是蛋白質與CO2相互作用的原因[26],但是Thomas R和Cundari Angela K等認為CO2被束縛在蛋白質內主要是靠酸性作用機制,酸性機制要大于疏水性作用[27]。
3 結論
DPCD處理能使凡納濱對蝦肌球蛋白疏水基團暴露,誘導肌球蛋白高級結構發生松散;與水浴熱處理相比,DPCD處理能使肌球蛋白暴露出更多的疏水基團,高級結構更加松散;隨著DPCD處理壓力和溫度的升高以及時間的延長,均能使肌球蛋白暴露出更多的疏水基團,高級結構更加松散。DPCD具有誘導凡納濱對蝦肌球蛋白變性和聚集形成凝膠的可能性。
參考文獻
[1]周光宏.畜產品加工學[M].北京:中國農業出版社,2002.
[2]SAMEJIMA K,ISHIOROSHI M,YASUI T.Relative roles of the head and tail Portions of the molecule in heat-induced gelation of myosin[J].Journal of food science,1981,46(5):1412-1418.
[3] WANG W,NEMA S,TEAGARDEN D.Protein aggregation—Pathways and influencing factors[J].International journal of pharmaceutics,2010,390(2):89-99.
[4]KRISTINSSON H G,HULTIN H O.Changes in trout hemoglobin conformations and solubility after exposure to acid and alkali pH[J].Journal of agricultural and food chemistry,2004,52(11):3633-3643.
[5]TANG C H,JIANG Y.Modulation of mechanical and surface hydrophobic properties of food protein films by transglutaminase treatment[J].Food research international,2007,40(4):504-509.
[6]廖小軍,胡小松.果蔬的“最少加工處理”及研究現狀[J].食品與發酵工業,1998,24(6):39-41.
[7]曲亞琳.高密度CO2誘導羊肉糜凝膠的形成因素及機理初探[D].北京:中國農業科學院,2010.
[8]屈小娟,劉書成,吉宏武,等.高密度CO2誘導制備蝦糜凝膠的特性[J].農業工程學報,2012,28(20):282-287.
[9]劉書成,張良,吉宏武,等.高密度CO2與熱處理對凡納濱對蝦肉品質的影響[J].水產學報,2013,37(10):1542-1550.
[10]HWANG G,WATABE S,HASHIMOTO K.Changes in carp myosin ATPase induced by temperature acclimation [J].Journal of comparative physiology B,1990,160(3):233-239.
[11]常耀光,李兆杰,薛長湖,等.超高壓處理對南美白對蝦在冷藏過程中貯藏特性的影響[J].農業工程學報,2008,24(12):230-237.
[12]KATO A,NAKAI S.Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins [J].Biochimica et biophysica acta(BBA)-Protein structure,1980,624(1):13-20.
[13]曾茂茂,王霄,陳潔.蛋白質疏水性測定方法的相關性及適用性[J].食品科學,2011,32(15):117-120.
[14]尹燕霞,向本瓊,佟麗.熒光光譜法在蛋白質研究中的應用[J].實驗技術與管理,2010,27(2):33-36,40.
[15]何軒輝.超高壓對花生分離蛋白凝膠特性的影響及其機理研究[D].北京:中國農業科學院,2013.
[16]Standard Reference Data Act.Thermophysical properties of fluid systems[EB/OL].[2015-10-08].http://webbook.nist.gov/chemistry/fluid/.
[17] 曹瑩瑩,張亮,王鵬,等.超高壓結合熱處理對肌球蛋白凝膠特性及蛋白二級結構的影響[J].肉類研究,2013,27(1):1-7.
[18]劉海梅.鰱魚糜凝膠及形成機理的研究[D].武漢:華中農業大學,2007.
[19]吳燁.兔肌球蛋白熱誘導凝膠化學作用力與凝膠結構功能關系的研究[D].南京:南京農業大學,2010.
[20]MORITA J I,YASUI T.Involvement of hydrophobic residues in heat-induced gelation of myosin tail subfragments from rabbit skeletal muscle [J].Agricultural and biological chemistry,1991,55(2):597-599.
[21]HUPPERTZ T,FOX P F,KELLY A L.High pressure treatment of bovine milk:effects on casein micelles and whey proteins [J].Journal of dairy research,2004,71(1):97-106.
[22]田悅,杜軍保.二硫鍵和巰基在蛋白質結構功能中的作用及分析方法[J].實用兒科臨床雜志,2007,22(19):1499-1501.
[23]RELKIN P.Reversibility of heat-induced conformational changes and surface exposed hydrophobic clusters of β-lactoglobulin:their role in heat-induced sol—gel state transition [J].International journal of biological macromolecules,1998,22(1):59-66.
[24]VISESSANGUAN W,OGAWA M,NAKAI S,et al.Physicochemical changes and mechanism of heat-induced gelation of arrowtooth flounder myosin[J].Journal of agricultural and food chemistry,2000,48(4):1016-1023.
[25]BUCKOW R,WEISS U,KNORR D.Inactivation kinetics of apple polyphenol oxidase in different pressure—temperature domains[J].Innovative food science & emerging technologies,2009,10(4):441-448.
[26]LEUNG K,NIELSEN I M B,KURTZ I.Ab initio molecular dynamics study of carbon dioxide and bicarbonate hydration and the nucleophilic attack of hydroxide on CO2[J].The journal of physical chemistry B,2007,111(17):4453-4459.
[27]CUNDARI T R,WILSON A K,DRUMMOND M L,et al.CO2-formatics:How do proteins bind carbon dioxide?[J].Journal of chemical information and modeling,2009,49(9):2111-2115.
(責任編輯:陳莊)
Effect of Dense Phase Carbon Dioxide on Hydrophobicity of Myosin Proteins from Litopenaeus vannamei
GUO Ming-hui,DENG Qian-lin,LIU Shu-cheng,DENG Chu-jin,JI Hong-wu,LI Cheng-yong,GAO Jing
(College of Food Science and Technology,Guangdong Ocean University//Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety//Key Laboratory of Advanced Processing of Aquatic Product of Guangdong Higher Education Institution,Zhanjiang 524088,China)
Abstract:This study investigated the effect of dense phase carbon dioxide(DPCD)on myosin gel formation induced by measuring the surface hydrophobicity and tyrosine intrinsic fluorescence spectrum of myosin in different conditions(pressure 5~30 MPa,temperature 50~70 ℃,time 10~50 min)with ANS probe and fluorescence scanning,respectively.The results indicated that DPCD treatment increased the surface hydrophobicity and the intrinsic fluorescence value of tyrosine significantly(P<0.05).Under the same temperature,the surface hydrophobicity and the intrinsic fluorescence value of tyrosine of myosin treated by DPCD were significantly higher than those of water bath heat-treatment(P<0.05).DPCD significantly enhanced the surface hydrophobicity and the intrinsic fluorescence value of myosin tyrosine with the increased pressure and temperature and the extension of time(P<0.05).These findings showed that DPCD could expose the hydrophobic group of myosin,which could loose the tight advanced structure.
Key words:Dense phase carbon dioxide; myosin; surface hydrophobicity; tyrosine
通信作者:劉書成(1977—),男,博士,教授,研究方向為食品非熱加工技術。
基金項目:國家自然科學基金資助項目(31371801);國家蝦產業產業技術體系專項基金(CARS-47)
收稿日期:2015-11-04
doi:10.3969/j.issn.1673-9159.2016.01.013
中圖分類號:TS254.4
文獻標志碼:A
文章編號:1673-9159(2015)06-0073-06
第一作者:郭明慧(1990—),女,在讀碩士,研究方向為食品非熱加工技術。

