豬TGFβR和TGFβ1基因多態性與產活仔數的關聯分析
徐夢思++黃濤++馬亮++王斌虎++劉麗娟++翟騰蛟++馬力鵬

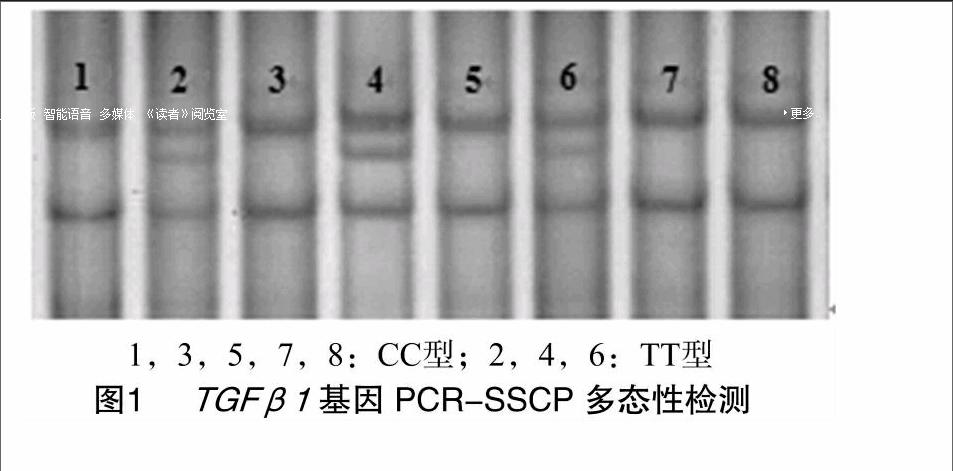
摘要:為探討豬轉化生長因子β1(TGFβ1)及其受體(TGFβRⅠ)基因多態性與大白豬和長白豬產活仔數的相關性。采用PCR-SSCP方法檢測了[WTBX][STBX]TGFβ1[WTBZ][STBZ]第6內含子和TGFβR[QX(Y15]Ⅰ[QX)]第7內含子中與豬繁殖力相關的2個突變位點在大白豬和長白豬(共計232頭)中的單核苷酸多態性,同時分析多態位點基因型與大白豬和長白豬產活仔數的關聯性。結果發現:[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因第7外顯子上游的第9位堿基存在C→T突變,在大白豬和長白豬中均檢出CC和TT 2種基因型,且不同基因型對2豬種產活仔數的影響差異不顯著(P>0.05);TGFβR[QX(Y15]Ⅰ[QX)]基因第7內含子第808位堿基存在A→G突變,在大白豬中檢出AA、AG、GG 3種基因型,長白豬中未檢出GG基因型,大白豬中GG型母豬產活仔數極顯著高于AA型(P<0.01),長白豬中,AA型和AG型產活仔數的影響差異不顯著(P>0.05)。研究結果表明,[WTBX][STBX]TGFβ1基因的突變位點對大白豬和長白豬的產活仔數沒有顯著影響,TGFβR[QX(Y15]Ⅰ[QX)]基因多態位點與母豬產活仔數顯著相關,可作為豬分子遺傳育種的候選基因,加快豬育種進程。
關鍵詞:豬;基因;TGFβR[QX(Y15]Ⅰ[QX)]基因;PCR-SSCP;產活仔數
中圖分類號: S828.2文獻標志碼: A
文章編號:1002-1302(2016)02-0038-04
收稿日期:2015-03-20
基金項目:國家自然科學基金(編號:30901014、31460586);留學回國人員科研啟動基金。
TGFβ1是轉化生長因子家族的重要成員之一,具有促進細胞生長、分化、遷移,參與免疫調節、細胞外間質形成、創傷愈合、組織修復、胚胎發育等生物學功能[1]。其受體TGFβRⅠ屬于絲氨酸/蘇氨酸激酶受體家族,在大多數細胞和組織中普遍表達,其胞內區具有絲氮酸/蘇氨酸激酶結構域,即GS區,具有激酶活性。在TGFβ/SMAD信號通路的信號轉導是由有活性的TGFβ1首先和TGFβRⅡ結合形成異源二聚體復合物,該異源二聚體能夠使TGFβRⅠGS區的絲氨酸和蘇氨酸磷酸化,激活TGFβRⅠ激酶,活化的TGFβRⅠ激酶再與下游的SMADs蛋白家族發生磷酸化,從而將配體信號跨膜轉導入細胞核中,進而引起一系列的生物學效應[2]。TGFβ1與其受體TGFβRⅠ直接參與下丘腦-垂體-卵巢軸的調控,在促進卵子成熟,黃體形成,及子宮內膜及滋養細胞的增殖與分化方面起著重要的作用[3]。
已有研究證實,TGFβ1與動物繁殖有著密切的關系,TGFβ1在卵巢細胞內的表達隨著動物物種、卵泡發育階段的不同而有所差異,但在多種動物卵泡發育階段都呈時空性表達[4];Wimmers 等通過 PCR-SSCP 檢測到皮特蘭豬、柏林小型豬,在TGFβ1第 5 外顯子的 798 堿基(AF461808)存在1個單核苷酸多態(SNP)[5];武艷萍等研究發現大白豬[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因多態性與產仔數間呈顯著關聯(P<0.05)[6];王嘉博發現[WTBX][STBX]TGFβ1[WTBZ][STBZ] 基因T4位點的 AA 型總產仔數最高,對母豬生產性狀的影響極顯著,對仔豬出生體質量及斷奶體質量影響不顯著[7]。李海晶等研究發現大白豬TGFβR[QX(Y15]Ⅰ[QX)]基因多態性與產仔數間呈顯著關聯(P<0.05)[8]。根據以上TGFβR[QX(Y15]Ⅰ[QX)]基因和[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因對繁殖的影響,本試驗以TGFβR[QX(Y15]Ⅰ[QX)]和[WTBX][STBX]TGFβ1[WTBZ][STBZ]作為候選基因進行研究,選取大白豬111頭,長白豬121頭為研究材料,采用PCR-SSCP技術,對豬[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因第6內含子和TGFβR[QX(Y15]Ⅰ[QX)]基因第7內含子進行多態性檢測,分析其多態性與豬產仔數之間的關聯性,為進一步提高豬繁殖性能,實現豬的遺傳改良提供理論依據。
1材料與方法
1.1試驗材料
本試驗選取健康無病的大白豬111頭和長白豬121頭,分別來自新疆科盛種豬場和新疆142團種豬場,用耳號鉗采集耳組織樣本0.1 g,置于70%乙醇溶液中,-80 ℃保存備用。
1.2試驗試劑
Taq MIX,購自CWBIO公司;DNA marker、DNA提取試劑盒、膠回收試劑盒,購自TIANGEN公司;pGEM-T Vector、T4 DNA連接酶,購自Promega公司;大腸桿菌DH5α感受態細胞,為石河子大學動物遺傳育種與繁殖實驗室保存。
1.3豬耳組織DNA的提取
取豬耳組織,用滅菌小剪刀充分剪碎,處理樣品過程中需注意剪刀的消毒,避免交叉污染。根據TIANGEN動物組織DNA提取試劑盒操作步驟提取豬耳組織基因組DNA。
1.4PCR-SSCP引物設計
根據已知的豬[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因第6內含子區的1 156 bp序列(序列:AJ621785中的第1 043位點)[6]和TGFβR[QX(Y15]Ⅰ[QX)]基因第7內含子區的1 259 bp序列中突變位點(序列:DQ519377中的第65 753位點)[8],利用Primer 50軟件設計擴增[WTBX][STBX]TGFβ1[WTBZ][STBZ]和TGFβR[QX(Y15]Ⅰ[QX)]的特異性上下游引物。引物由北京華大生物工程技術服務有限公司合成,引物序列(表1)。
1.5PCR擴增
以豬耳組織DNA為模板,使用Taq Mix試劑進行PCR擴增,PCR反應體系為20 μL:Mix 10 μL,上下游引物各0.8 μL(10 μmol/L),DNA 1 μL,補ddH2O 至總反應體系為20 μL。PCR反應條件:94 ℃預變性2 min;94 ℃變性30 s,退火30 s,72 ℃延伸30 s,共35個循環;72 ℃終延伸5 min;保存4 ℃。PCR產物經2.0%瓊脂糖凝膠電泳檢測。
1.6PCR-SSCP
根據PCR產物片段的大小,[WTBX][STBX]TGFβ1[WTBZ][STBZ]和TGFβR[QX(Y15]Ⅰ[QX)]基因分別使用10%和12%非變性聚丙烯酰胺凝膠進行檢測。取 3 μL 擴增條帶明亮單一、片段大小符合預期的PCR產物和 8 μL Loading buffer,瞬時離心混勻。PCR儀98 ℃變性 10 min 后迅速冰浴10 min,取10 μL變性后的PCR產物上樣。120 V穩壓電泳12 h,銀染顯帶,確定純合子和雜合子帶型,并拍照記錄。
1.7PCR產物的克隆測序
利用普通瓊脂糖回收試劑盒對PCR-SSCP檢測到的同一引物不同帶型的PCR產物進行回收,將純化產物與pGEM-T載體連接,連接體系為:2×Rapid Ligation buffer 5 μL,PCR 產物3 μL,pGEM-T Vector 1 μL,T4 DNA Ligase 1 μL,PCR儀中16 ℃連接過夜。然后將連接產物轉化到大腸桿菌DH5α感受態細胞,涂布平板,37 ℃過夜培養,挑選陽性菌落,37 ℃擴大培養8 h,將選取的陽性菌株送交北京華大生物工程技術服務有限公司測序。
1.8數據統計
根據PCR-SSCP銀染顯影帶型的顯示,統計計算等位基因的基因頻率和基因型頻率,利用SPSS 17.0軟件中的 One-way ANOVA方法進行方差分析,LSD法進行組間差異顯著性檢驗,分析[WTBX][STBX]TGFβ1[WTBZ][STBZ]和TGFβR[QX(Y15]Ⅰ[QX)]不同基因型與大白豬和長白豬產活仔數性狀的相關性,不同基因對應的產活仔數用平均值±標準差表示。
2結果與分析
2.1PCR-SSCP檢測結果
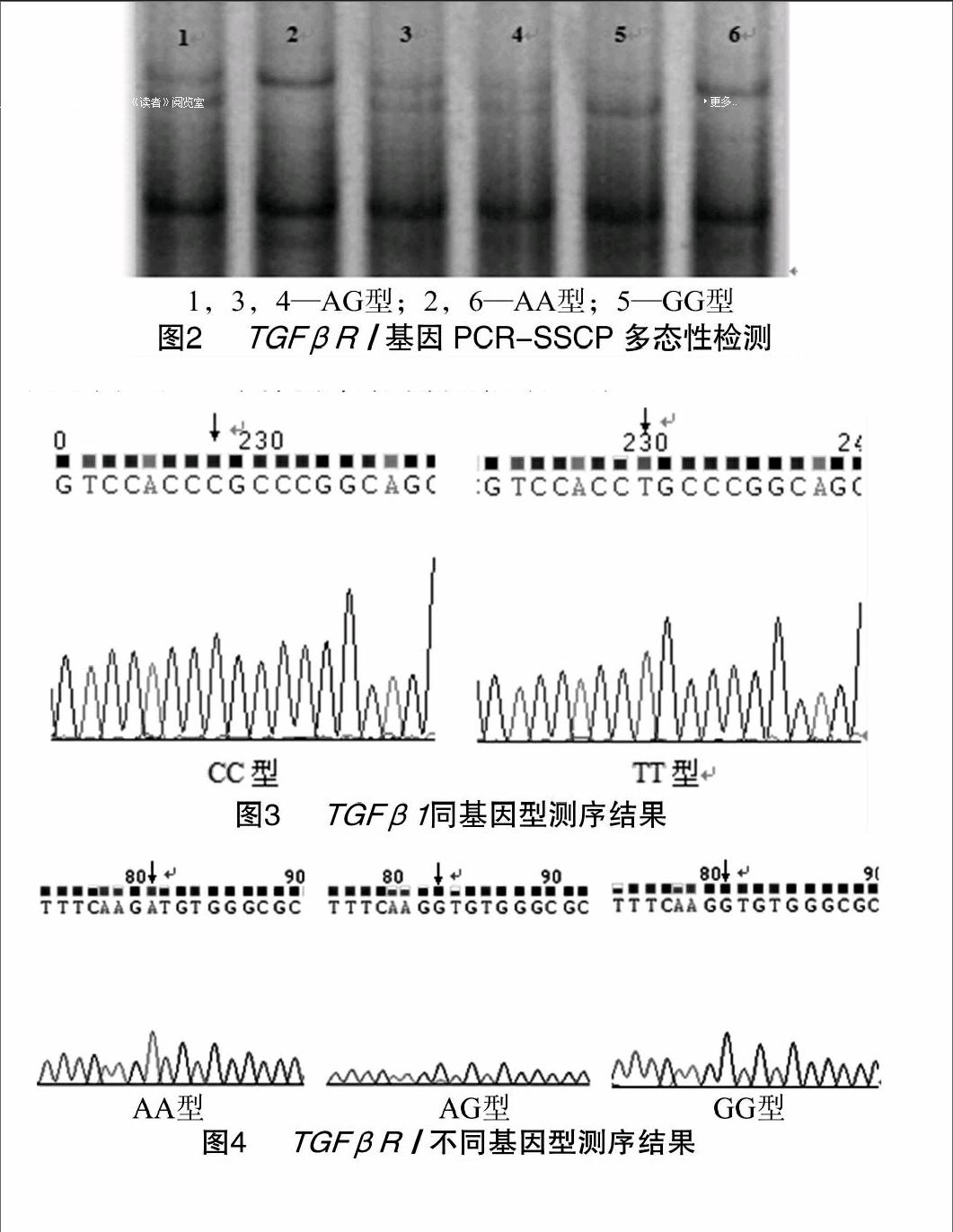
對豬耳組織DNA用[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因第6內含子和TGFβR[QX(Y15]Ⅰ[QX)]基因第7內含子特異性引物擴增,對擴增產物分別進行10%和12%非變性聚丙烯酰胺凝膠電泳檢測。在2個豬種[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因引物擴增片段均上發現1個突變位點,檢測到2種基因型,分別命名為CC型和TT型,結果見圖1;在2個豬種TGFβR[QX(Y15]Ⅰ[QX)]基因引物擴增片段上均發現1個突變位點,大白豬中檢測到3種基因型,長白豬中檢測到2種基因型,分別命名為AA型、AG型及GG型,結果見圖2。
2.2測序結果及分析
經SSCP分型后,將不同基因型個體的PCR產物用普通瓊脂糖膠回收試劑盒純化回收后連接pGEM-T載體,轉化大腸桿菌DH5α送樣測序。測序結果經DNAMAN和Chrimas軟件分析后,發現在[WTBX][STBX]TGFβ1[WTBZ][STBZ]引物擴增片段的第156堿基處發生了C→T突變,此突變位點位于[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因第7外顯子上游的第9位堿基(序列:AJ621785中的第1 043位點)。TGFβR[QX(Y15]Ⅰ[QX)]引物擴增片段的第112堿基處發生了A→G突變,此突變位點位于TGFβR[QX(Y15]Ⅰ[QX)]基因第7內含子第808位堿基(序列:DQ519377中的第65 753位點)。[WTBX][STBX]TGFβ1[WTBZ][STBZ] 和TGFβR[QX(Y15]Ⅰ[QX)]基因不同基因型個體測序結果分別見圖3、圖4。
2.3不同豬種[WTBX][STBX]TGFβ1[WTBZ][STBZ]和TGFβR[QX(Y15]Ⅰ[QX)]基因的等位基因和基因型頻率分析
對[WTBX][STBX]TGFβ1[WTBZ][STBZ]和TGFβR[QX(Y15]Ⅰ[QX)]基因在大白豬和長白豬中的基因頻率和基因型頻率進行統計(表2、表3),[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因在大白豬和長白豬中均檢測到CC、TT 2種基因型,未檢測到CT基因型,等位基因C占優勢。TGFβR[QX(Y15]Ⅰ[QX)]基因在大白豬中檢測到AA、AG、GG 3種基因型,等位基因A占優勢;在長白豬中檢測到AA、AG 2種基因型,未檢測到GG基因型,等位基因A占優勢。
2.4[WTBX][STBX]TGFβ1[WTBZ][STBZ]和TGFβR[QX(Y15]Ⅰ[QX)]不同基因型對豬產活仔數的影響
利用SPSS 17.0軟件對統計結果進行One-way ANOVA分析,LSD法進行組間差異顯著性檢驗,分析[WTBX][STBX]TGFβ1[WTBZ][STBZ]和TGFβR[QX(Y15]Ⅰ[QX)]各突變位點不同基因型與母豬產活仔數性狀的相關性,不同基因對應的產活仔數用平均值±標準差表示。結果(表4)顯示[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因在大白豬和長白豬中,CC型和TT型產活仔數之間均沒有顯著差異(P>0.05),產活仔數趨勢均為TT>CC。TGFβR[QX(Y15]Ⅰ[QX)]基因大白豬中,GG型和AG型產活仔數極顯著高于AA型(P<0.01),GG型產活仔數顯著高于AG型(P<0.05),產活仔數趨勢為GG>AG>AA;長白豬中,AA型和AG型產活仔數之間差異不顯著,產活仔數趨勢為AG>AA。
2.5[WTBX][STBX]TGFβ1[WTBZ][STBZ]和TGFβR[QX(Y15]Ⅰ[QX)]合并基因型對豬產活仔數的影響
將檢測出的[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因 C→T突變位點與TGFβR[QX(Y15]Ⅰ[QX)]基因A→G突變位點合并基因型,在檢測豬群中則存在CCAA、CCAG、CCGG、TTAA、TTAG和TTGG 6種合并基因型。以[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因和TGFβR[QX(Y15]Ⅰ[QX)]基因的合并基因型為參數對不同豬種產活仔數進行分析,大白豬群中TTGG合并基因型的產活仔數最高,為11.54頭/胎,平均比最低的CCAA合并基因型的產活仔數多1.81頭/胎。長白豬中4種合并基因型產活仔數的平均值之間相差較小(表5)。
3討論與結論
繁殖性狀是豬的重要經濟性狀之一,它的優劣不僅直接影響母豬的繁殖生產力,而且直接影響養豬生產的經濟效益[9-10]。近年來,轉化生長因子β超家族成員在動物繁殖中的作用被廣泛研究,TGFβ1和TGFβRⅠ作為轉化生長因子β超家族重要成員,它們在動物繁殖中的作用也受到越來越多的關注。
TGFβ1是一種具有多種生物學功能的細胞因子,在正常的組織、細胞和轉化細胞中均存在。TGFβ1可以通過調節基因表達來發揮維持機體正常生理過程和生命活動的重要作用。現已有研究表明TGFβ1在卵巢組織中高表達,與卵泡發育、顆粒細胞的增殖、分化和排卵有關[11]。TGFβ1參與顆粒細胞與膜細胞以及顆粒細胞與卵母細胞之間的雙向通話[12]。因而我們將[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因作為繁殖性狀的候選基因,參考武艷萍等、王嘉博發現的研究結果設計引物,[HJ1.4mm]利用單鏈構象多態性聚合酶鏈技術對該基因第6內含子多態性進行檢測,在第7外顯子上游的第9位堿基檢測出C→T突變,這與武艷萍等人的研究結果一致。對C→T突變進行分析發現,在大白豬和長白豬中導致出現TT、CC 2種基因型,且2個群體中均為C等位基因占優勢,T和C等位基因頻率相差較大,說明[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因C→T突變的等位基因頻率和群體遺傳特征在不同品種中較為一致。并對所檢測出的SNP位點的不同基因型與豬產活仔數進行了關聯性分析,大白和長白經產母豬的產活仔數均表現為TT>CC,在大白豬種中該位點TT型母豬的產活仔數比CC型多0.43頭/胎(P>0.05),在長白豬種中該位點TT型母豬的產活仔數比CC型多0.20頭/胎(P>0.05)。在這2個品種中T等位基因有利于提高母豬的產活仔數,這反映出[WTBX][STBX]TGFβ1[WTBZ][STBZ]基因可能與豬產活仔數性能密切相關,表明該位點的T基因可以作為豬高產活仔數的一個[HJ]遺傳標記。
TGFβRI在卵巢不同發育階段中均有表達,通過自分泌/旁分泌機制參與卵巢顆粒細胞增殖、卵母細胞成熟和類固醇生成,調節數種關鍵的顆粒細胞酶,對保持卵巢內的理想環境起著十分重要的作用[13]。目前國內外對豬TGFβR[QX(Y15]Ⅰ[QX)]基因多態性的報道還很少,本研究借鑒李海晶等的研究結果,設計引物,利用PCR-SSCP方法對該基因第7內含子進行多態性檢測,檢測1個SNP位點,即TGFβR[QX(Y15]Ⅰ[QX)]基因第7內含子第808位堿基(序列:DQ519377中的第65753位點)存在A→G突變,這與李海晶等的研究結果存在一定的差異,前人在TGFβR[QX(Y15]Ⅰ[QX)]基因第7內含子中檢測出2個SNP位點,并且就 A→G 突變,測序樣本中只出現了1種純合子和1種雜合子,本研究在大白豬群體中檢測出AA、AG、GG 3種基因型,而在長白豬群體中只檢測出AA、AG 2種基因型。這說明在群體中是存在GG基因型的,長白豬群體中未檢出可能是由于GG型出現的比率本身就較低,擴大樣本數量可能會檢測出。對A→G突變進行分析發現,在大白豬和長白豬2個群體中均為A等位基因占優勢,A和G等位基因頻率相差較大。分析不同基因型與豬產活仔數之間的關聯性,發現大白經產母豬產活仔數表現為GG>AG>AA,長白經產母豬產活仔數表現為AG>AA,大白豬中GG型比AG型和AA型母豬產活仔數分別高出1.83頭/胎和3.18頭/胎,GG型與AG型母豬產活仔數之間差異顯著(P<0.05),與AA型之間差異極顯著(P<0.01);而長白豬中AG型比AA型母豬產活仔數高出0.30頭/胎,差異不顯著(P>0.05)。在這2個品種中G等位基因有利于提高母豬的產活仔數,結合前人的研究結果可進一步證實TGFβR[QX(Y15]Ⅰ[QX)]基因多態性與豬產活仔數顯著相關,該基因可以用于豬分子遺傳育種的候選基因。
[HS2][HT8.5H]參考文獻:[HT8.SS][HJ1.7mm]
[1][ZK(#]Lastres P,Letamendía A,Zhang H,et al. Endoglin modulates cellular responses to TGFβ 1[J]. The Journal of Cell Biology,1996,133(5):1109-1121.
[2]Mulsant P,Lecerf F,Fabre S,et al. Mutation in bone morphogenetic protein receptor-IB is associated with increased ovulation rate in Booroola Mérino ewes[J]. Proceedings of the National Academy of Sciences of the United States of America,2001,98(9):5104-5109.

