不同外植體及激素組合對(duì)貼梗海棠愈傷組織誘導(dǎo)的影響
賈曉梅++周悅++曹柳青++黃璞璐


摘要:以當(dāng)年生幼嫩枝條、2~3年生枝條的葉片為試驗(yàn)材料,分別采用0.1%HgCl2溶液、2%NaClO溶液進(jìn)行消毒處理,運(yùn)用對(duì)比試驗(yàn)的方法進(jìn)行貼梗海棠愈傷組織的誘導(dǎo)研究,結(jié)果表明,誘導(dǎo)愈傷組織的最適外植體為葉片,最適培養(yǎng)基為MS+0.5 mg/L 6-BA+0.3 mg/L NAA。
關(guān)鍵詞:貼梗海棠;外植體;激素組合;愈傷組織;誘導(dǎo)
中圖分類號(hào): S685.990.4+3文獻(xiàn)標(biāo)志碼: A
文章編號(hào):1002-1302(2016)02-0054-02
收稿日期:2015-03-31
基金項(xiàng)目:河北省高等學(xué)校科學(xué)技術(shù)研究項(xiàng)目(編號(hào):Z2013008);保定學(xué)院本科教學(xué)工程建設(shè)項(xiàng)目(編號(hào):20120205、Xk20130601);保定學(xué)院科研基金(編號(hào):2012Z08);保定學(xué)院科研團(tuán)隊(duì)(編號(hào):KYTD2013001);河北省科技計(jì)劃(編號(hào):15227527)。
作者簡(jiǎn)介:賈曉梅(1978—),女,碩士,副教授,主要從事植物生理和生物技術(shù)研究。E-mail:jxmqiang@aliyun.com。
貼梗海棠[Chaenomeles speciosa(Sweet)Nakai]是薔薇科木瓜屬植物,為落葉灌木,耐旱、喜光、耐寒,抗逆性極強(qiáng)。其花色艷麗,氣味芳香,被廣泛應(yīng)用于城鄉(xiāng)綠化、庭院美化;其果實(shí)別稱皺皮木瓜,富含多種營(yíng)養(yǎng)成分[1],為常用中藥,可舒筋活絡(luò)、驅(qū)風(fēng)止痛[2];其葉片具有抗氧化和保肝功效[3]。可見(jiàn),貼梗海棠是一種具有多用途的優(yōu)良園林綠化植物。
貼梗海棠的繁殖多采用傳統(tǒng)的種子繁殖和無(wú)性繁殖(扦插、嫁接、壓條等)[4]。為提高貼梗海棠的品質(zhì),部分學(xué)者已對(duì)其育苗[5]、花期調(diào)控[6]、嫁接技術(shù)[7]、栽培管理[8]等方面進(jìn)行了研究;為突破繁殖材料的數(shù)量限制、加快推廣速度,部分學(xué)者已將組織培養(yǎng)技術(shù)應(yīng)用于貼梗海棠的快速繁殖[9-10],初步建立了快繁體系,但關(guān)于貼梗海棠愈傷組織培養(yǎng)的研究鮮有報(bào)道。通過(guò)研究不同外植體和激素組合對(duì)其愈傷組織誘導(dǎo)的影響,以期為貼梗海棠的遺傳轉(zhuǎn)化育種開(kāi)辟一條有效途徑,為該品種的開(kāi)發(fā)和推廣奠定技術(shù)基礎(chǔ)。
1材料與方法
1.1試驗(yàn)材料
試驗(yàn)材料由三禾苗圃提供,取貼梗海棠當(dāng)年生幼嫩枝條、2~3年生枝條的葉片為外植體。
1.2試驗(yàn)方法
1.2.1材料消毒將新生幼嫩枝條用加入少量皂粉的自來(lái)水浸泡30 min,再用自來(lái)水沖洗1.0~1.5 h,去除肉眼可見(jiàn)的灰塵及其他雜質(zhì)。在無(wú)菌操作臺(tái)內(nèi),將試驗(yàn)材料用75%乙醇消毒30 s后分為兩半,一半轉(zhuǎn)入0.1% HgCl2溶液中浸泡7~8 min,再用無(wú)菌水沖洗3~4次;另一半轉(zhuǎn)入2% NaClO溶液中浸泡15 min,再用無(wú)菌水沖洗3~4次。將消毒后的材料置于無(wú)菌濾紙上,吸干接種材料表面的多余水分。將葉片切成0.5 cm2的小塊,或在完整葉片上劃出網(wǎng)格狀傷口,嫩莖、幼芽的長(zhǎng)度均為0.5~1.0 cm,分別接種于誘導(dǎo)愈傷培養(yǎng)基上。每種外植體分別在各體積分?jǐn)?shù)梯度激素的培養(yǎng)基上接種10瓶,葉片每瓶接種4塊,莖段每瓶接種4段,幼芽每瓶接種3個(gè)。
1.2.2培養(yǎng)基以MS為基本培養(yǎng)基,附加不同種類激素體積分?jǐn)?shù)配比組成的9種培養(yǎng)基(表1)。培養(yǎng)基均附加蔗糖 30 g/L、瓊脂8 g/L,pH值為5.8,培養(yǎng)溫度為(25±2) ℃,光照度為2 000 lx,每天光照8 h。
2結(jié)果與分析
2.1不同消毒方法對(duì)污染率的影響
在對(duì)外植體的消毒過(guò)程中,分別選用2% NaClO溶液、0.1% HgCl2溶液進(jìn)行消毒處理。由表2可知,選用0.1% HgCl2溶液進(jìn)行浸泡消毒的外植體污染率遠(yuǎn)遠(yuǎn)低于選用2% NaClO溶液消毒的外植體,2% NaClO溶液處理后污染率均在10%及以上,而0.1% HgCl2溶液處理后消毒效果明顯改善,葉片、莖段、幼芽污染率分別為2.5%、2.5%、0。
2.2不同處理方式對(duì)誘愈結(jié)果的影響
由表3可知,在誘愈培養(yǎng)基上接種20 d后,通過(guò)誘導(dǎo)過(guò)程發(fā)現(xiàn)劃有網(wǎng)格狀傷口的全葉外植體出愈率(22%)遠(yuǎn)遠(yuǎn)低于切成小塊的葉片外植體(67%), 故將經(jīng)過(guò)處理的全葉外植
2.3不同激素組合對(duì)莖段愈傷組織的影響
莖段愈傷組織產(chǎn)生于兩端切面處,誘導(dǎo)初期質(zhì)地松軟、呈半透明乳白色。在誘愈培養(yǎng)基上接種20 d后,有84%莖段均誘導(dǎo)出愈傷組織,與葉片、嫩芽等外植體相比,莖段愈傷組織出現(xiàn)最早。將莖段產(chǎn)生的愈傷組織繼代轉(zhuǎn)接,均能增殖。培養(yǎng)20 d發(fā)現(xiàn)大部分培養(yǎng)基中增殖的愈傷組織與誘導(dǎo)初期一樣質(zhì)地松軟、沒(méi)有光澤,并隨培養(yǎng)時(shí)期的延長(zhǎng)而褐變死亡,僅3、5、9號(hào)培養(yǎng)基上的愈傷組織出現(xiàn)生長(zhǎng),其中9號(hào)培養(yǎng)基上的愈傷組織狀態(tài)最好,出現(xiàn)質(zhì)地松脆的綠色愈傷組織(表4)。
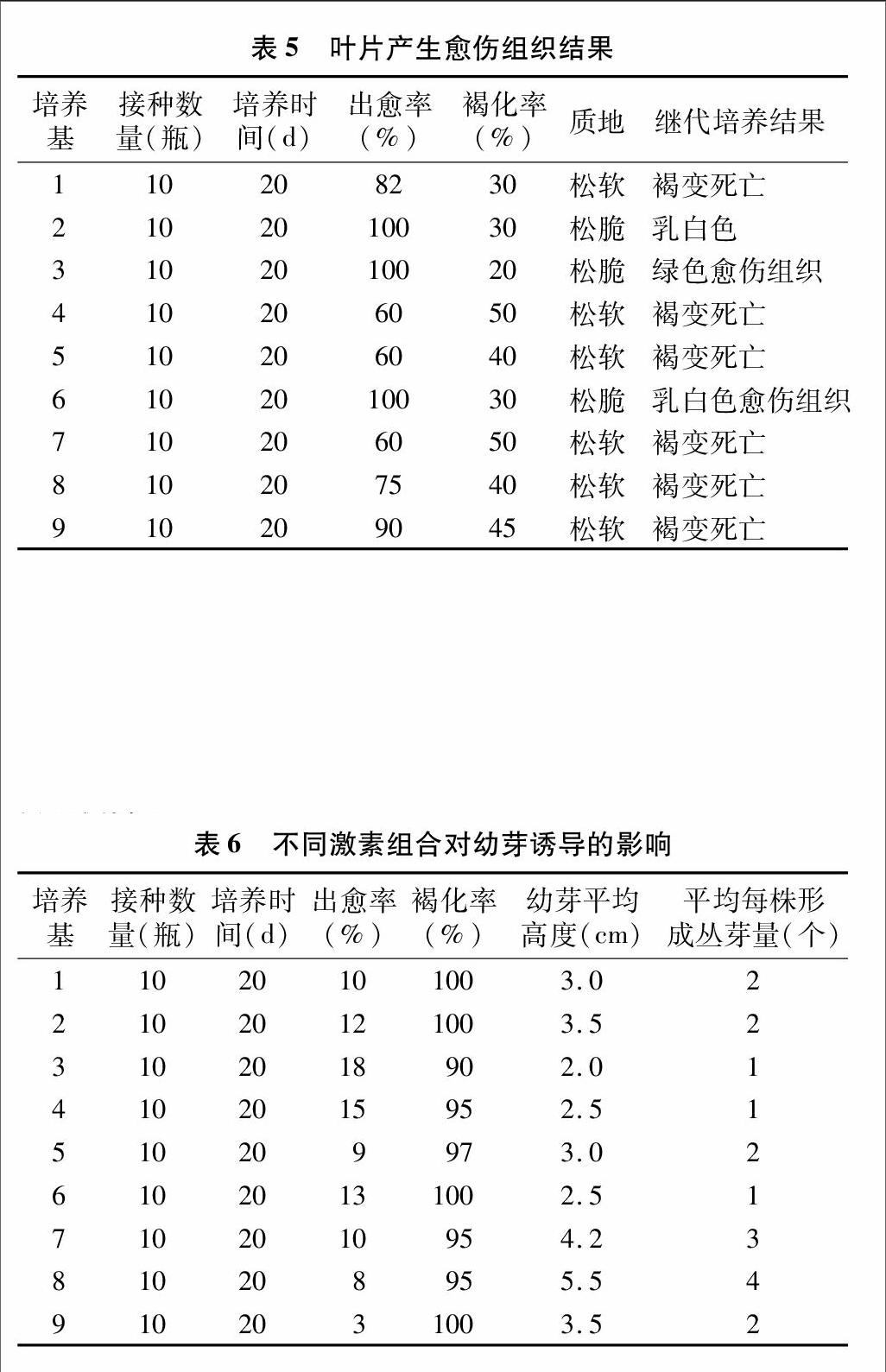
2.4不同激素組合對(duì)葉片愈傷組織的影響
葉片愈傷組織多發(fā)生于切面,少數(shù)愈傷組織由葉片表層細(xì)胞產(chǎn)生,多數(shù)呈乳白色,少數(shù)呈綠色。由表5可知,接種 20 d 后約80%葉片能誘導(dǎo)出愈傷組織,但4、5、7號(hào)培養(yǎng)基出愈率較低,僅為60%。在轉(zhuǎn)接愈傷組織繼代培養(yǎng)的過(guò)程中,2、3、6號(hào)培養(yǎng)基中愈傷組織的增殖能力遠(yuǎn)遠(yuǎn)高于其他培養(yǎng)基;其他培養(yǎng)基上的愈傷組織雖能增殖,但表現(xiàn)松、軟、過(guò)于散碎,并隨培養(yǎng)時(shí)間的延長(zhǎng)陸續(xù)褐變死亡。在3號(hào)培養(yǎng)基上誘導(dǎo)出的綠色愈傷組織與莖段、幼芽等外植體誘導(dǎo)出的狀態(tài)良好的愈傷組織相比質(zhì)地更松脆。
2.5不同激素組合對(duì)幼芽誘導(dǎo)的影響
在誘愈培養(yǎng)基上接種10 d左右,幼芽開(kāi)始伸長(zhǎng)生長(zhǎng);20 d后部分培養(yǎng)基中的幼芽平均可長(zhǎng)至3.3 cm。在誘導(dǎo)過(guò)程中幼芽基部長(zhǎng)出叢芽,而幼芽所誘導(dǎo)的愈傷組織多在叢芽部位,
其質(zhì)地松軟,轉(zhuǎn)接后增殖培養(yǎng),褐化率高達(dá)97%,短時(shí)期內(nèi)均褐變死亡。由表6可知,在幼芽誘導(dǎo)與繼代增殖的過(guò)程中,接種于8號(hào)培養(yǎng)基的幼芽生長(zhǎng)速度最為迅速,且形成的叢芽數(shù)量也多于其他培養(yǎng)基,與接種于其他培養(yǎng)基的幼芽相比具有明顯優(yōu)勢(shì)。
3結(jié)論
本試驗(yàn)選擇貼梗海棠的葉片、莖段、幼芽作為外植體,研究不同外植體及激素組合對(duì)貼梗海棠愈傷組織誘導(dǎo)的影響。結(jié)果表明,在選擇消毒劑時(shí),0.1% HgCl2溶液處理遠(yuǎn)遠(yuǎn)好于2% NaClO溶液處理;葉片進(jìn)行0.5 cm2的分割處理出愈率高于劃有網(wǎng)格狀傷口的全葉。在所有外植體愈傷組織的誘導(dǎo)和繼代增殖過(guò)程中,莖段、葉片、幼芽的愈傷組織出愈率分別為84%、80%、11%,而幼芽的褐化率最高(97%)、葉片最低(37%),且由葉片產(chǎn)生的綠色愈傷組織質(zhì)地更為松脆,增殖能力比莖段和幼芽產(chǎn)生的更強(qiáng)。由此確定誘導(dǎo)愈傷組織的最適外植體為葉片,最適培養(yǎng)基為MS+0.5 mg/L 6-BA+0.3 mg/L NAA。
[HS2*2][HT8.5H]參考文獻(xiàn):[HT8.SS]
[1][ZK(#]Mihova T,Blagov A,宋來(lái)慶. 貼梗海棠主要果實(shí)營(yíng)養(yǎng)成分分析[J]. 煙臺(tái)果樹(shù),2013(2):13-14.
[2]崔波,李服,馬杰. 鄭州植物志[M]. 北京:中國(guó)科學(xué)技術(shù)出版社,2008.
[3]孔祥密. 垂絲海棠和貼梗海棠抗氧化和保肝作用研究[D]. 開(kāi)封:河南大學(xué),2014.
[4]馬冬菁. 貼梗海棠培育技術(shù)研究進(jìn)展[J]. 防護(hù)林科技,2010(6):49-51.
[5][ZK(#]唐新華. 貼梗海棠育苗技術(shù)[J]. 林業(yè)實(shí)用技術(shù),2005(11):24-25.
[6]張秀省,黃勇. 貼梗海棠的栽培及花期調(diào)控技術(shù)[J]. 農(nóng)村實(shí)用工程技術(shù),2001(10):13.
[7]封丙軍. 貼梗海棠喬木化嫁接技術(shù)[J]. 農(nóng)村科技,2007(4):56-57.
[8]鄧運(yùn)川,沙剛. 貼梗海棠的栽培管理[J]. 中國(guó)花卉園藝,2010(14):34-35.
[9]陳罡,葉景豐,馬冬菁,等. 貼梗海棠組培快繁技術(shù)研究[J]. 北方園藝,2008(8):186-187.
[10][ZK(#]袁秀云,張仙云,馬杰. 貼梗海棠組培快繁技術(shù)研究[J]. 河南科學(xué),2009(2):175-177.

