活性碳源對蔬菜地土壤硝態氮及氮氧化物氣體的影響
楊程++劉秋香
摘要:室內25 ℃條件下,于存在硝態氮累積、50%田間持水量的設施蔬菜地土壤中,分別添加含碳(C)量為0、0.5、1.0、1.5 g/kg的活性碳源葡萄糖,分別標記為C0、C1、C2、C3,研究活性碳用量對土壤硝態氮及其氮氧化物氣體NO、N2O(含量均以氮計)的影響。結果表明,培養16 d,C0處理土壤銨態氮、硝態氮含量相對穩定,C1、C2、C3處理的土壤硝態氮含量均由初始870 mg/kg降至10 mg/kg以下,且葡萄糖用量越高,硝態氮下降越快;培養16 d后,C1、C2、C3處理的土壤銨態氮由初始30.8 mg/kg分別提高到302.0、33.9、62.5 mg/kg;葡萄糖添加顯著提高土壤NO、N2O的排放,C0處理土壤NO、N2O的累積產生量分別為3.80、0.04 mg/kg,C1、C2、C3處理NO、N2O的累積產生量則分別達到 4.0~11.7、3.3~62.4 mg/kg。添加活性碳源能有效降低設施蔬菜地土壤積累的硝態氮,但也應充分重視NO、N2O的排放。
關鍵詞:設施蔬菜;土壤;硝態氮;葡萄糖;NO;N2O;活性碳源
中圖分類號: S153文獻標志碼: A文章編號:1002-1302(2016)02-0378-04
收稿日期:2015-02-12
基金項目:江蘇省科技支撐計劃(編號:BE2014722)。
作者簡介:楊程(1983—),男,江蘇淮安人,碩士,工程師,從事土壤污染分析研究。Tel:(025)51816320;E-mail:yc384522@163.com。為追求設施蔬菜高產,菜農經常施用大量化肥,導致蔬菜地土壤硝態氮累積,不僅嚴重影響蔬菜產量和品質,也會引起一系列環境問題,如水體污染、刺激氮氧化物氣體排放等[1-4]。消除及控制蔬菜地土壤硝態氮含量,既可以減少土壤中積累的硝態氮對環境的污染,又可以緩解蔬菜地土壤的次生鹽漬化,是一個值得關注的問題。一般認為,土壤硝態氮的去除途徑主要有微生物對硝態氮的同化、異化還原成銨(DNRA)、反硝化或者淋溶等[5-10]。土壤硝態氮的反硝化和淋溶過程會造成氮素損失,產生危害環境的NO、N2O氣體[2,4],或進入地下水和地表水,造成水體硝態氮含量超標[1,3]等問題;微生物對硝態氮的同化可以將硝態氮轉化為有機氮,異化還原成銨可將硝態氮轉化為銨態氮,而與硝態氮相比,有機氮和銨態氮活動性較弱,易保存在土壤中供后季作物吸收利用。因此,促進設施蔬菜地土壤硝態氮的微生物同化和異化還原成銨可相應減少氮肥的施用,具有重要的現實意義。
有研究發現,添加有機物料能夠提高土壤活性有機碳含量,促進土壤微生物同化無機氮[11-12],外源活性碳的加入可能會使設施蔬菜地土壤硝態氮的含量降低。試驗采用室內培養方法,研究葡萄糖作為活性有機碳的加入對設施蔬菜地土壤累積硝態氮的影響,測定NO、N2O的排放,以期為合理有效利用蔬菜地土壤硝態氮提供理論依據。
1材料與方法
1.1供試土壤
試驗于2012年5月開始進行,供試土壤采自江蘇省宜興市周鐵鎮中心村(31°22′ N,119°57′ E)種植10年的蔬菜地,土壤類型為普通簡育水耕人為土。采樣時,隨機選取5個 1 m×1 m的樣方,將已種植的番茄割除,用土鉆進行采樣,每個樣方內采樣5~10次,采樣深度為0~20 cm;剔除土壤中的石塊和植物根系,將新鮮土壤混合均勻,過2 mm篩,裝于密封塑料袋中,4 ℃保存。供試土壤基本理化性質為:全碳含量 18.0 g/kg,全氮、NH+4、NO-3 含量(均以氮計,下同)分別為 3 040、30.8、876 mg/kg,容重為1.03 g/cm3,粉粒、沙粒、黏粒含量分別為84.2%、11.9%、4.0%,pH值為4.30,田間持水量(WHC)為62.3%。
1.2試驗設計
試驗設4個處理,以葡萄糖為活性碳源,分別添加含碳(以碳計)0、0.5、1.0、1.5 g/kg的葡萄糖,分別記為C0、C1、C2、C3處理,其中C0處理不施葡萄糖作為對照。每個處理重復3次。
1.3試驗方法
稱取相當于30 g烘干土質量的新鮮土樣于250 mL三角瓶中,按試驗設計添加葡萄糖,與土壤均勻混合;加入蒸餾水,調節土壤持水量至50%;用帶孔保鮮膜封住瓶口,25 ℃恒溫培養16 d,每2 d調節1次水分,保持土壤恒質量;培養1、2、3、5、8、11、16 d,每個處理分別隨機選取3瓶,以測定土壤NO、N2O、CO2氣體的產生速率,氣體采樣結束,分別加入 150 mL 濃度為2 mol/L的KCl溶液,25 ℃、250 r/min振蕩 1 h,定量濾紙過濾,測定土壤NH+4-N、NO-3-N含量。
1.4測定方法
1.4.1氣體產生速率測定氣體采樣時,去掉三角瓶保鮮膜,用周圍涂抹704硅膠的硅橡膠塞密封瓶口;在固定裝置上抽真空1 min,再充入室內空氣,重復3次;將采氣口用704膠密封,25 ℃恒溫培養室中培養3 h,再次采集氣體樣本;測定NO、N2O、CO2氣體產生量,N2O、CO2采用Shimadzu產 GC-14B 型島津氣相色譜儀測定,NO采用USA產Model 42i型氮氧化物測定儀測定。抽取氣樣前用注射器反復抽提瓶內氣體3次,以混勻氣體。
1.4.2含氮量測定提取液NH+4、NO-3含量用Skalarplus San流動分析儀測定;土壤pH值(水土比2.5 mL ∶1 g)采用南京Quark公司產DMP-2 mV/pH計測定;土壤有機碳含量用重鉻酸鉀容量法測定;土壤全氮含量用半微量凱氏定氮法測定;土壤粒徑采用美國產激光粒度分析儀測定。
1.5計算方法和統計分析
氣體N2O、NO、CO2產生速率的計算公式分別為:
VN2O=[ρ1×C1×Vg×273]/[W×(273+T)]×24/t;
VNO=[ρ2×C2×Vg×273]/[W×(273+T)]×24/t;
VCO2=[ρ3×C3×Vg×273]/[W×(273+T)]×24/t。
式中:VN2O、VNO分別為N2O、NO的產生速率,以氮計,μg/(kg·d);VCO2為CO2的產生速率,以碳計,mg/(kg·d);ρ1、ρ2、ρ3分別為標準狀態下N2O-N、NO-N、CO2-C的密度,分別為1.25、0.625、0.536 kg/m3;C1、C2分別為N2O、NO的氣體濃度,nmol/mol;C3為CO2的氣體濃度,μmol/mol;Vg為培養瓶上部有效空間體積,m3;W為烘干土質量,kg;T為測定氣體時的溫度,℃;t為取氣時間,h。
累積產生量為相鄰2次氣體產生速率的平均值與測定時間間隔乘積的累加值。
采用SPSS 13.0軟件進行方差分析(ANOVA);采用Duncans極差法進行差異顯著性檢驗;采用Spearmans Rank法進行相關性分析。
2結果與分析
2.1無機氮含量的變化
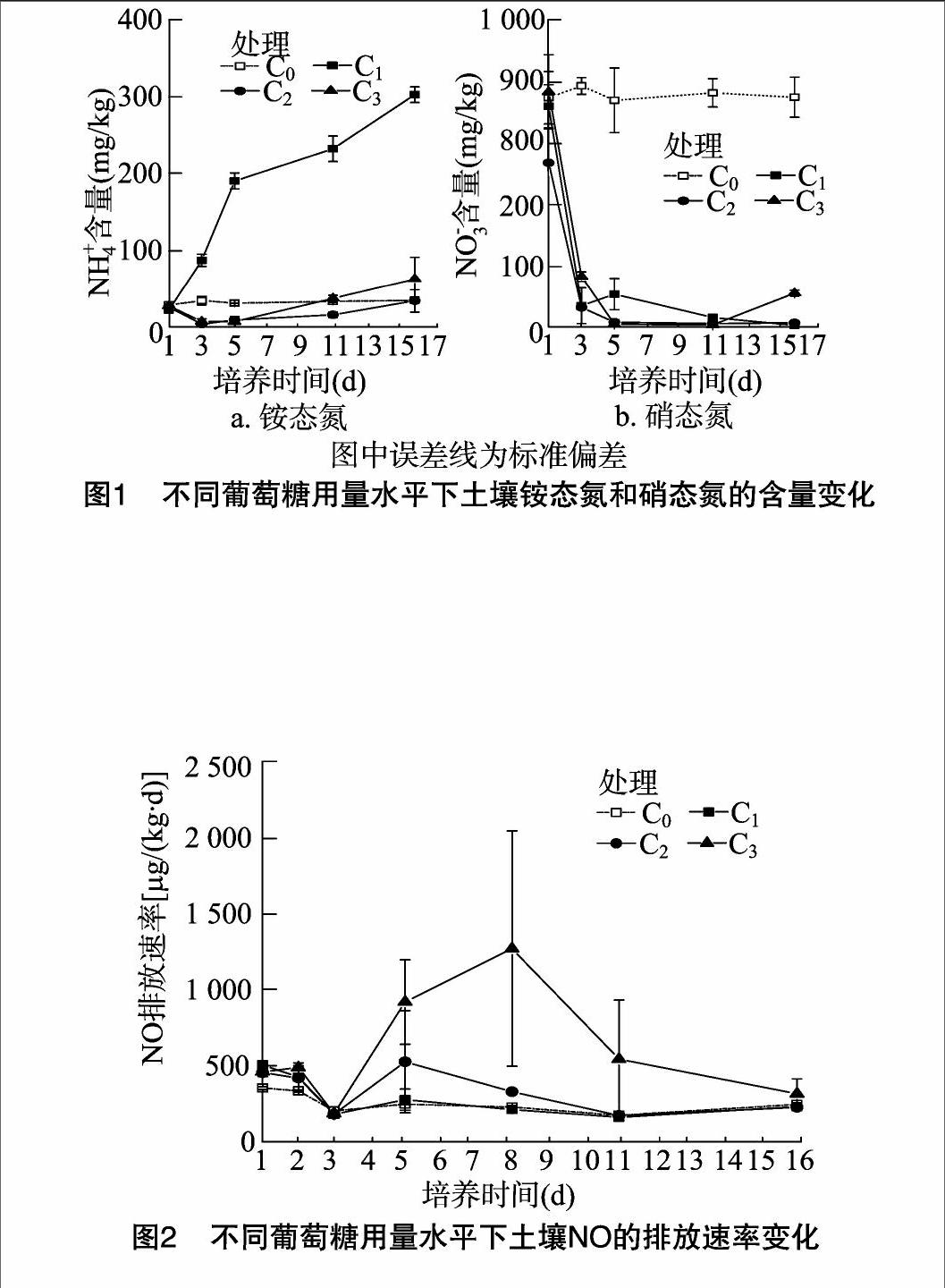
由圖1可見,使用葡萄糖可明顯使土壤中無機氮含量發生變化;整個培養過程中,C0處理土壤硝態氮含量相對穩定,約為870 mg/kg,銨態氮含量變化也相對平緩,介于30.8~34.5 mg/kg;添加葡萄糖處理的土壤硝態氮含量迅速降低,下降速度隨葡萄糖用量的不同而有較大差異;培養3 d,C1、C2、C3處理的土壤硝態氮含量均降至100 mg/kg以下,且隨培養時間的延長,C1、C2處理的土壤硝態氮含量持續降低,培養 16 d 時分別僅為2.52、6.44 mg/kg,而C3處理培養5~10 d,土壤硝態氮含量低于10 mg/kg,培養16 d時又升至 56.0 mg/kg;添加葡萄糖培養初期,土壤銨態氮含量降低,培養1 d,3個處理的銨態氮含量為22.0~27.3 mg/kg;隨培養時間的延長,C1處理土壤銨態氮含量持續升高,16 d時達到302 mg/kg,而C2、C3處理土壤銨態氮含量一直降低,至培養10 d時開始升高,培養16 d時分別達到33.9、62.5 mg/kg。
2.2對NO排放的影響
由圖2可見,土壤NO的排放速率因葡萄糖添加量不同而有較大差異;培養1 d,與C0處理NO排放速率354 μg/(kg·d)相比,添加葡萄糖促進了NO的排放,NO排放速率達到456~506 μg/(kg·d);隨培養時間延長,4個處理的NO排放量降低,培養3 d時排放量為最低;隨后,C0、C1處理的土壤NO排
放趨于平穩,而C2、C3處理NO排放增加,C2處理培養5 d時NO排放出現峰值,為527 μg/(kg·d),C3處理培養8 d時出現峰值,為1 271 μg/(kg·d);繼續培養,NO排放速率迅速降低,16 d時4個處理土壤NO的排放無明顯差異。
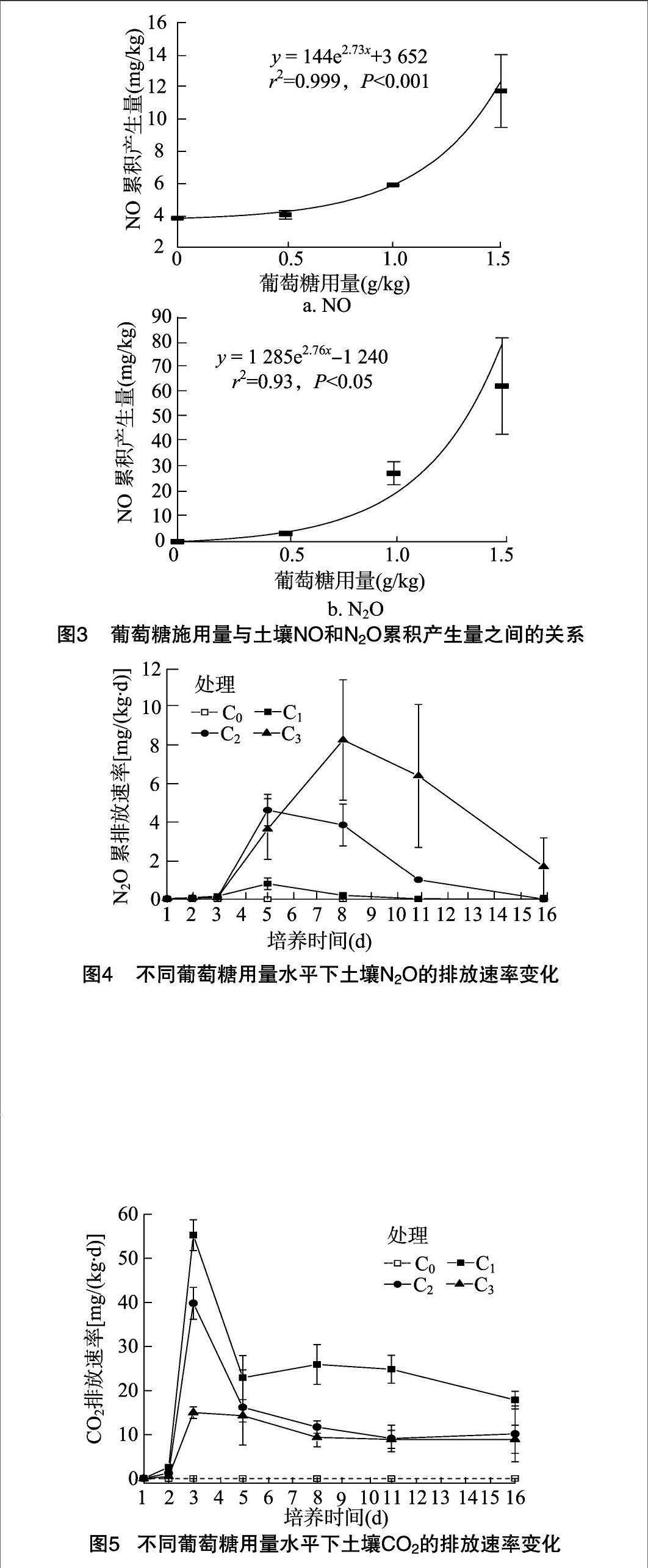
由圖3-a、表1可見,整個培養過程中,添加葡萄糖提高了設施蔬菜地土壤NO的累積產生量,C2、C3處理的土壤NO累積產生量分別為5.9、11.7 mg/kg,與C0處理的土壤NO累積產生量 3.8 mg/kg相比差異顯著(P<0.05);C1處理與對照差異不顯著;相關分析表明,土壤NO累積產生量與葡萄糖施用量呈極顯著的指數關系(P<0.001)。
2.3對N2O排放的影響
由圖4可見,整個培養過程中,添加葡萄糖處理的土壤N2O排放速率明顯高于對照;C0處理的土壤N2O排放速率峰值出現在培養1 d時,達到6.98 μg/(kg·d),之后逐漸減弱;添加葡萄糖處理的土壤N2O排放速率總體呈先升高后降低趨勢,C1、C2培養5 d時達到最大值,分別為806、4 660 μg/(kg·d),而C3處理培養8 d時出現峰值,為 8 317 μg/(kg·d);培養至16 d時,C3處理的土壤N2O排放速率仍高達1 707 μg/(kg·d),明顯高于其他3個處理。由圖3-b、表1可見,添加葡萄糖處理的土壤N2O累積產生量為3.3~62.4 mg/kg,顯著高于對照處理的0.04 mg/kg;3個添加葡萄糖處理的土壤N2O累積產生量,其相互間也達到顯著差異水平;相關分析表明,土壤N2O累積產生量與葡萄糖添加量呈顯著的指數關系(P<0.05)。
2.4對CO2排放的影響
由圖5可知,添加葡萄糖明顯促進了土壤CO2的排放;整個培養過程中,C0處理的土壤CO2 排放速率介于0.029~0.066 mg/(kg·d);培養3 d時,C1、C2、C3處理的土壤CO2排放速率出現峰值,分別達到55.3、39.8、15.0 mg/(kg·d),
之后迅速降低;培養5~16 d,變化相對平緩;培養16 d時,C1處理CO2排放速率為17.9 mg/(kg·d),仍明顯高于C2、C3處理。由表1可見,整個培養過程中,CO2累積排放量以C1處理最高,為365.9 mg/(kg·d),顯著高于C2、C3處理;C0處理CO2累積排放量相對最低,僅為0.7 mg/kg,與其他3個處理有顯著性差異。
3結論與討論
不添加葡萄糖的設施蔬菜地土壤培養16 d,其硝態氮含量相對穩定,而添加葡萄糖處理的土壤,其硝態氮含量由 870 mg/kg 降至10 mg/kg以下,這表明葡萄糖作為一種活性
表1培養16 d不同葡萄糖用量水平下土壤NO、N2O和CO2的
累積產生量
處理氣體累計產生量(mg/kg)NON2OCO2C03.8c0.04d0.7cC14.0c3.3c365.9aC25.9b27.4b198.9bC311.7a62.4a145.3b注:同列數據后不同小寫字母表示處理間差異顯著(P<0.05)。
碳源,能夠有效降低蔬菜地積累的硝態氮;分別添加含碳量0.5、1.0、1.5 g/kg活性碳源葡萄糖處理的土壤培養16 d時,硝態氮損失量分別為867、864、814 mg/kg,而整個培養過程中,以NO、N2O氣體形式損失的氮量分別為7.35、33.3、74.1 mg/kg,遠低于硝態氮的損失量,這表明氮氧化物氣體NO、N2O并不是硝態氮消耗的主要途徑。本試驗沒有直接測定加入葡萄糖后土壤微生物的生物氮和難溶性有機氮含量,但根據前人研究結論[7,13-14]可知,活性碳源的加入能顯著刺激微生物對硝態氮的同化,活性碳源的虧缺可能是蔬菜地土壤微生物活性的限制因子。實際農業生產中,設施蔬菜地土壤中加入綠肥如紫云英、黑麥草等物料,能夠提供微生物利用的活性碳源,這可能會提高微生物對硝態氮的同化作用而有效降低硝態氮含量。
添加葡萄糖處理的土壤培養16 d時,其銨態氮含量明顯提高,而本試驗葡萄糖的加入并沒有帶來外源氮,銨態氮的產生可能主要來自于土壤原有的有機氮礦化和硝態氮的異化還原。通過15N標記方法,加入0.5 g/kg(以碳計)葡萄糖和豐度為99.2%的NH415NO3于同一蔬菜地土壤,發現培養8 d時土壤銨態氮15N豐度升高至4.74%,這充分證明DNRA過程的發生。值得注意的是,培養16 d時,葡萄糖添加量較高的處理,其土壤銨態氮含量少于低濃度處理,這可能是由于高濃度葡萄糖處理時土壤的DNRA速率低于低濃度。Browning 等發現,碳源極豐富的培養基中,DNRA過程的關鍵功能基因nrf受到抑制[15]。因此,活性碳源葡萄糖施用量過大并不利于DNRA過程的發生。此外,試驗表明,施用高于0.5 g/kg的葡萄糖可使土壤CO2的排放降低,高碳輸入量很有可能導致土壤微生物“碳中毒”,而降低了微生物活性、抑制DNRA過程的發生。由于NO-3是DNRA過程發生的底物和影響因素[16],控制活性碳源的施用量,將硝態氮轉化為銨態氮,一方面可以減少蔬菜種植過程中氮肥施用量,另一方面可以減少氮素損失和環境污染[8]。
一般認為,土壤N2O、NO的排放主要來自硝化過程和反硝化過程[17-19],其發生強度主要受限于土壤O2 [17,20]、礦質氮[21-22]和有機碳[6,9]等。整個培養過程中,不添加葡萄糖處理的土壤,其硝態氮含量比較穩定,約為870 mg/kg,N2O產生速率一直低于NO,培養16 d時N2O累積產生量為 0.04 mg/kg,遠低于NO累積產生量3.8 mg/kg,這表明50%持水條件下,無碳源添加的蔬菜地土壤硝化過程主要是NO、N2O的產生過程[23]。添加葡萄糖提高了土壤NO、N2O的排放,葡萄糖加入量越大,NO、N2O的累積產生量越高,其產生量均與加入的葡萄糖量呈顯著的指數關系,而 NO/N2O 比例呈下降趨勢,這表明活性碳的加入刺激了土壤反硝化速率,反硝化變為NO、N2O的主要產生過程。這可能在于外源活性碳一方面刺激了土壤微生物活性,降低了土壤中O2供應,使土壤厭氧區域增大[20,24],另一方面增加了土壤中活性有機碳含量,提供了更多的電子供體[25],利于硝態氮的反硝化過程發生,從而提高了NO、N2O排放。由于NO、N2O在大氣光化學過程中起著重要的作用[26-27],且N2O是一種重要的溫室氣體[28],因此,在有效降低設施蔬菜地土壤硝態氮的過程中,應重視NO、N2O的排放。值得注意的是,除NO、N2O氣體外,反硝化過程產生的N2可能是活性碳有效降低土壤硝態氮含量的另外一個重要組分[19],為準確評估硝態氮的去向,N2產生量也應引起注意。
由于本試驗是在室內模擬條件下進行,且使用的是葡萄糖,大田原位條件下尋求一種合適的有機物料如綠肥,以降低蔬菜地積累的硝態氮及減少氮氧化物氣體排放值得進一步研究。
參考文獻:
[1]Ju X T,Kou C L,Zhang F S,et al. Nitrogen balance and groundwater nitrate contamination:comparison among three intensive cropping systems on the north China plain[J]. Environmental Pollution,2006,143(1):117-125.
[2]Xiong Z Q,Xie Y X,Xing G X,et al. Measurements of nitrous oxide emissions from vegetable production in China[J]. Atmospheric Environment,2006,40(12):2225-2234.
[3]Shi W M,Yao J,Yan F. Vegetable plantation under greenhouse conditions leads to rapid accumulation of nutrients,acidification and salinity of soils and groundwater contamination in South-Eastern China[J]. Nutrient Cycling in Agroecosystems,2009,83(1):73-84.
[4]He F F,Jiang R F,Chen Q,et al. Nitrous oxide emissions from an intensively managed greenhouse vegetable cropping system in northern China[J]. Environmental Pollution,2009,157(5):1666-1672.
[5]Shi W,Norton J M. Microbial control of nitrate concentrations in an agricultural soil treated with dairy waste compost or ammonium fertilizer[J]. Soil Biology and Biochemistry,2000,32(10):1453-1457.
[6]Miller M N,Zebarth B J,Dandie C E,et al. Crop residue influence on denitrification,N2O emissions and denitrifier community abundance in soil[J]. Soil Biology and Biochemistry,2008,40(10):2553-2562.
[7]Wan Y J,Ju X T,Ingwersen J,et al. Gross nitrogen transformations and related nitrous oxide emissions in an intensively used calcareous soil[J]. Soil Science Society of America Journal,2009,73(1):102-112.
[8]Tiedje J M,Sexstone A J,Myrold D D,et al. Denitrification:ecological niches,competition and survival[J]. Antonie Van Leeuwenhoek,1982,48(6):569-583.
[9]Weier K L,Doran J W,Power J F,et al. Denitrification and the dinitrogen/nitrous oxide ratio as affected by soil water,available carbon,and nitrate[J]. Soil Science Society of American Journal,1993,57:66-72.
[10]張乃明,李剛,蘇友波,等. 滇池流域大棚土壤硝酸鹽累積特征及其對環境的影響[J]. 農業工程學報,2006,22(6):215-217.
[11]Baggs E M,Rees R M,Smith K A,et al. Nitrous oxide emission from soils after incorporating crop residues[J]. Soil Use and Management,2000,16(2):82-87.
[12]Kaewpradit W,Toomsan B,Vityakon P,et al. Regulating mineral N release by mixing groundnut residues and rice straw under field conditions[J]. European Journal of Soil Science,2008,59(4):640-652.
[13]Recous S,Mary B,Faurie G. Microbial immobilization of ammonium and nitrate in cultivated soils[J]. Soil Biology and Biochemistry,1990,22(7):913-922.
[14]Christie P,Wasson E A. Short-term immobilization of ammonium and nitrate added to a grassland soil[J]. Soil Biology and Biochemistry,2001,33(9):1277-1278.
[15]Browning D F,Grainger D C,Beatty C M,et al. Integration of three signals at the Escherichia coli nrf promoter:a role for Fis protein in catabolite repression[J]. Molecular Microbiology,2005,57(2):496-510.
[16]Burgin A J,Hamilton S K. Have we overemphasized the role of denitrification in aquatic ecosystems? A review of nitrate removal pathways[J]. Frontiers in Ecology and the Environment,2007,5(2):89-96.
[17]Freney J R. Emission of nitrous oxide from soils used for agriculture[J]. Nutrient Cycling in Agroecosystems,1997,49(1/2/3):1-6.
[18]Bollmann A,Conrad R. Influence of O2 availability on NO and N2O release by nitrification and denitrification in soils[J]. Global Change Biology,1998,4(4):387-396.
[19]朱同彬,張金波,蔡祖聰. 淹水條件下添加有機物料對蔬菜地土壤硝態氮及氮素氣體排放的影響[J]. 應用生態學報,2012,23(1):109-114.
[20]Wolf I,Russow R. Different pathways of formation of N2O,N2 and NO in black earth soil[J]. Soil Biology and Biochemistry,2000,32(2):229-239.
[21]Blackmer A M,Bremner J M. Inhibitory effect of nitrate on reduction of N2O to N2 by soil microorganisms[J]. Soil Biology and Biochemistry,1978,10(3):187-191.
[22]Ryden J C. Denitrification loss from a grassland soil in the field receiving different rates of nitrogen as ammonium nitrate[J]. Journal of Soil Science,1983,34(2):355-365.
[23]Hayakawa A,Akiyama H,Sudo S,et al. N2O and NO emissions from an Andisol field as influenced by pelleted poultry manure[J]. Soil Biology & Biochemistry,2009,41(3):521-529.
[24]Bauhus J,Meyer A C,Brumme R. Effect of the inhibitors nitrapyrin and sodium chlorate on nitrification and N2O formation in an acid forest soil[J]. Biology and Fertility of Soils,1996,22(4):318-325.
[25]Beauchamp E G,Trevors J T,Paul J W. Carbon sources for bacterial denitrification[J]. Advances in Soil Science,1989,10:113-142.
[26]Williams E J,Hutchinson G L,Fehsenfeld F C. NOx and N2O emissions from soil[J]. Global Biogeochemical Cycles,1992,6(4):351-388.
[27]Rudolph J,Koschorreck M,Conrad R. Oxidative and reductive microbial consumption of nitric oxide in a heathland soil[J]. Soil Biology and Biochemistry,1996,28(10/11):1389-1396.
[28]Bouwman A F. Soils and greenhouse effect[M]. New York:Willey,1990:61-127.管冠,姚鋒先,劉桂東,等. 不同施肥年限對贛南臍橙果園土壤酶活性及微生物種群的影響[J]. 江蘇農業科學,2016,44(2):382-385.

