煙草青枯菌FQY_4宿主特異性候選基因分析
蔡劉體,陸 寧,沈子霞,石俊雄
(1.貴州省煙草科學研究院,貴州貴陽550081;2.貴州省煙草公司遵義縣公司,貴州遵義563003)
煙草青枯菌FQY_4宿主特異性候選基因分析
蔡劉體1,陸 寧1,沈子霞2,石俊雄1
(1.貴州省煙草科學研究院,貴州貴陽550081;2.貴州省煙草公司遵義縣公司,貴州遵義563003)
為青枯菌與煙草的相互作用研究提供宿主特性候選基因,在煙草青枯菌FQY_4基因組測序的基礎上,采用基因組及同源基因比較,分析青枯菌株系GMI1000、Po82、CFBP2957、CMR15、PSI07和FQY_4的核心基因及FQY_4宿主特異性候選基因。結果表明:FQY_4基因組中有632個宿主特異性候選基因,其中染色體、巨大質粒分別有365個和267個,包括跨膜蛋白、信號蛋白和細胞壁水解相關的基因,移動元件蛋白和許多未知功能的蛋白基因,以及宿主特異性候選三型分泌系統的42個效應蛋白因子(T3Es)。
煙草;青枯菌;青枯病;宿主;基因
青枯菌〔Ralstonia solanacearum(Pseudomonas solanacearum)〕是一種土傳性的細菌性病原菌,屬于革蘭氏陰性菌。青枯菌種性非常復雜[12],按照種系型(Phylotype)劃分框架及對應的地理起源信息,青枯菌可分為4個種系型:種系型Ⅰ和Ⅱ分別由亞洲和美國菌株組成,種系型Ⅲ的成員由非洲菌株組成,種系型Ⅳ包括來自印度尼西亞和澳大利亞的R.syzygii和BDB[23]。
青枯菌是一個復雜的種,遺傳多樣性豐富[45],青枯菌宿主眾多,包含50多個科中的200多種植物,其中包括重要的農作物烤煙、馬鈴薯、西紅柿、辣椒和香蕉等[67]。由青枯菌侵染導致的煙草青枯病是危害煙草的主要病害之一[8],在與宿主相互作用的長期進化中,形成了宿主適應性的一些特異性基因。
在病原菌-宿主相互作用的長期進化過程中,青枯菌復雜種獲得了一些宿主特異性基因。Genin[9]綜述了青枯菌株系適應植物寄主的分子特征,包括青枯菌適應宿主進化過程中獲得或丟失的三型分泌系統的效應蛋白因子。Guidot等[10]通過多宿主演化試驗研究了青枯菌適應植物宿主的相關基因,包括青枯菌在適應的宿主起作用的efpR基因,Ailloud等[11]通過基因組比較方法分析了宿主分別為香蕉和馬鈴薯青枯菌株系的宿主特異性候選基因。
隨著生物技術和測序技術的發展,近年來已經報道青枯菌多個株系的全基因組的測序,包括青枯菌株系GMI 1000[12]、Po 82[13]和CFBP 2957[14]等,這些青枯菌株系全基因組測序信息的解析和積累,有助于分析青枯菌復雜種中株系宿主的特異性基因,有助于青枯菌與其宿主相互作用的研究。為給青枯菌與煙草的相互作用研究提供宿主特性候選基因,在完成FQY_4基因組測序的基礎上,通過基因組比較分析了FQY_4基因組中宿主特異性候選基因。
1 材料與方法
1.1 材料
煙草青枯菌FQY_4,全基因組序列通過Hiseq 2 000高通量測序完成,FQY_4基因組在GenBank的登錄號分別是CP004012和CP004013[15]。其他青枯菌株系的種系型及基因組信息從GenBank數據庫中獲取(表1)。
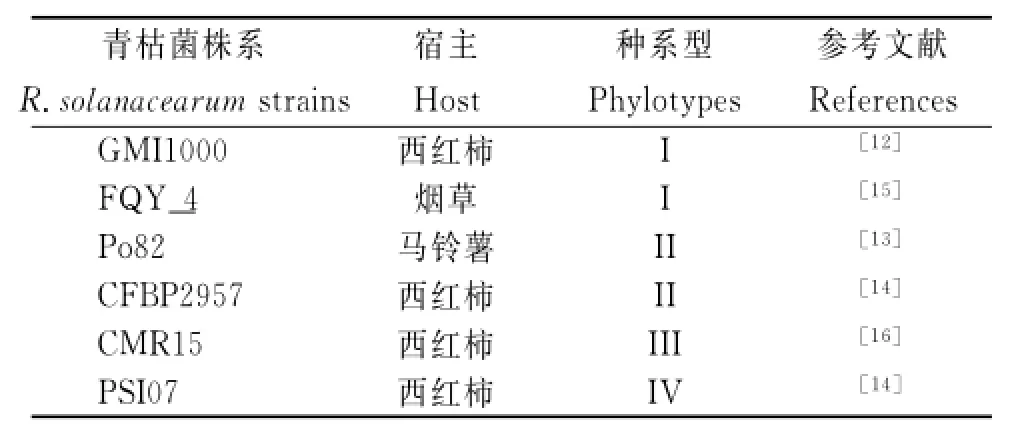
表1 青枯菌株系種系型及宿主信息Table1 The phylotypes and hosts information of R.solanacearumstrains
1.2 基因組比較分析
基因組比較及煙草青枯菌FQY_4基因組和巨大質粒上宿主特異性基因分析采用OMA algorithm和honology blast比較法;煙草青枯菌FQY_4三型分泌系統的宿主特異性效應蛋白因子分析采用ScanYourGenome(網址:http://iant.toulouse.inra.fr/T3E)和T3Es數據庫分析比對法。
2 結果與分析
2.1 FQY_4基因組染色體上宿主特異性候選基因
從圖1可看出,不同演化型的青枯菌6個株系具有核心基因2 932個,但是也有菌株自身特有的基因,特異性基因數目因青枯菌株系的不同而存在差異,其中菌株PSI07有自身特異性基因407個。這些特異性基因可能是在病原菌-宿主相互作用的長期進化過程中形成,也是宿主特異的候選基因。由表2可知,煙草青枯菌FQY_4染色體上具有365個宿主特異性候選基因,其中包括與青枯菌侵染宿主相關的跨膜蛋白、信號蛋白和細胞壁水解相關的酶,還有許多功能未知的蛋白。
2.2 FQY_4巨大質粒上宿主特異性候選基因
從圖2看出,5個青枯菌株系的巨大質粒共有的核心基因數有928個,特異性基因數目因青枯菌株系的不同有差異,煙草青枯菌FQY_4有自身特異性基因267個,與同是種系型I的GMI 1000株系的巨大質粒自身特有基因數目(261個)相差較小。由表3可知,煙草青枯菌FQY_4巨大質粒上宿主特異性候選基因包括與侵染宿主相關的多糖降解酶、效應蛋白因子及許多未知功能的蛋白。
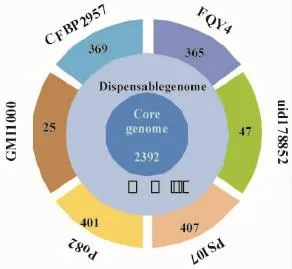
圖1 青枯菌株系(6個)染色體基因組核心基因Fig.1 The core genes on chromosome of six R.solanacearumstrains
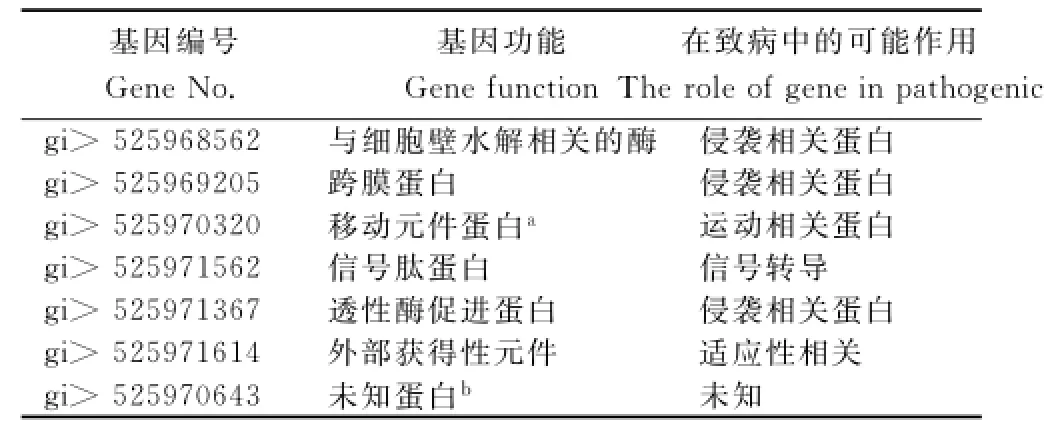
表2 部分青枯菌FQY_4基因組上部分宿主特異性候選基因信息Table2 Part of candidate genes on chromosome of FQY_4strains for host specificity
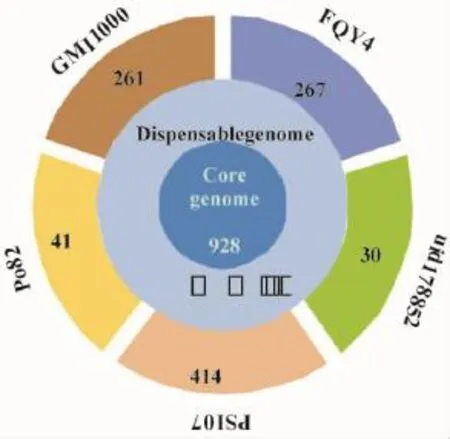
圖2 青枯菌株系(5個)巨大質粒基因組核心基因示意圖Fig.2 The core genes on huge plasmid of five R.solanacearumstrains
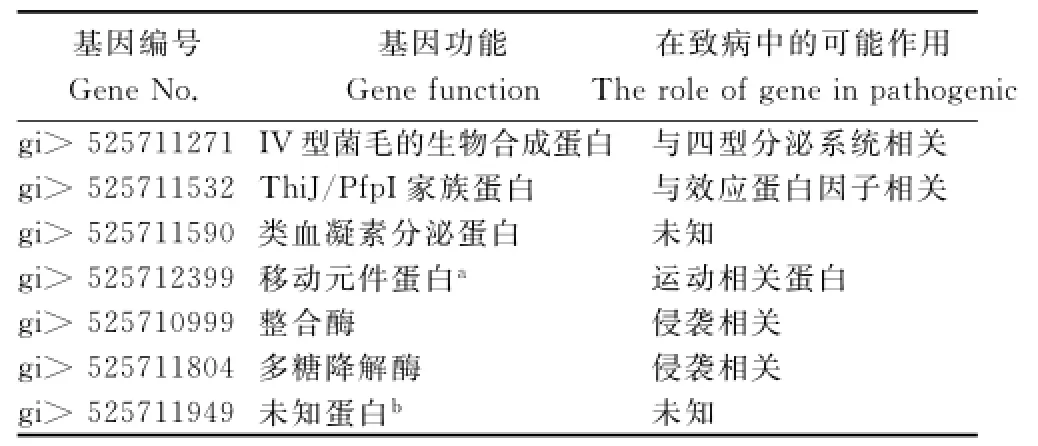
表3 部分青枯菌FQY_4巨大質粒上宿主特異性候選基因信息Table3 Part of candidate genes on huge plasmid of FQY_4strains for host specificity
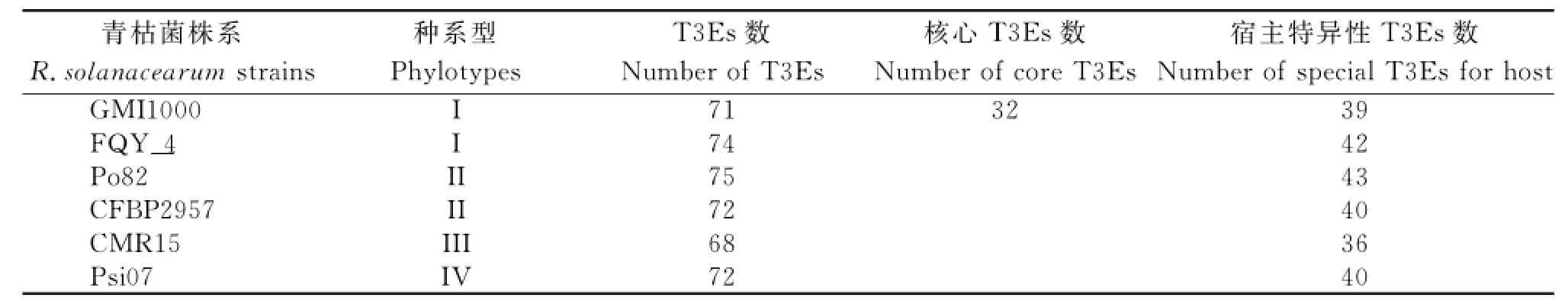
表4 青枯菌株系的T3Es數目比較Table4 The comparison of T3Es number in different R.solanacearumstrains

表5 煙草青枯菌FQY_4的宿主特異性候選T3Es信息Table5 The information of candidates T3Es in R.solanacearumFQY_4for host specificity
2.3 三型分泌系統中宿主特異性效應蛋白因子
青枯菌三型分泌系統中有豐富的效應蛋白因子(T3Es)[17],不同種系型的青枯菌株系有T3Es 60~90個,其中核心T3Es有32個[1718]。從表4可知,煙草青枯菌FQY_4有宿主特異性候選T3Es 42個。由表5可知,煙草青枯菌FQY_4的宿主名稱、位置信息和部分功能信息。從功能角度看,部分T3Es具有酶的功能,如乙酰轉移酶、泛素連接酶和果膠裂解酶等,由此推測較多的核心T3Es功能可能與青枯菌復雜種的進化過程有關,但大部分T3Es的功能尚有待于進一步研究驗證,尤其是其中的假基因拷貝是否有其他生物學功能或作用,目前仍不清楚。
3 結論與討論
試驗結果顯示,不同宿主的青枯菌株系的宿主特異性候選基因數有較大差異,FQY_4染色體上有632個候選基因(染色體上有365個,巨大質粒上有267個),而同是種系型I但宿主不同的GMI 1000株系宿主特異性候選基因為286個(染色體上25個,巨大質粒上261個);宿主同為西紅柿的青枯菌株系GMI 1000、CFBP 2957、CMR 15和PSI 07的宿主特異性候選基因數也有較大差異,說明青枯菌對其宿主有其自身一些分子特征[9]。
青枯菌的三型分泌系統(the type III secretion system,T3SS)及效應蛋白因子(effector proteins,T3Es)在青枯菌侵染致病過程中起重要作用[1921]。Genin等[20]預測青枯菌能產生70~80個T3Es,其對宿主的適應性有較大貢獻,Ailloud等[11]分析了青枯菌核心T3Es中的14個效應蛋白因子RipG5、RipB、RipW、RipAC、RipAB、RipR、RipE1、RipAM、RipAN、RipAY、RipAJ、RipF1、RipAI和PopC-like,說明在青枯菌復雜種與其宿主的相互作用中,可能出現了數百次效應蛋白因子的獲得和丟失事件。煙草青枯菌FQY_4宿主特異性候選效應蛋白因子是否在青枯菌與煙草相互作用的進化過程中出現獲得和丟失事件有待于進一步分析和研究。
青枯菌宿主特異性基因的確定及其在于宿主相互作用中所起的作用,需要更多的不同種系型、不同地里起源及不同最適宿主的青枯菌株系的全基因組信息和數據提供支持。另外,青枯菌中致病基因復雜網絡調控的機理及功能,在培養基中已經有大量的報道和闡述,但是在致病過程中,這些網絡調控在機理中的功能知之甚少[2223]。隨著越來越多不同種系型青枯菌株系測序的完成[2425]和青枯菌眾多致病因子及其調控途徑和網絡的闡明[2627],預計能更有效地獲得青枯菌這個復雜種中的核心基因和各自的宿主特異性基因,為青枯菌與其宿主相互作用的研究提供更多的基因信息。
[1]HAYWARD A C.Characteristics of Pseudomonas solanacearum[J].Journal of Applied Microbiology,1964,27(2):265-277.
[2]FEGAN M,PRIOR P.How complex is the Ralstonia solanacearumspecies complex[M]//ALLEN C,PRIOR P.Bacterial wilt disease anDThe Ralstonia solanacearumspecies complex.St.Paul,MN:American Phytopathological Society Press,2005:449-461.
[3]DENNY T P.Plant pathogenic Ralstonia species[M]//Gnanamanickam SS.Plant-Associated Bacteria.Dordrecht,The Netherlands:Springer Publishing,2006:573-644.
[4]HAYWARD A C.Biology and epidemiology of bacterial wilt caused by Pseudomonas solanacearum[J].Annual Review of Phytopathology,1991,29:65-87.
[5]GENIN S,DENNY T P.Pathogenomics of the Ralstonia solanacearumspecies complex[J].Annual review of phytopathology,2012(50):67-89.
[6]GENIN S.Molecular Traits Controlling Host Range And Adaptation To Plants In Ralstonia Solanacearum[J].New Phytologist,2010,187(4):920-928.
[7]GUIDOT A,WEI J,FERDY J B,et al.Multihost experimental evolution of the pathogen Ralstonia solanacearum unveils genes involved in adaptation to plants[J].Molecular Biology &Evolution,2014,31(11):2913-2928.
[8]AILLOUD F,LOWE T,CELLIER G,et al.Comparative genomic analysis of Ralstonia solanacearum reveals candidate genes for host specificity[J].Bmc Genomics,2015,16(1):1-11.
[9]SALANOUBAT M,GENIN S,ARTIGUENAVE F,et al.Genome sequence of the plant pathogen Ralstonia solanacearum[J].Nature.2002,415:497-502.
[10]XU J,ZHENG H J,LIU L,et al.Complete genome sequence of the plant pathogen Ralstonia solanacearumstrain Po82[J].J Bacteriol,2011,193(16):4261-4262.
[11]REMENANT B,COUPAT-GOUTALAND B,GUIDOT A,et al.Genomes of three tomato pathogens within the Ralstonia solanacearumspecies complex reveal significant evolutionary divergence[J].BMC Genomics,2010,11(1):379.
[12]CAO Yi,TIAN Baoyu,LIU Yanxia,et al.Genome sequencing of Ralstonia solanacearum FQY_4,isolated from a bacterial wilt nursery used for breeding crop resistance[J].Genome Announcements,2013,1(3):13.
[13]REMENANT B,DE CAMBIAIRE J C,CELLIER G,et al.Ralstonia syzygii,the blood disease bacterium and some Asian R.solanacearumstrains form a single genomic species despite divergent lifestyles[J/ OL].PloS One,2011,6(9):e24356[2016-03-25].http://www.plosone.org/article/info%3Adoi% 2F10.1371%2Fjournal.pone.0024356#pone-0024356-g004.
[14]PEETERS N,CARR RE S,ANISIMOVA M,et al.Repertoire,unified nomenclature and evolution of the Type III effector gene set in the Ralstoniaso lanacearumspecies complex[J].BMC genomics,2013,14(1):859.
[15]蔡劉體,劉艷霞,孟琳,等.煙草青枯菌FQY_4基因組中原噬菌體生物信息學分析[J].中國煙草學報,2015,21(1):82-88.
[16]朱賢朝,王彥亭,王智發.中國煙草病蟲害防治手冊[M].北京:中國農業版社,2001.
[17]徐進,馮潔.植物青枯菌遺傳多樣性及致病基因組學研究進展[J].中國農業科學,2013,46(14):2902-2909.
[18]周訓軍,楊玉文,王靜,等.煙草青枯菌遺傳多樣性分析[J].中國煙草學報,2014,20(4):69-74.
[19]CORNELIS G R,VAN Gijsegem F.Assembly and function of type III secretory systems[J].Annu Rev Microbiol,2000,54(1):735-774.
[20]GENIN S,BOUCHER C.LessonSLearned from the genome analysis of Ralstonia solanacearum[J].Annu Rev Phytopathol,2004,42(9):107-134.
[21]BüTTNERTTNER D,BONAS U.Getting acrossbacterial type III effector proteins on their way to the plant cell[J].EMBO J,2002,21(20):5313-5322.
[22]GENIN S,BRITO B,DENNY T P,et al.Control of the Ralstonia solanacearumType III secretion system(Hrp)genes by the global virulence regulator PhcA[J].FEBSLett,2005(579):2077-2081.
[23]YOSHIMOCHI T,HIKICHI Y,KIBA A,et al.The global virulence regulator PhcA negatively controls the Ralstonia solanacearumhrp regulatory cascade by repressing expression of the PrhIR signaling proteins[J].J Bacteriol,2009,191(10):3424-3428.
[24]LI Zefeng,WU Sanling,BAI Xuefei,et al.Genome sequence of the tobacco bacterial wilt pathogen Ralstonia solanacearum[J].Journal of Bacteriology,2011,193(21):6088-6089.
[25]RAMESH R,GAITONDE S,ACHARI G,et al.Genome Sequencing of Ralstonia solanacearum Biovar 3,Phylotype I,Strains Rs-09-161and Rs-10-244,I-solated from Eggplant and Chili in India[J/OL].Genome Announcements,2014,2(3):e00323-14[2016-03-25].http://europepmc.org/abstract/MED/24874667.
[26]ZULUAGA A P,SOL M,LU H,et al.Transcriptome responses to Ralstonia solanacearum infection in the roots of the wild potato Solanum commersonii.[J].BMC Genomics,2015,16(1):246-262.
[27]CAI H,SHENG Y,YAN Y,et al.CaWRKY6transcriptionally activates CaWRKY40,regulates Ralstonia solanacearum resistance,and confers high-temperature and high-humidity tolerance in pepper[J].Journal of Experimental Botany,2015,66(11):3163-3174.
(責任編輯:孫小嵐)
Analysis of Candidate Genes of Ralstonia solanacearum FQY_4for Host Specificity
CAI Liuti1,LU Ning1,SHEN Zixia2,SHI Junxiong1
(1.Guizhou Tobacco Research Institute,Guiyang,Guizhou550081;2.Zunyi Branch of Guizhou Tobacco Company,Zunyi,Guizhou563003,China)
In order to obtain the candidate genes of tobacco R.solanacearumfor host specificity,based on the sequenced genome of FQY_4,the core genes and special genes of GMI1000,Po82,CFBP2957,CMR15,PSI07and FQY_4strains were analyzeDThrough the methods of genome comparative and homology blast.The results showeDThat there are 632candidate genes for its host specificity in the FQY_4genome.Among them 365and 267candidate genes on its chromosome and huge plasmid respectively,including the genes relateDTo trans-membrane proteins,signal proteins and cell wall hydrolysis,the genes relateDTo mobile element proteins,many unknown functional proteins and 42effector proteins(T3Es).
tobacco;Ralstonia solanacearum;bacterial wilt;host;gene
S572
A
1001-3601(2016)10-0411-0005-04
2016-04-25;2016-09-27修回
中國煙草總公司項目“煙株根際土壤微生物施肥響應及調控技術研究”(11020142009);中國煙草總公司貴州省分公司項目“煙草青枯菌致病基因家族分析”(黔煙合201203),“青枯菌噬菌體的篩選及其防控煙草青枯病的探索”(黔煙合201203)
蔡劉體(1974-),男,副研究員,博士,從事土肥植保工作。E-mail:cailiuti01@163.com

