間充質(zhì)干細(xì)胞對腫瘤作用的雙向性:促進(jìn)或抑制
?
間充質(zhì)干細(xì)胞對腫瘤作用的雙向性:促進(jìn)或抑制
胡文龍1,2鄔亞華2殷嫦嫦2施劍明1殷明1
(南昌大學(xué)研究生院醫(yī)學(xué)部,江西南昌33006)
〔關(guān)鍵詞〕間充質(zhì)干細(xì)胞;腫瘤;生長;轉(zhuǎn)移
間充質(zhì)干細(xì)胞(MSCs)是具有向腫瘤組織定向遷移能力的多能干祖細(xì)胞〔1〕,到達(dá)腫瘤組織的MSCs參與形成腫瘤的纖維血管組織,分化形成腫瘤相關(guān)成纖維細(xì)胞(TAFs)和血管周細(xì)胞〔2〕。研究表明MSCs促進(jìn)腫瘤生長和轉(zhuǎn)移,也有研究顯示MSCs抑制腫瘤生長。出現(xiàn)這種矛盾的原因尚不清楚。有研究者將MSCs作為運載抗腫瘤制劑的特異性細(xì)胞載體〔3〕。但是基于目前的研究,還不能說MSCs是一個合格的載體工具,另外抗腫瘤制劑的腫瘤靶向產(chǎn)物是否能克服MSCs的內(nèi)源性促瘤作用,在什么條件下MSCs促進(jìn)或抑制腫瘤的生長和轉(zhuǎn)移,這是運用MSCs作為載體治療腫瘤所要解決的兩大難題。本文主要綜述體內(nèi)MSCs對腫瘤的影響并試圖分析文獻(xiàn)報道中的矛盾。
1MSCs的組織來源及功能
采用相同的方法可從成人和胎兒的多種組織中分離得到MSCs〔4〕。骨髓和脂肪組織MSCs含量豐富〔5〕,成人腎臟、皮膚、甲狀旁腺也可分離得到MSCs〔6〕。MSCs或類間充質(zhì)干細(xì)胞也可以從胎兒組織分離,包括皮膚、臍帶和胎盤〔7,8〕。各種不同組織來源的MSCs和骨髓MSCs具有許多相同的重要特性,包括細(xì)胞表面標(biāo)志物的表達(dá),塑料貼壁性,分化為間葉組織細(xì)胞的能力(脂肪、骨、肌肉、軟骨)〔5〕。此外,MSCs具有腫瘤趨向性,利用該特征可將它們與其他間充質(zhì)細(xì)胞區(qū)分開來,例如成纖維細(xì)胞等〔9〕。
MSCs具有促進(jìn)傷口愈合和支持造血功能,一旦到達(dá)損傷部位時,MSCs就能分化成結(jié)締組織成分,支持血管生成,分泌細(xì)胞因子和生長因子,促進(jìn)愈合。研究者們對骨髓MSCs促進(jìn)修復(fù)的作用進(jìn)行廣泛的研究,包括在缺血性心臟病、糖尿病和帕金森病〔10〕等疾病展開的研究。
MSCs對腫瘤細(xì)胞的作用可能與其促進(jìn)傷口愈合的功能相似。腫瘤中的MSCs分化為成纖維細(xì)胞和周細(xì)胞,并且可能分化為內(nèi)皮樣細(xì)胞或血管基質(zhì)細(xì)胞〔11〕。此外,MSCs能分泌基質(zhì)蛋白和細(xì)胞因子促進(jìn)腫瘤細(xì)胞增殖、遷移和支持血管生成,例如血管內(nèi)皮生長因子(VEGF)和血小板源性生長因子(PDGF)〔12〕。
MSCs也有復(fù)雜的免疫調(diào)節(jié)功能,能通過抑制宿主的免疫反應(yīng)和纖維化來抑制炎癥反應(yīng)。利用MSCs的免疫抑制特性可以降低同種異體骨髓移植的細(xì)胞毒性反應(yīng),進(jìn)而治療移植物抗宿主疾病〔13〕。
2MSCs促進(jìn)腫瘤生長

表1 MSCs促進(jìn)腫瘤生長
研究證實MSCs能促進(jìn)腫瘤生長(見表1)。Karnoub 等〔14〕將人MSCs(hMSCs)與綠色熒光蛋白標(biāo)記的人乳腺癌細(xì)胞(MCF/Ras、MDAMB-231、MDAMB-435、HMLER)按3∶1一起注入裸鼠體內(nèi),結(jié)果MSCs能促進(jìn)MCF/Ras細(xì)胞系增長,對其他三種類型細(xì)胞生長無影響,但其能促進(jìn)所有類型細(xì)胞系發(fā)生轉(zhuǎn)移。骨髓來源的MSCs能促進(jìn)體內(nèi)骨肉瘤細(xì)胞的生長,體外實驗中,ELISA檢測發(fā)現(xiàn)MSCs能分泌CCL5,將CCL5抗體加入含MSCs條件培養(yǎng)基的骨肉瘤細(xì)胞系Sao-2細(xì)胞中,MSCs促進(jìn)該細(xì)胞系的增殖作用消失,說明CCL5參與了MSCs對骨肉瘤的作用過程〔15〕。進(jìn)一步研究發(fā)現(xiàn)MSCs與Saos-2均能分泌IL-6,并因此促進(jìn)彼此增殖〔16〕。MSCs對前列腺癌也有顯著的促生長作用,且MSCs進(jìn)入前列腺癌微環(huán)境后,新生血管相關(guān)標(biāo)志物(巨噬細(xì)胞炎性蛋白-2、血管內(nèi)皮生長因子、轉(zhuǎn)化生長因子-β、IL-6)增加。Hernanda 等〔17〕發(fā)現(xiàn)Huh7細(xì)胞與MSCs一起移植入裸鼠體內(nèi),形成的肝癌體積明顯大于單獨移植。人臍帶MSCs能通過活化NF-κB通路明顯促進(jìn)胃癌細(xì)胞的增殖及遷移〔20〕。
脂肪組織含有豐富的多能MSCs,即脂肪干細(xì)胞(ASCs),與骨髓間MSCs功能相似,具有腫瘤趨向性。Muehlberg等〔21〕發(fā)現(xiàn)ASCs能促進(jìn)鼠體內(nèi)腫瘤模型的生長,ASCs和乳腺癌細(xì)胞株(MCF-1)一起移植導(dǎo)致了瘤體形成更快和體積更大。在大部分報道中,MSCs都是加入到一定數(shù)量的腫瘤細(xì)胞中,這就導(dǎo)致增加的細(xì)胞總數(shù)可能包括腫瘤細(xì)胞和MSCs,已有證據(jù)顯示,在體內(nèi)腫瘤細(xì)胞存在的情況下,MSCs能增殖,而單獨移植的MSCs則不能增殖〔3〕。因此,實驗觀察到的腫瘤體積增加可能與是腫瘤細(xì)胞數(shù)量的增加或MSCs的增加,或兩者均有。然而,腫瘤基質(zhì)細(xì)胞所占這比例卻未能確定,因此在下“MSCs促瘤生長”的結(jié)論時必須謹(jǐn)慎。
3MSCs抑制腫瘤生長
矛盾的是,也有許多研究證明MSCs抑制腫瘤生長(表2)。人類胎兒皮膚來源的MSCs能通過抑制增殖、細(xì)胞集落形成和致癌基因表達(dá)抑制體內(nèi)外人肝癌細(xì)胞〔25〕。肝癌細(xì)胞與相同數(shù)量的MSCs共注射,延遲了腫瘤的發(fā)展并縮小了腫瘤的體積。同樣來源的MSCs抑制MCF-7的體外增長〔26〕。研究人員發(fā)現(xiàn)用MSCs的條件培養(yǎng)基處理腫瘤細(xì)胞后導(dǎo)致了生存因子的下調(diào),例如β-catenin、c-Myc和存活素。這種效應(yīng)是由MSCs分泌的β-catenin信號通路的抑制劑(DKK-1)介導(dǎo)的〔26〕。
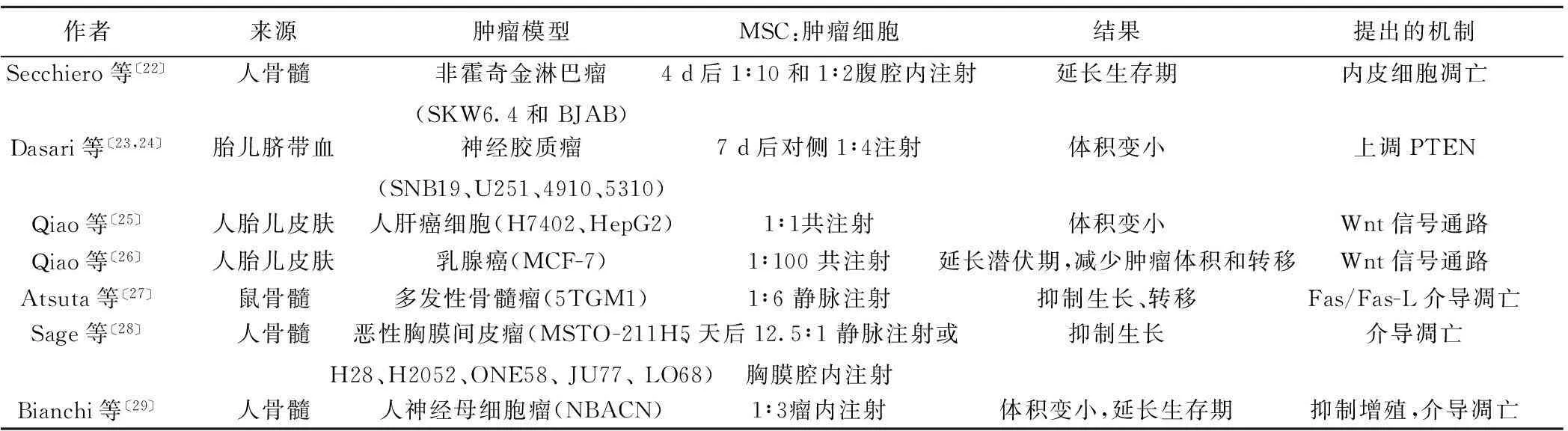
表2 MSCs抑制腫瘤生長
PTEN:同源性磷酸酶-張力蛋白
骨髓源性的MSCs抑制了裸鼠多發(fā)性骨髓瘤的生長,抑制了其股骨頸骨質(zhì)的再吸收及腫瘤細(xì)胞向肺和腎臟的轉(zhuǎn)移。同時,體外實驗發(fā)現(xiàn)Fas/Fas-L介導(dǎo)的細(xì)胞凋亡在MSCs抑制多發(fā)性骨髓瘤的生長過程中發(fā)揮了重要作用〔27〕。Sage等〔28〕發(fā)現(xiàn)MSCs能表達(dá)腫瘤壞死因子相關(guān)凋亡誘導(dǎo)配體(TRAIL),進(jìn)而介導(dǎo)惡性胸膜間皮瘤的凋亡。靜脈注射的MSCs通過增加腫瘤細(xì)胞的凋亡延緩了間皮瘤的生長。MSCs能抑制NBACN細(xì)胞的增殖并促進(jìn)其凋亡,使注射了MSCs的裸鼠的神經(jīng)母細(xì)胞瘤模型生長受到了明顯抑制,從而延長了該組裸鼠的生存期〔29〕。Jin等〔30〕研究表明MSCs對腫瘤的作用取決于腫瘤微環(huán)境,黑色素瘤細(xì)胞活化的浸潤淋巴細(xì)胞(TIL)激發(fā)MSCs向TH1表型分化,活化的MSCs分泌IL-12和吲哚胺2,3加雙氧酶(IDO)發(fā)揮抗腫瘤的免疫調(diào)節(jié)效應(yīng)。
4MSCs對腫瘤生長的影響因素
MSCs對腫瘤細(xì)胞的作用是復(fù)雜多變的,對腫瘤生長表現(xiàn)出促進(jìn)或抑制的雙向性。MSCs能與腫瘤周圍的細(xì)胞相互作用,如免疫細(xì)胞(巨噬細(xì)胞和T細(xì)胞)和內(nèi)皮細(xì)胞。其他類型的細(xì)胞也在調(diào)節(jié)腫瘤進(jìn)展中發(fā)揮作用。
不同來源的MSCs是產(chǎn)生矛盾結(jié)果的主要因素。脂肪組織〔31〕和胎兒皮膚〔26〕來源與骨髓〔17〕來源的MSCs對乳腺癌細(xì)胞起著完全相反的作用。Belmar-Lopez等〔32〕比較了五種不同來源(脂肪、骨髓、羊膜、子宮內(nèi)膜上皮及間質(zhì))的MSCs對宮頸癌(HeLa)細(xì)胞的作用,結(jié)果它們在趨化性、促瘤增殖及遷移的能力均表現(xiàn)出不同程度的差異。
MSCs的異質(zhì)性可能是文獻(xiàn)中MSCs對腫瘤影響不一致的主要原因之一。文獻(xiàn)中所用的MSCs大多數(shù)是根據(jù)干細(xì)胞的塑料貼壁性分離培養(yǎng)的,這類細(xì)胞表達(dá)相似的細(xì)胞表面標(biāo)志物,但是,它們在關(guān)鍵的地方有著面標(biāo)志物,現(xiàn)已有幾個標(biāo)志物被提出,如NG2〔33〕。Waterman等〔34〕對表型不同的兩種MSCs(MSC1和MSC2)進(jìn)行了研究,發(fā)現(xiàn)兩者對卵巢癌分別產(chǎn)生了抑制和促進(jìn)的作用。
體內(nèi)腫瘤模型的差異很大,也可能導(dǎo)致研究的結(jié)果的不同。腫瘤免疫、缺氧、血管生成和細(xì)胞因子等因素在這些文章的模型中都有巨大差異。然而,對于MCF-7細(xì)胞,不同學(xué)者發(fā)現(xiàn)MSCs能促進(jìn)和抑制腫瘤發(fā)展,表明腫瘤模型并不是唯一影響研究結(jié)果的因素。
移植入的MSCs的量可能是影響腫瘤生長的決定因素。文獻(xiàn)分析結(jié)果顯示:報告促生長作用的研究者傾向于使用較高的MSCs——腫瘤細(xì)胞比。然而,低百分比的MSCs,如Xu等〔15〕使用10%的MSCs,也能促進(jìn)骨肉瘤的生長和轉(zhuǎn)移。有報道〔21〕稱,MSCs比例增高可以進(jìn)一步促進(jìn)腫瘤的生長,這表明在合適條件下,MSCs的促瘤生長作用可能存在細(xì)胞數(shù)量依賴性。
MSCs引入到腫瘤細(xì)胞微環(huán)境的時機也可能是一個重要影響因素。建好腫瘤模型后再把MSCs注入體內(nèi)的文章多報告為抑瘤生長作用〔23,24〕。相比之下,報告促增長作用的文章基本都將MSCs與腫瘤細(xì)胞混合注射或同步注射。MSCs在腫瘤生長的早期促進(jìn)了腫瘤的進(jìn)程,例如血管生成,這是腫瘤發(fā)生所必需的。這與研究MSCs和脈管系統(tǒng)相互作用的文章結(jié)果一致。
最后,不同患者之間存在的個體差異可能也導(dǎo)致了治療結(jié)果的爭議。或許是由于遺傳、后天獲得或環(huán)境作用,使MSCs對腫瘤微環(huán)境產(chǎn)生了不同的作用。對癌癥易感者的MSCs進(jìn)行研究,如體細(xì)胞突變或環(huán)境暴露而獲得易感性,可能有助于確定患者間是否存在個體差異。
綜上所述,MSCs對腫瘤作用具有雙向性,但產(chǎn)生這種矛盾結(jié)果還不能簡單解釋,MSCs對腫瘤作用受多種因素影響。MSCs促進(jìn)腫瘤生長和轉(zhuǎn)移的可能性使人們擔(dān)憂其作為臨床治療工具的安全性,但到目前為止,有超過1 000名患者因各種適應(yīng)癥而使用MSCs治療,卻并沒有1例MSCs相關(guān)腫瘤形成的報告。人為操控MSCs分泌具有抗腫瘤效應(yīng)的細(xì)胞因子,或許意味著我們能通過控制細(xì)胞因子的表達(dá)來克服其可能存在的促瘤效應(yīng),選擇合適的移植時機可以避免破壞MSCs的抑瘤作用,干擾MSCs的促瘤效應(yīng)等治療方案可為腫瘤的臨床治療提供新的思路。總之,只有對組織來源、捐贈者的個體差異、MSCs移植的時機或關(guān)鍵受體的表達(dá)等因素綜合分析后才能更加準(zhǔn)確地研究MSCs對腫瘤的作用,為MSCs的臨床應(yīng)用提供更好的理論支持。
5參考文獻(xiàn)
1Kuhn NZ,Tuan RS.Regulation of stemness and stem cell niche of mesenchymal stem cells:implications in tumorigenesis and metastasis〔J〕.J Cell Physiol,2010;222(2):268-77.
2Hata N,Shinojima N,Gumin J,etal.PDGF-BB mediates the tropism of human mesenchymal stem cells for malignant gliomas〔J〕.Neurosurgery,2010;66(1):144-56.
3Studeny M,Marini FC,Champlin RE,etal.Bone marrow-derived mesenchymal stem cells as vehicles for interferon-beta delivery into tumors〔J〕.Cancer Res,2002;62(13):3603-8.
4Pittenger MF,Mackay AM,Beck SC,etal.Multilineage potential of adult human mesenchymal stem cells〔J〕.Science,1999;284(5411):143-7.
5Dominici M,Le Blanc K,Mueller I,etal.Minimal criteria for defining multipotent mesenchymal stromal cells〔J〕.Internat Socie Cell Thera Positi Stat Cytother,2006;8(4):315-7.
6Shih YR,Kuo TK,Yang AH,etal.Isolation and characterization of stem cells from the human parathyroid gland〔J〕.Cell Prolif,2009;42(4):461-70.
7Kim SM,Lim JY,Park SI,etal.Gene therapy using TRAIL-secreting human umbilical cord blood-derived mesenchymal stem cells against intracranial glioma〔J〕.Cancer Res,2008;68(23):9614-23.
8Gucciardo L,Lories R,Ochsenbein-K?lble N,etal.Fetal mesenchymal stem cells:isolation,properties and potential use in perinatology and regenerative medicine〔J〕.BJOG,2009;116(2):166-72.
9Spaeth E,Klopp A,Dembinski J,etal.Inflammation and tumor microenvironments:defining the migratory itinerary of mesenchymal stem cells〔J〕.Gene Ther,2008;15(10):730-8.
10Brooke G,Cook M,Blair C,etal.Therapeutic applications of mesenchymal stromal cells〔J〕.Semin Cell Dev Biol,2007;18(6):846-58.
11Short B,Brouard N,Occhiodoro-Scott T,etal.Mesenchymal stem cells〔J〕.Arch Med Res,2003;34(6):565-71.
12Beckermann BM,Kallifatidis G,Groth A,etal.VEGF expression by mesenchymal stem cells contributes to angiogenesis in pancreatic carcinoma〔J〕.Br J Cancer,2008;99(4):622-31.
13Wolff D,Steiner B,Hildebrandt G,etal.Pharmaceutical and cellular strategies in prophylaxis and treatment of graft-versus-host disease〔J〕.Curr Pharm Des,2009;15(17):1974-97.
14Karnoub AE,Dash AB,Vo AP,etal.Mesenchymal stem cells within tumour stroma promote breast cancer metastasis〔J〕.Nature,2007;449(7162):557-63.
15Xu W,Bian Z,Fan Q,etal.Human mesenchymal stem cells(hMSCs)target osteosarcoma and promote its growth and pulmonary metastasis〔J〕.Cancer Letters,2009;281(1):32-41.
16Bian ZY,Fan QM,Li G,etal.Human mesenchymal stem cells promote growth of osteosarcoma:Involvement of interleukin-6 in the interaction between human mesenchymal stem cells and Saos-2〔J〕.Cancer Sci,2010;101(12):2554-60.
17Hernanda PY,Pedroza-Gonzalez A,van der Laan LJ,etal.Tumor promotion through the mesenchymal stem cell compartment in human hepatocellular carcinoma〔J〕.Carcinogenesis,2013;34(10): 2330-40.
18Chaturvedi P,Gilkes DM,Wong CC,etal.Hypoxia-inducible factor-dependent breast cancer-mesenchymal stem cell bidirectional signaling promotes metastasis〔J〕.J Clini Invest,2013;123(1):189-205.
19Sung SY,Liao CH,Wu HP,etal.Loss of Let-7 microRNA upregulates IL-6 in bone marrow-derived mesenchymal stem cells triggering a reactive stromal response to prostate cancer〔J〕.PLoS One,2013;8(8):e71637.
20Yang T,Zhang X,Wang M,etal.Activation of mesenchymal stem cells by macrophages prompts human gastric cancer growth through NF-kB pathway〔J〕.PLoS One,2014;9(5):e97569.
21Muehlberg FL,Song YH,Krohn A,etal.Tissue-resident stem cells promote breast cancer growth and metastasis〔J〕.Carcinogenesis,2009;30(4):589-97.
22Secchiero P,Zorzet S,Tripodo C,etal.Human bone marrow mesenchymal stem cells display anti-cancer activity in SCID mice bearing disseminated non-Hodgkin's lymphoma xenografts〔J〕.PLoS one,2010;5(6):e11140.
23Dasari VR,Velpula KK,Kaur K,etal.Cord blood stem cell-mediated induction of apoptosis in glioma downregulates X-linked inhibitor of apoptosis protein(XIAP)〔J〕.PLoS One,2010;5(7):e11813.
24Dasari VR,Kaur K,Velpula KK,etal.Upregulation of PTEN in glioma cells by cord blood mesenchymal stem cells inhibits migration via downregulation of the PI3K/Akt pathway〔J〕.PLoS One,2010;5(4):e10350.
25Qiao L,Xu Z,Zhao T,etal.Suppression of tumorigenesis by human mesenchymal stem cells in a hepatoma mode〔J〕.Cell Res,2008;18(4):500-7.
26Qiao L,Xu ZL,Zhao TJ,etal.Dkk-1 secreted by mesenchymal stem cells inhibits growth of breast cancer cells via depression of Wnt signalling〔J〕.Cancer Lett,2008;269(1):67-77.
27Atsuta I,Liu S,Miura Y,etal.Mesenchymal stem cells inhibit multiple myeloma cells via the Fas/Fas ligand pathway〔J〕.Stem Cell Res Ther,2013;4(5):111.
28Sage EK,Kolluri KK,McNulty K,etal.Systemic but not topical TRAIL-expressing mesenchymal stem cells reduce tumour growth in malignant mesothelioma〔J〕.Thorax,2014;69(7):638-47.
29Bianchi G,Morandi F,Cilli M,etal.Close interactions between mesenchymal stem cells and neuroblastoma cell lines lead to tumor growth inhibition〔J〕.PLoS One,2012;7(10):e48654.
30Jin P,Civini S,Zhao Y,etal.Direct T cell-tumour interaction triggers TH1 phenotype activation through the modification of the mesenchymal stromal cells transcriptional programme〔J〕.Br J Cancer,2014;110(12):2955-64.
31Kucerova L,Skolekova S,Matuskova M,etal.Altered features and increased chemosensitivity of human breast cancer cells mediated by adipose tissue-derived mesenchymal stromal cells〔J〕.BMC Cancer,2013;13(1):535.
32Belmar-Lopez C,Mendoza G,Oberg D,etal.Tissue-derived mesenchymal stromal cells used as vehicles for anti-tumor therapy exert different in vivo effects on migration capacity and tumor growth〔J〕.BMC Med,2013;11(1):139.
33Molloy AP,Martin FT,Dwyer RM,etal.Mesenchymal stem cell secretion of chemokines during differentiation into osteoblasts,and their potential role in mediating interactions with breast cancer cells〔J〕.Int J Cancer,2009;124(2):326-32.
34Waterman RS,Henkle SL,Betancourt AM.Mesenchymal stem cell 1(MSC1)-based therapy attenuates tumor growth whereas MSC2-treatment promotes tumor growth and metastasis〔J〕.PLoS One,2012;7(9):e45590.
〔2015-07-29修回〕
(編輯袁左鳴)
〔中圖分類號〕R730
〔文獻(xiàn)標(biāo)識碼〕A
〔文章編號〕1005-9202(2016)05-1243-04;
doi:10.3969/j.issn.1005-9202.2016.05.102
通訊作者:殷明(1958-),男,教授,博士生導(dǎo)師,主要從事脊柱及骨腫瘤外科研究。
基金項目:國家自然科學(xué)基金資助項目(No.81160226)
1南昌大學(xué)第二附屬醫(yī)院骨科
2九江學(xué)院基礎(chǔ)醫(yī)學(xué)院
第一作者:胡文龍(1988-),男,碩士在讀,主要從事骨腫瘤外科研究。

