中國東北黑土土壤剖面微生物群落碳源代謝特征
王 梓,韓曉增,,*,張志明,郝翔翔
1 東北農業大學資源與環境學院, 哈爾濱 150030 2 中國科學院東北地理與農業生態研究所海倫農田生態系統國家野外科學觀測研究站,哈爾濱 150081
中國東北黑土土壤剖面微生物群落碳源代謝特征
王 梓1,韓曉增1,2,*,張志明2,郝翔翔2
1 東北農業大學資源與環境學院, 哈爾濱 150030 2 中國科學院東北地理與農業生態研究所海倫農田生態系統國家野外科學觀測研究站,哈爾濱 150081
利用Biolog Eco微平板培養法,對中國科學院海倫農田生態系統國家野外科學觀測研究站農田(CL)、恢復草地(GL)和人工林地(FL)土壤剖面不同深度土壤中微生物群落碳源代謝特征進行研究。理化性質結果顯示,有機碳、全氮和堿解氮含量隨深度增加逐漸減少,pH則是上層土壤低于底層。可培養微生物數量從表層(0—20 cm)到底層(180—200 cm)逐漸減少, 在表層(0—20 cm)3種可培養微生物數量均為草地>農田>林地。可培養微生物主要生活在近地表0—60 cm土層中,在60—200cm土層中3種利用方式下可培養細菌、真菌和放線菌數量基本相同。Biolog結果顯示,在0—40 cm土層中微生物群落活性最大,底層(180—200 cm)土壤微生物群落活性最小。3種利用方式剖面微生物群落Shannon多樣性指數和碳源利用數量從表層到底層逐漸減少,并且與SOC和TN呈極顯著正相關關系(P< 0.05)。與農田相比恢復草地和人工林地剖面20—40 cm土層中微生物群落對各類碳源的利用強度都較高,說明沒有農業機械作業的植被自然生長條件下根系會打破原來農田中的犁底層,促進表層(0—20 cm)以下微生物群落活性。碳源利用率和主成分分析結果表明長期不同植被覆蓋已經改變了剖面微生物群落碳源代謝特征,而且根系已經影響到100 cm的微生物群落,但還沒有影響到180—200cm中的微生物群落。
黑土; 剖面; 微生物群落; 碳源代謝特征
土壤生物被認為是地球關鍵元素生物,是地球化學循環過程的引擎[1],而土壤微生物由于數量巨大,種類豐富成為其中非常重要的組成部分[2],對土壤生態功能的發揮有極為重要的作用[3- 5]。土壤是在地球表層母質或母巖上發育起來的自然體,土體物質垂直分布的斷面稱為土壤剖面,土壤剖面中的物質變化過程,是植被根系-微生物-土壤非生命物質三者相互作用過程[6-7]。植物根系的分布會改變不同深度土層中微生物生存的物理環境,同時根系代謝產物和死亡部分又能給微生物提供生命活動的能量和物質。剖面中微生物群落的活動控制C、N、P等重要元素的生物地球化學循環,致使某些物質在土壤剖面中存在位置的再分配。所以隨著時間的變化,根系-微生物-土壤這個體系在相互作用中不斷地向著某一個方向發育。
中國東北黑土是在沖積沉積物上發育的土壤,土體深厚、土壤粘重,形成界限分明的表層、亞表層、過渡層和母質層。剖面中不同層次間微生物群落結構和活性是不同的,一些研究也證明了這一點,在新疆阜康地區農田中表層土壤中放線菌門和變形菌門是群落中主要的類群,二者相對豐度接近50%,但是在亞表層中放線菌門相對豐度逐漸減少,變形菌門相對豐度逐漸增加[8]。2012年研究人員對美國科羅拉多州戈登峽谷流域剖面微生物群落進行研究也表明表層土壤微生物群落組成與亞表層土壤微生物群落組成差異非常大[9]。這些研究結果表明土壤剖面中不同層次微生物群落組成差異很大,從而推論剖面不同深度土層中微生物群落碳源代謝能力也會存在較大的差異,然而截止到目前為止,對黑土不同利用方式剖面不同深度土層中微生物碳源代謝特征的研究,國內外還鮮有報道。
Biolog 作為研究土壤微生物群落功能多樣性的一種簡單、快速方法[10- 14],已經對不同土壤類型[15]、不同植物根系活動下[16-17]的根際土壤微生物多樣性和碳源代謝特征做了很多研究。本研究應用Biolog方法研究不同利用方式下黑土剖面不同深度土層中微生物群落碳源代謝特征的變化,區分不同深度土層中微生物群落的主要代謝碳源類型和利用強度,更深刻的理解微生物群落變化與土壤剖面物質轉化的關系,加深對土壤形成的認識,具有重要的生態環境意義。
1 材料方法
1.1 研究區概況
試驗區位于中國科學院海倫農田生態系統國家野外科學觀測研究站(47°26′N,126°38′E),地處黑龍江省中部,屬溫帶大陸性季風氣候,平均海拔234 m,年均氣溫1.5℃,≥10 ℃的有效積溫2400—2500℃,無霜期120—130 d,作物生長期約120 d。全年降水量500—600 mm,80%以上集中在5—9月[18]。
1.2 試驗設計
試驗區位于500 m×150 m的區域內,地勢平坦,土壤質地均一。土壤類型為第四紀黃土狀亞黏土發育而成的中厚層黑土。于1985年設置以下3 種土地利用方式:1) 草地(GL),1985年退耕休閑,植被類型為草原化草甸植被,主要植被有苔草(Carex)、問荊(EquisetumarvenseL.)和狗尾草(Setariaviridis)等;2)農田(Cropland,CL),采用傳統常規耕作方式,不施肥,種植制度為小麥-玉米-大豆輪作,一年一熟制,本研究當季種植作物為大豆(Soybean),秋季收獲后將作物地上部全部移除;3)林地(Forestland,FL),于1985年在耕地上直接種植紅皮云杉(Piceakoraiensis),種植密度為2 m×2 m,株高約4.5 m。
1.3 樣品采集
2013年6月每種利用方式挖取3個土壤剖面,剖面深度為200 cm,在表層采集0—10 cm和10—20 cm,之后以每20 cm為1層,共采集11層土壤樣品。土壤樣品裝入封口袋內,放入冰盒運回實驗室,4℃冰箱中保存,以備分析。
1.4 試驗方法
土壤有機碳與全氮采用元素分析儀(EA3000, Euro Vector, Italy)測定;堿解氮采用堿解擴散法測定;土壤速效鉀采用乙酸銨提取法-火焰光度計測定;土壤pH采用電位法(水土比2.5∶1)。
土壤可培養細菌、放線菌和真菌計數采用平板菌落計數法測定。細菌采用牛肉膏蛋白胨瓊脂培養基(pH 7.0—7.2),放線菌采用改良高氏1號培養基(pH 7.2—7.4),真菌采用馬丁(Mantin)培養基[19-21]。
Biolog EcoPlate接種和培養:稱取相當于5 g烘干土重的鮮土加入到裝有45 mL滅菌生理鹽水(0.85%)的三角瓶中,超聲1 min,然后在振蕩器上振蕩40 min混勻。土壤溶液稀釋至10-3濃度梯度,向ECO板中每孔加入150 μL土壤稀釋液,28℃保濕避光培養216 h。每隔24 h用Biolog 自動讀數儀測量590 nm(顏色和濁度)和750 nm(濁度)波長下的數值。
1.5 數據分析
按照Classen[20]方法計算:
(1)平均顏色變化率(AWCD)
AWCD=∑(C590-750)/n;
(2)Shannon指數H(評估物種豐富度)
H=-∑piln(pi)。
式中,C是反應孔吸光值,n是碳源數。pi為第i孔相對吸光度值與整個平板相對吸光度值總和的比率。
選擇培養第6天的數據進行后續分析。
試驗結果的方差分析及主成分分析采用SPSS 19.0進行。
2 結果
2.1 理化性質
雖然地表植被不同,但是SOC、TN和EN都隨著深度增加而減少,在0—10 cm土層中草地含量高于林地和農田。SOC、TN和EN在0—60 cm土層變化最大,在60—200 cm土層變化減小。3個剖面表層pH都低于底層。
2.2 可培養微生物數量變化
剖面不同層次可培養微生物數量變化結果見圖2。結果顯示,無論是真菌、細菌還是放線菌都是表層數量最多,3種利用方式中60 cm以下土層的可培養微生物數量幾乎相同。但是在0—20 cm土壤中無論真菌、細菌還是放線菌數量均為草地>農田>林地。
2.3 剖面中不同層次土壤微生物碳源代謝特征
2.3.1 土壤微生物群落平均顏色變化率
從剖面不同層次平均顏色變化率(AWCD)結果(圖3)可以看到,微生物群落的活性(AWCD高低)隨剖面深度增加而減小。農田0—20 cm土層的AWCD值顯著高于其他層次,由于農田0—20 cm土壤每年都會翻耕,并且作物根系主要集中在0—20 cm層次中,所以在0—10cm和10—20cm土層中AWCD值相近。由于農田剖面中有犁底層產生,這決定了耕層以下微生物群落的AWCD值較低。草地剖面中植被種類多根系密集,所以0—10 cm和10—20 cm層表現出較高的AWCD值。恢復草地處理中由于大量雜草根系進入較深的土層中,所以40—60 cm層中AWCD值仍然較高,顯著高于農田和林地相應層次。人工林地0—40 cm之間的3個土層的AWCD值比較接近,但是顯著高于深層次土層的AWCD值。

圖1 3種利用方式下剖面的土壤屬性Fig.1 Soil properties of soil profile under three land useCL: 農田Crop Land; GL: 草地Grass Land; FL: 林地Forest Land
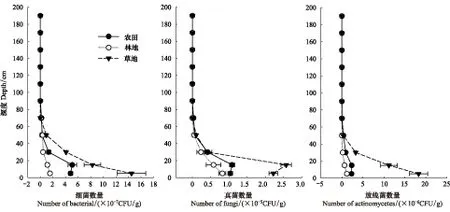
圖2 剖面中可培養微生物數量Fig.2 The number of cultivable microorganisms in three profiles

圖3 平均顏色變化率變化Fig.3 Average Well Color Development (AWCD) of microbial community in three profiles
2.3.2 多樣性指數
Shannon指數是應用最廣泛的多樣性指數,是評價群落物種多樣性的指數。3個處理中,表層多樣性指數顯著高于底層(P<0.05),碳源利用數量結果也是如此(P<0.05)(表1)。在0—40 cm土層中草地剖面中的Shannon指數和碳源利用數量都是最高的,說明草地植被會增加微生物群落的多樣性。但是3個剖面在底層(180—200 cm)無論是多樣性指數還是碳源利用數量是沒有顯著差異(表1),所以可以推測雖然不同類型的植被在同一塊土地生長了近30年,但是不同類型的植被并沒有對底層的微生物群落碳源代謝多樣性產生影響。
2.3.3 碳源相對利用率
Eco板中有31個碳源,分為6類,由于碳源含有生態有關的化合物,所以更適合研究土壤微生物的功能多樣性[11]。由于機械作業在農田耕層(0—20 cm)下會產生一層堅硬的犁底層,會阻礙水分、肥料和植物根系進入土壤剖面下方,從圖4中看到,農田剖面中6類碳源的吸光值都是0—20 cm土層最高,之后隨深度增加而降低。糖類、氨基酸類、羧酸類和酚酸類在20 cm之后迅速下降,這4類碳源在Eco板上31個碳源中是大多數。并且糖類、氨基酸類和羧酸類是土壤微生物群落利用最多的碳源,這些碳源在20 cm土層以下利用程度迅速下降,說明了人類農業活動對土壤剖面微生物群落的影響是很大的。草地和林地0—40 cm中各類碳源利用變化較大,但是在40 cm以下碳源利用程度逐漸減小。

表1 不同植被對剖面微生物群落Shannon指數和碳源利用數量的影響
CL: 農田Crop Land; GL: 草地Grass Land; FL: 林地Forest Land; 平均值±標準偏差,n=3; 大寫字母代表不同處理相同層次(P<0.05),小寫字母代表相同處理不同層次(P<0.05)

圖4 3個剖面不同土壤層次內微生物群落對6類碳源的利用強度Fig.4 Utilization intensity of six kind carbon sources in all layers of three profiles
2.3.4 主成分分析
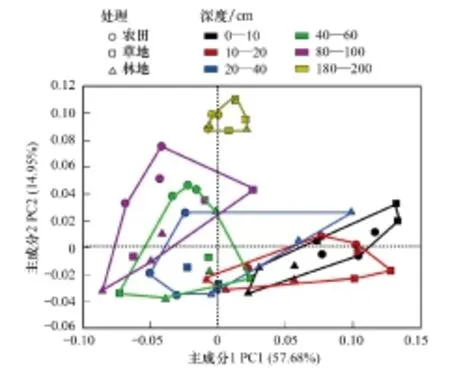
圖5 對3個剖面不同層次土壤微生物群落的主成分分析 Fig.5 Principal component analysis of soil microbial community in all layers of three profiles
微生物群落對碳源利用情況反映了微生物群落組成的變化[21],對碳源利用結果進行主成分分析。從圖5中看到在3個剖面中微生物群落從表層逐漸過渡到底層,既反映了微生物群落碳源利用特征的變化,也反映了微生物群落組成的變化。從0—100 cm土層中表現出植被根系對微生物群落都產生了影響,導致微生物群落碳源利用特征產生分異,而在180—200 cm土層中植被根系的影響幾乎消失。
3 討論
3.1 可培養微生物數量在剖面中的分布情況
雖然平板稀釋法培養的微生物只是整個群落中的一小部分[22-23],但是依然可以從某種程度上表現出微生物群落的變化趨勢。在研究中可培養微生物數量隨深度增加而減少,與以前的研究相同[24]。前期的研究表明,植被根系對SOC的影響可以達到100 cm以下[25],但是對可培養微生物數量的影響只是在0—60 cm中(圖2)。在0—60 cm中草地植被顯著提高了可培養微生物的數量,林地的可培養微生物數量卻是減少了,這充分體現了植被對土壤微生物群落生存環境的影響。而且最近的研究表明,不同的植被覆蓋對微生物群落組成以及碳礦化速率都有非常大的影響[26]。從表層到深層的理化性質數據顯示養分含量隨逐漸減少,容重逐漸增加[25],說明越往深層土壤孔隙越少,空氣越少,造成水分養分運移減少[27],環境逐漸變得惡劣,所以可培養微生物數量隨深度減少甚至消失。
不僅可培養微生物總量隨著深度變化而變化,各類群微生物比例也隨深度變化而變化(表2)。農田由于每年翻耕,所以0—10 cm和10—20 cm中的細菌、放線菌和真菌的數量和比例相近。由于20—40 cm是犁底層,經過機械壓實容重較大,所以這一層中細菌比例減少,細菌總量也是少于0—20cm表層土壤。可培養微生物在草地剖面所有土層中都被檢測到,在0—80 cm中細菌和放線菌的比例較大,在80 cm以下細菌和放線菌比例急劇減少,二者比例逐漸接近。說明根系作用的層次主要是0—80 cm。林地只在0—40 cm中3種微生物都被檢測出,但細菌與放線菌的比例顯著小于同層次的農田和草地,可能由于木本植被是多年生植被,根系在土壤中很深,近地表的根系并不是農作物與雜草那樣柔軟且具有大量根毛的根系,所以不能刺激微生物生長;林地中地表溫度也要低于草地和農田;其次林地地表有一層半分解的枯枝落葉層,而且枯枝落葉分解主要依靠真菌。這些原因綜合起來決定了林地中可培養微生物總量較少,整個微生物群落中也是真菌比例較大。

表2 在3個剖面中不同層次可培養細菌、放線菌和真菌數量的比值
3.2 剖面中微生物群落的能源利用特征
利用方式是影響土壤剖面土壤屬性最主要的人為因素之一,植被的轉變導致進入土壤中凋落物種類和數量的變化,造成凋落物分解后進入土壤剖面中的物質量和種類不同[28]。Biolog可研究土壤微生物群落對碳源利用能力的變化規律,但無法對土壤微生物進行分類研究[29],所以在本文研究有一定局限性。但綜合幾種傳統方法,仍能探索微生物群落在土壤剖面中利用碳源的規律。微生物群落AWCD,多樣性指數和碳源利用數量都隨著深度增加而減少,其中多樣性指數與SOC和TN呈極顯著正相關關系(表3),說明剖面中微生物群落多樣性隨養分含量減少而減少。值得注意的是,草地與林地的多樣性指數與pH呈極顯著負相關,但是農田的多樣性指數卻沒有顯著相關,這一點也與前期有機碳在剖面分布結果相同[25],都證明了人類生產活動對土壤屬性會產生顯著影響。

表3 多樣性指數與理化性質相關關系
**P<0.01
黑土農田剖面中由于每年的翻耕和機械壓實產生了犁底層[30],阻擋了根系的生長,所以每種碳源利用程度都在0—20 cm較高,在20 cm以下逐漸下降。地上植被轉變后經過植被自然生長,犁底層逐漸消失,根系活動的土層加深導致剖面中不同層次微生物群落對6類碳源的利用發生變化(圖4)。在0—10 cm土層中林地對羧酸類碳源的利用顯著低于草地和農田。而且林地剖面中微生物群落對碳源的利用強度在40 cm以下土層才逐漸下降;而草地剖面中微生物群落在除糖類和胺類碳源利用強度變化與農田相似外,氨基酸類、羧酸類和酚酸類碳源利用強度在40 cm以下土層逐漸減弱,而聚合物類碳源利用強度在60 cm以下在逐漸減弱。從主成分分析結果中可以看到,根系已經影響到100 cm以下的土壤微生物群落,但是并沒有影響到180—200 cm土層的微生物群落。
本研究應用的Biolog技術由于其操作簡便廣泛應用于微生物群落功能多樣性的研究中。但是本身也有一定的局限性,其中所含的碳源具有一定的人為傾向,并沒有包含土壤中所有種類的化合物,而且只能檢測到生長較快的微生物類群,這樣有可能低估土壤微生物群落的實際代謝水平[31]。因此,在今后的研究中盡量結合多種研究方法,得到更全面的更客觀的研究結果。
4 結論
對黑土不同利用方式下土壤剖面中微生物群落碳源利用特征研究表明,從農田植被轉變為恢復草地增加了可培養微生物數量,轉變為人工林地后減少了可培養微生物數量。植被根系對可培養微生物數量的影響在0—60 cm之間。恢復草地和人工林地除了改變表層微生物群落活性和碳源利用強度外,還改變了100 cm以下的微生物群落碳源代謝特征,增加了剖面深層中的微生物活性及各類碳源的利用強度,促進了剖面中養分與物質的循環。
[1] 賀紀正, 陸雅海, 傅博杰. 土壤生物學前沿. 北京: 科學出版社, 2015: 29- 29.
[2] 黃昌勇. 土壤學. 北京: 中國農業出版社, 2000: 51- 51.
[3] Nannipieri P, Ascher J, Ceccherini M T, Landi L, Pietramellara G, Renella G. Microbial diversity and soil functions. European Journal of Soil Science, 2003, 54(4): 655- 670.
[4] Van Der Heijden M G A, Bardgett R D, Van Straalen N M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecology Letters, 2008, 11(3): 296- 310.
[5] 林先貴, 胡君利. 土壤微生物多樣性的科學內涵及其生態服務功能. 土壤學報, 2008, 45(5): 892- 900.
[6] 孫波, 廖紅, 蘇彥華, 許衛鋒, 蔣瑀霽. 土壤-根系-微生物系統中影響氮磷利用的以下關鍵協同機制的研究進展. 土壤, 2015, 47(2): 210- 219.
[7] Gyaneshwar P, Kumar G N, Parekh L J, Poole P S. Role of soil microorganisms in improving P nutrition of plants. Plant and Soil, 2002, 245(1): 83- 93.
[8] Li C H, Yan K, Tang L S, Jia Z J, Li Y. Change in deep soil microbial communities due to long-term fertilization. Soil Biology and Biochemistry, 2014, 75: 264- 272.
[9] Eilers K G, Debenport S, Anderson S, Fierer N. Digging deeper to find unique microbial communities: the strong effect of depth on the structure of bacterial and archaeal communities in soil. Soil Biology and Biochemistry, 2012, 50: 58- 65.
[10] Preston-Mafham J, Boddy L, Randerson P F. Analysis of microbial community functional diversity using sole-carbon-source utilisation profiles—a critique. FEMS Microbiology Ecology, 2002, 42(1): 1- 4.
[11] 鄭華, 歐陽志云, 方治國, 趙同謙. BIOLOG在土壤微生物群落功能多樣性研究中的應用. 土壤學報, 2004, 41(3): 456- 461.
[12] Choi K H, Dobbs F C. Comparison of two kinds of Biolog microplates (GN and ECO) in their ability to distinguish among aquatic microbial communities. Journal of Microbiological Methods, 1999, 36(3): 203- 213.
[13] Garland J L. Analysis and interpretation of community-level physiological profiles in microbial ecology. FEMS Microbiology Ecology, 1997, 24(4): 289- 300.
[14] Garland J L, Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization. Applied and Environmental Microbiology, 1991, 57(8): 2351- 2359.
[15] Sun B, Wang X Y, Wang F, Jiang Y J, Zhang X X. Assessing the relative effects of geographic location and soil type on microbial communities associated with straw decomposition. Applied and Environmental Microbiology, 2013, 79(11): 3327- 3335.
[16] Yin R, Deng H, Wang H L, Zhang B. Vegetation type affects soil enzyme activities and microbial functional diversity following re-vegetation of a severely eroded red soil in sub-tropical China. Catena, 2014, 115: 96- 103.
[17] 劉明, 李忠佩, 張桃林. 不同利用方式下紅壤微生物生物量及代謝功能多樣性的變化. 土壤, 2009, 41(5): 744- 748.
[18] 石洪艾, 尤孟陽, 李祿軍, 韓曉增. 長期施用有機物料下黑土氮素有效性及其與作物產量的關系. 生態學雜志, 2012, 31(9): 2283- 2288.
[19] 李振高, 駱永明, 滕應. 土壤與環境微生物研究法. 北京: 科學出版社, 2008: 52- 52.
[20] Classen A T, Boyle S I, Haskins K E, Overby S T, Hart S C. Community-level physiological profiles of bacteria and fungi: plate type and incubation temperature influences on contrasting soils. FEMS Microbiology Ecology, 2003, 44(3): 319- 328.
[21] 夏雪, 谷潔, 車升國, 高華, 秦清軍. 施氮水平對塿土微生物群落和酶活性的影響. 中國農業科學, 2011, 44(8): 1618- 1627.
[22] Kirk J L, Beaudette L A, Hart M, Moutoglis P, Klironomos J N, Lee H, Trevors J T. Methods of studying soil microbial diversity. Journal of Microbiological Methods, 2004, 58(2): 169- 188.
[23] 宋長青, 吳金水, 陸雅海, 沈其榮, 賀紀正, 黃巧云, 賈仲君, 冷疏影, 朱永官. 中國土壤微生物學研究10年回顧. 地球科學進展, 2013, 28(10): 1087- 1105.
[24] Fierer N, Schimel J P, Holden P A. Variations in microbial community composition through two soil depth profiles. Soil Biology and Biochemistry, 2003, 35(1): 167- 176.
[25] 郝翔翔, 韓曉增, 李祿軍, 鄒文秀, 陸欣春, 喬云發. 土地利用方式對黑土剖面有機碳分布及碳儲量的影響. 應用生態學報, 2015, 26(4): 965- 972.
[26] Fanin N, Bertrand I. Aboveground litter quality is a better predictor than belowground microbial communities when estimating carbon mineralization along a land-use gradient. Soil Biology and Biochemistry, 2016, 94: 48- 60.
[27] 趙洪書. 從容重計算土壤總孔隙度的初步探討. 土壤學報, 1964, 12(2): 230- 234.
[28] Lambin E F, Turner B L, Geist H J, Agbola S B, Angelsen A, Bruce J W, Coomes O T, Dirzo R, Fischer G, Folke C, George P S, Homewood K, Imbernon J, Leemans R, Li X B, Moran E F, Mortimore M, Ramakrishnan P S, Richards J F, Sk?nes H, Steffen W, Stone G D, Svedin U, Veldkamp T A, Vogel C, Xu J C. The causes of land-use and land-cover change: moving beyond the myths. Global Environmental Change, 2001, 11(4): 261- 269.
[29] 李晨華, 張彩霞, 唐立松, 熊正琴, 王保戰, 賈仲君, 李彥. 長期施肥土壤微生物群落的剖面變化及其與土壤性質的關系. 微生物學報, 2014, 54(3): 319- 329.
[30] 韓曉增, 鄒文秀, 王鳳仙, 王鳳菊. 黑土肥沃耕層構建效應. 應用生態學報, 2009, 20(12): 2996- 3002.
[31] 章家恩, 蔡燕飛, 高愛霞, 朱麗霞. 土壤微生物多樣性實驗研究方法概述. 土壤, 2004, 36(4): 346- 350.
Metabolic characteristics of the microbial community on the basis of carbon source in black soil profiles in northeastern China
WANG Zi1, HAN Xiaozeng1,2,*, ZHANG Zhiming2, HAO Xiangxiang2
1CollegeofResourcesandEnvironmentalSciences,NortheastAgriculturalUniversity,Harbin150030,China2NationalObservationStationofHailunAgroecologySystem,Northeast-InstituteofGeographyandAgroecology,ChineseAcademyofSciences,Harbin150081,China
Using long-term field experiment of different ecosystems established at the Hailun State Key Experimental Station of Agroecology, Chinese Academy of Sciences, soil profiles down to the parent material layer (200 cm) were collected to investigate microbial metabolic characteristics of the carbon source by using the Biolog ECO micro-plate technique. The field treatments included three different ecosystems: Crop Land (CL), Grass Land (GL), and Forest Land (FL). The results showed that soil organic carbon (SOC), total nitrogen (TN), and effective nitrogen (EN) decreased with soil depth; soil pH increased with soil depth, and it was lower in the surface layer (0—20 cm) than in the bottom layer (180—200 cm). The number of cultivable microorganisms (bacteria, fungi, and actinomycetes) gradually decreased with soil depth; the cultivable microorganisms mainly lived in the top 0—60 cm soil layer. The numbers of the three types of cultivable microorganisms decreased in the order of GL > CL > FL at 0—20 cm soil depth, and the numbers were almost the same in the three ecosystems in the 60—200 cm soil layer. Activities of the soil microbial community were the highest at 0—40 cm soil depth and decreased with soil depth; the lowest value was observed in the 200 cm soil layer. Similar to SOC and TN, the Shannon diversity index and carbon source utilization gradually decreased with soil depth and showed a positive correlation with SOC and TN (P< 0.05). Compared to CL, carbon use efficiency of the soil microbial community improved at subsurface soil depth (20—40 cm) in GL and FL. This demonstrated that the roots of the vegetation could break the plow pan in GL and FL soils without any tillage activities and promote the activities of the soil microbial community below the surface soil layers. Principal component analysis of the utilization intensity of six types of carbon sources showed that the different long-term ecosystems with different vegetation types had changed the carbon utilization intensity of the soil microbial community in the soil profiles. The roots of the vegetation or crops had great influence on the soil microbial community to 100 cm depth, but not to 200 cm depth.
black soil; soil profile; microbial community; metabolic characteristics
國家自然基金資助項目(41371296)
2015- 09- 28;
2016- 04- 29
10.5846/stxb201509281979
*通訊作者Corresponding author.E-mail: xzhan@iga.ac.cn
王梓,韓曉增,張志明,郝翔翔.中國東北黑土土壤剖面微生物群落碳源代謝特征.生態學報,2016,36(23):7740- 7748.
Wang Z, Han X Z, Zhang Z M, Hao X X.Metabolic characteristics of the microbial community on the basis of carbon source in black soil profiles in northeastern China.Acta Ecologica Sinica,2016,36(23):7740- 7748.

