脂肪間充質干細胞誘導巨噬細胞向M2型極化的實驗研究①
王玲玲 唐麗麗 孫 萌 王天陽 尤和誼 張純武 楊亦榮 陳吉彩 周蒙滔 陳必成
(溫州醫科大學附屬第一醫院普外科,溫州32500)
?
脂肪間充質干細胞誘導巨噬細胞向M2型極化的實驗研究①
王玲玲唐麗麗②孫萌②王天陽尤和誼張純武楊亦榮陳吉彩周蒙滔陳必成②
(溫州醫科大學附屬第一醫院普外科,溫州32500)
[摘要]目的:探究脂肪間充質干細胞體外對炎癥啟動細胞——巨噬細胞的極化作用。方法:脂多糖(LPS,1 μg/ml)模擬局部炎癥,誘導RAW264.7巨噬細胞向M1型巨噬細胞極化。收集培養過脂肪間充質干細胞的培養基(ADMSCCM)誘導M1型RAW264.7細胞向M2轉化。檢測M1和M2極化方向的相關指標,通過對IL-10、IGF-1、Arg-1、TNF-α、FIZZ1、SPHK-1的mRNA定量,以及通過Western蛋白質印跡法和熒光標記技術觀察IL-10、IL-12 p40、IL-27 Rα的表達。結果:LPS誘導后的RAW264.7細胞,在經過ADMSCCM培養后,其M1相關指標(TNF-α mRNA、IL-12 p40;P<0.05)顯著下降,部分M2相關指標(IGF-1、IL-10 mRNA、IL-10;P<0.05)明顯上升。結論:脂肪間充質干細胞分泌的可溶性細胞因子,可誘導已向M1型極化的RAW264.7細胞向M2型巨噬細胞極化。
[關鍵詞]脂肪間充質干細胞;巨噬細胞;RAW264.7;極化
脂肪間充質干細胞(Adipose derived mesenchymal stem cells,ADMSC),因其提取過程較其他干細胞相對簡單,而廣泛的被嘗試應用于各種疾病的治療。最初關于ADMSC的研究多將其注射到局部組織,以期填補、替換局部的組織損傷。但之后的實驗卻發現移植到局部組織的ADMSC分泌的可溶性細胞因子可以促進局部損傷的修復,并具強大的炎癥調節功能。
通常認為巨噬細胞是具吞噬功能的促炎細胞。目前發現不同表型的巨噬細胞執行不同的功能。Mosser等[1]將巨噬細胞按功能分為:經典活化型(M1),創傷愈合型(M2a)以及調節型(M2b/c)巨噬細胞。也是移植ADMSC治療炎癥疾病如胰腺炎、風濕性關節炎和克隆恩氏病的可能機制。細菌及其產物LPS可以誘導巨噬細胞呈現M1表型,使其可以分泌多種促炎因子,具強大的胞吞作用,可以更有效殺傷細胞內病原體[2]。亦有實驗表明,成熟的M1型巨噬細胞是可以向M2型巨噬細胞轉化的[3]。
在ADMSC移植到局部,和周圍組織及血液中遷移而來的巨噬細胞共同作用于局部組織,兩種細胞在促進局部組織修復和調節免疫功能方面的功能極為相似。因此,研究ADMSC對巨噬細胞有何影響,是否可以誘導促炎的M1型巨噬細胞轉化為促修復,調節免疫的M2型巨噬細胞,具有重要的意義。
1材料與方法
1.1材料
1.1.1脂肪間充質干細胞提取、培養脂肪間充質干細胞(ADMSC)提取參考Zuk等[4]的方法,略有改進:取7周齡C57BL/6小鼠(上海斯萊克實驗動物有限公司)腹股溝區脂肪組織,分離較大血管后剪碎,含10%Ⅰ型膠原酶(Sigma公司)的DMEM培養液(Gibco BRL公司,不含Hips成分)于37℃震蕩消化90 min,篩網濾去未消化的組織,懸濁液于1 200 r/min離心10 min,取沉淀,PBS沖洗、離心3次后,用含10%胎牛血清(Gibco BRL公司)的DMEM培養液重懸,培養于37℃,5%CO2的培養箱,此后兩日均用PBS洗去未貼壁的細胞和組織塊。常規換液至細胞達到80%~90%融合時進行傳代。
1.1.2含ADMSC分泌的可溶性細胞因子培養基(ADMSCCM)的制備ADMSC傳代至第2、3代,當細胞鋪滿80%~90%視野時,使用無血清的DMEM培養液培養,24 h后取培養液,2 500 r/min離心10 min,取上清液,保存于-20℃,細胞常規傳代。
1.2方法
1.2.1RAW264.7細胞培養及處理小鼠單核巨噬細胞白血病細胞(RAW264.7),購自KeyGen BioTech公司,使用含5%胎牛血清(HyClone公司)的1640培養液常規傳代培養。實驗分空白對照組(Control組),LPS刺激組(LPS組),LPS刺激-ADMSCCM干預組(LPS-CM組)。當細胞鋪滿30%的視野時,用不含血清的1640培養液預處理12 h后Control組常規換液,LPS及LPS-CM組換添加1 μg/ml LPS(Sigma公司)的1640培養液培養,24 h后Control、LPS組換1640培養液培養,LPS-CM組換含50%ADMSCCM的1640培養液培養。48 h后提取總RNA、總蛋白并進行免疫熒光實驗。
1.2.2 RNA提取及RTPCR按1.2.1的步驟處理的RAW264.7細胞,Trizol法(Invitrogen公司)提取總RNA。使用Thermo試劑盒(Thermo Fisher Scientific公司)逆轉錄cDNA,進行RTPCR。擴增程序為:95℃3 min,95℃15 s,62℃1 min,40循環(ABI7500,USA)。應用參照基因GAPDH進行校正,利用空白對照組進行歸一化,最終得到目的基因的表達差異:相對表達量=2-△△Ct,△△Ct=[Cttarget gene (標本) - Ctinternal reference (標本)]-[Cttarget gene(對照)-Ct internal reference (對照)]。實驗均進行復孔檢測。檢測GAPDH、IL-10、IL-12p40、IL-27Rα、IGF-1、iNOS、Arg-1、TNF-α、FIZZ1、SPHK1的相對表達量,引物均由GENEWIZ公司合成,序列見表1。
1.2.3蛋白提取及Western蛋白質印跡檢測按1.2.1步驟處理的RAW264.7細胞,細胞裂解液作用20 min后細胞刮收集細胞,12 000 r/min離心后收集上清液,BCA蛋白濃度測定試劑盒測定蛋白濃度,加入蛋白上樣緩沖液后100℃變性5 min。制備12%聚丙烯酰胺分離膠和4%積層膠,取30 μg蛋白上樣電泳。分子量18.7 kD(IL-10)的蛋白濕法電轉移25 min,其余均轉50 min。5%牛奶TBSB封閉后,孵育一抗GAPDHpAb(Bioworld公司),Anti-IL10 antibody(Abcam公司),Anti-IL27Rα antibody(abcam公司),抗IL-12BP40抗體(Santa Cruz Biotechnology公司)。孵育辣根過氧化物酶標記山羊抗兔IgG二抗(Bioworld公司)后曝光,使用Quantityone對得到的條帶進行光密度定量分析。
1.2.4免疫熒光染色按1.2.1步驟處理的RAW264.7細胞,經4%甲醛液固定,TritonX-100破膜,封閉,孵育一抗、二抗,DIPA染色(Roche公司),室溫涼干后熒光顯微鏡觀察(目的激發波長493 nm,發射波長518 nm;細胞核激發波長360 nm,發射波長450 nm),隨機選取中央部位拍照。使用Image-Pro Plus 6.0進行圖片合成及熒光強度分析。
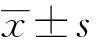
表1RTPCR引物序列
Tab.1Primers used with real-time PCR
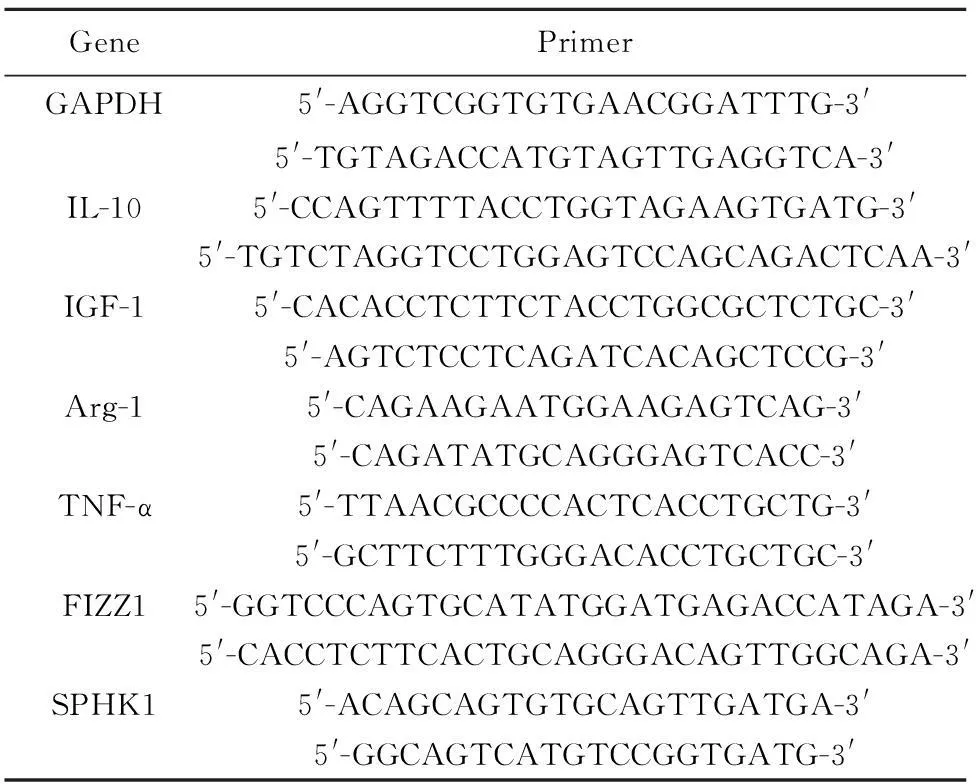
GenePrimerGAPDH5'-AGGTCGGTGTGAACGGATTTG-3'5'-TGTAGACCATGTAGTTGAGGTCA-3'IL-105'-CCAGTTTTACCTGGTAGAAGTGATG-3'5'-TGTCTAGGTCCTGGAGTCCAGCAGACTCAA-3'IGF-15'-CACACCTCTTCTACCTGGCGCTCTGC-3'5'-AGTCTCCTCAGATCACAGCTCCG-3'Arg-15'-CAGAAGAATGGAAGAGTCAG-3'5'-CAGATATGCAGGGAGTCACC-3'TNF-α5'-TTAACGCCCCACTCACCTGCTG-3'5'-GCTTCTTTGGGACACCTGCTGC-3'FIZZ15'-GGTCCCAGTGCATATGGATGAGACCATAGA-3'5'-CACCTCTTCACTGCAGGGACAGTTGGCAGA-3'SPHK15'-ACAGCAGTGTGCAGTTGATGA-3'5'-GGCAGTCATGTCCGGTGATG-3'
mRNA相對定量Ct值,WB光密度定量分析結果及免疫熒光強度分析結果進行Oneway ANOVA后,兩兩比較采用Student-Newman-Keuls檢驗,以P<0.05為差異有統計學意義。
2結果
2.1巨噬細胞分型相關分子mRNA的相對表達量如圖1,已向M1極化的RAW264.7細胞(LPS組),在ADMSCCM的作用后,其M1相關指標TNF-α mRNA表達明顯下降(P=0.039)。M2a相關性指標IGF-1 mRNA表達明顯下降(P=0.045),及Arg-1 mRNA表達上升(P=0.162),FIZZ1 mRNA表達無明顯變化(P=0.626)。M2b相關指標IL-10 mRNA表達明顯上升(P=0.046),SPHK-1mRNA表達無明顯差別(P=0.587)。
2.2巨噬細胞分型相關分子蛋白表達如圖2所示,RAW264.7細胞在LPS誘導后,IL-10、IL27Rα表達量下降(PIL-10=0.011,PIL27Rα<0.001),IL-12p40表達量上升(PIL-12p40=0.001),說明其向M1型巨噬細胞極化。經過ADMSCCM的誘導培養后,IL-10、IL27Rα表達量有所回升(PIL-10=0.012,PIL27Rα=0.048),IL-12p40表達量下降(PIL-12p40=0.005),說明已向M1型極化的RAW264.7細胞在ADMSCCM的作用下向M2型極化。
2.3免疫熒光標志按1.2.1的步驟處理的RAW264.7細胞。可見LPS-CM處理組相比LPS組熒光強度,其IL-12p40表達量明顯下降,而IL-10,IL-27Rα的表達量明顯升高(圖3)。
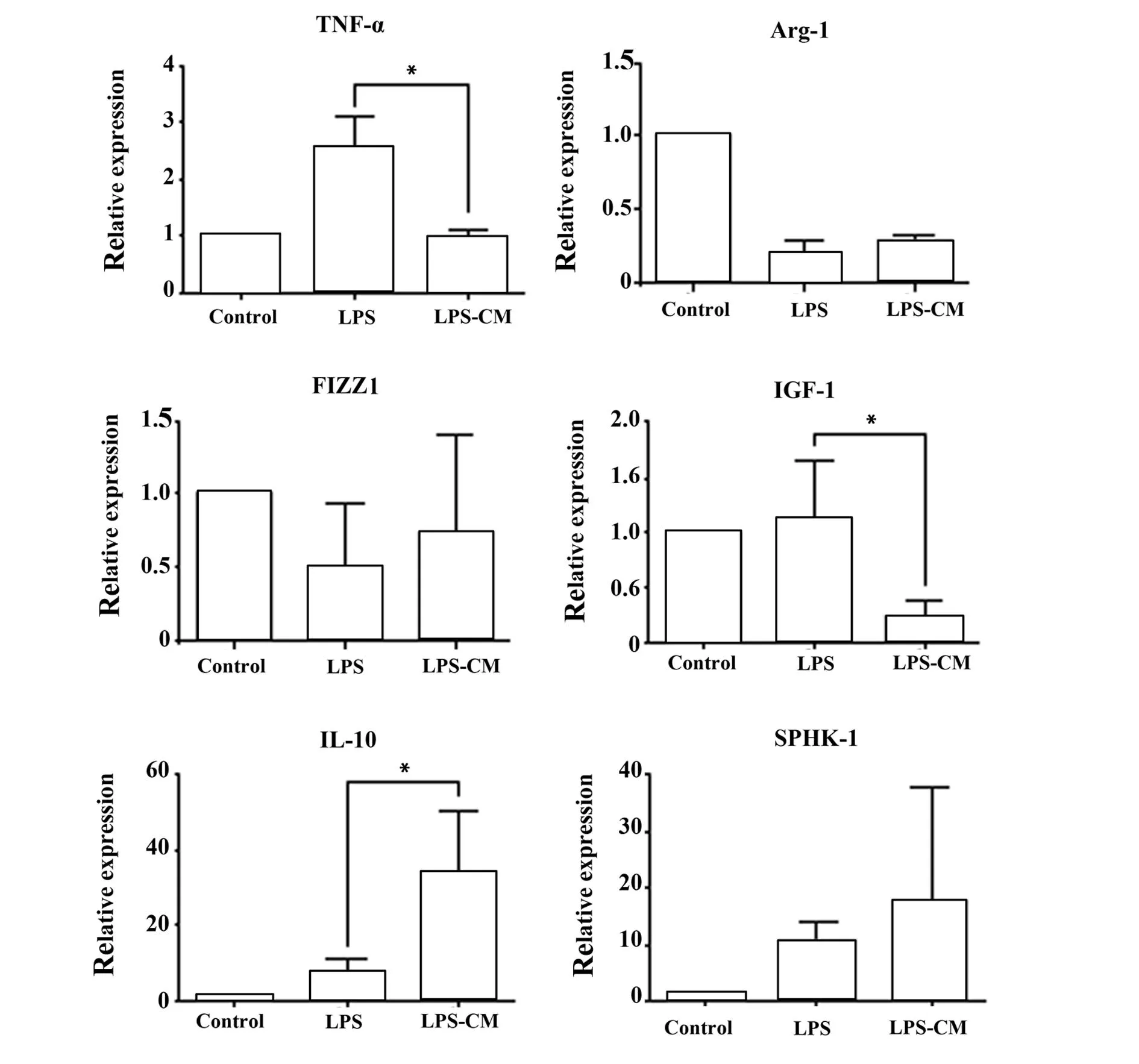
圖1 巨噬細胞分型相關分子mRNA的相對表達量Fig.1 Relative expression of macrophage type related mRNANote: *.P<0.05.
3討論
本課題以小鼠單核巨噬細胞白血病細胞(RAW264.7)代替腹腔貯存型巨噬細胞。使用脂多糖(LPS)將RAW264.7誘導為促炎的M1型巨噬細胞。使用含ADMSC分泌的可溶性細胞因子的培養基(ADMSCCM)模擬ADMSC移植治療。檢測以IL-12p40為代表的經典活化型巨噬細胞指標,以IL-27Rα為代表的創傷愈合型巨噬細胞指標,以及以IL-10為代表的調節型巨噬細胞指標。檢測發現LPS能誘導RAW264.7細胞向M1表型極化,而加入ADMSCCM后極化細胞能逆轉M1極化,成為M2型巨噬細胞。
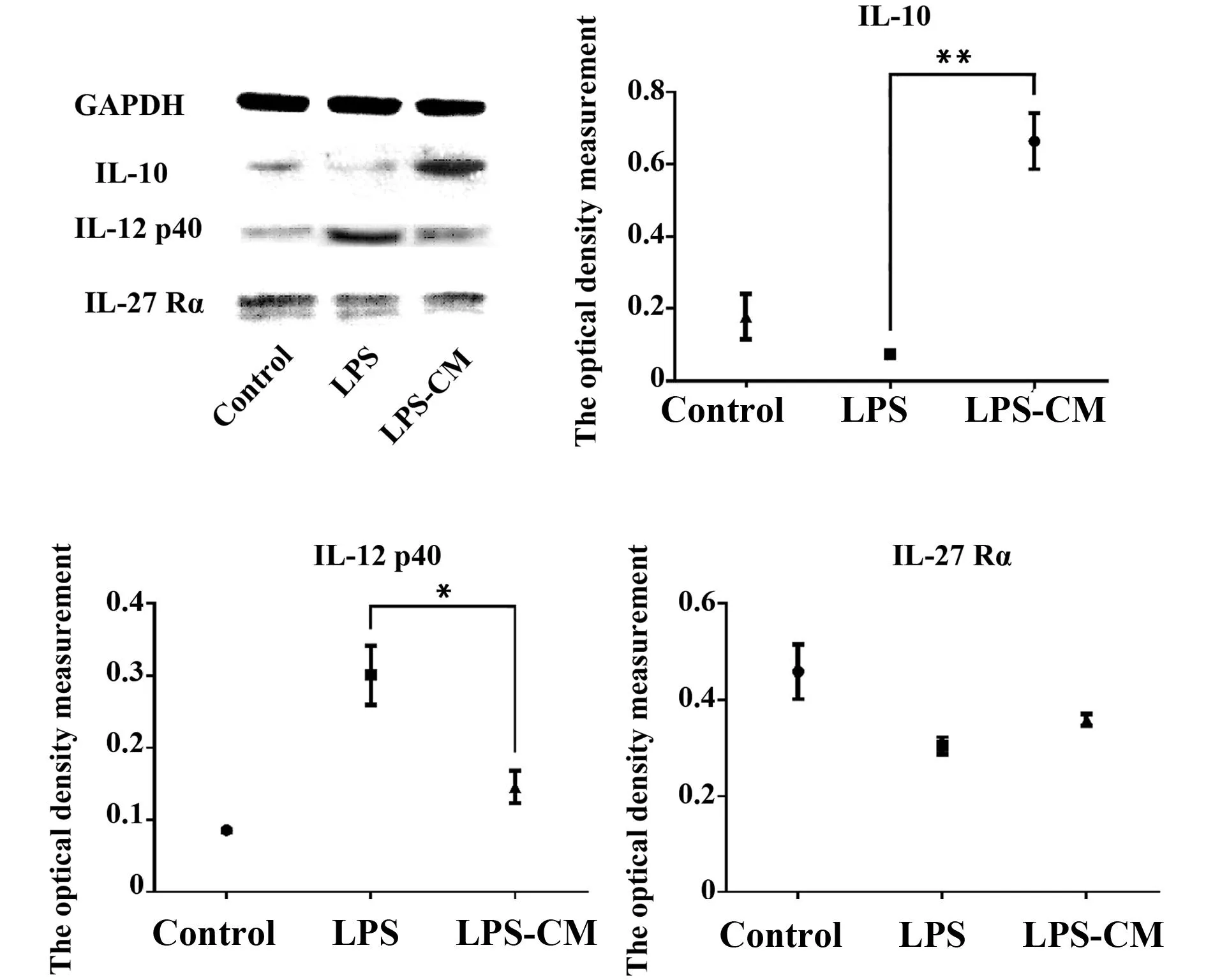
圖2 RAW264.7誘導極化時IL-10、IL-12 p40和IL27Rα的表達Fig.2 Expression of IL-10,IL-12 p40 and IL-27 Rα in different group of RAW264.7 cellNote: *.P<0.05;**.P<0.001.
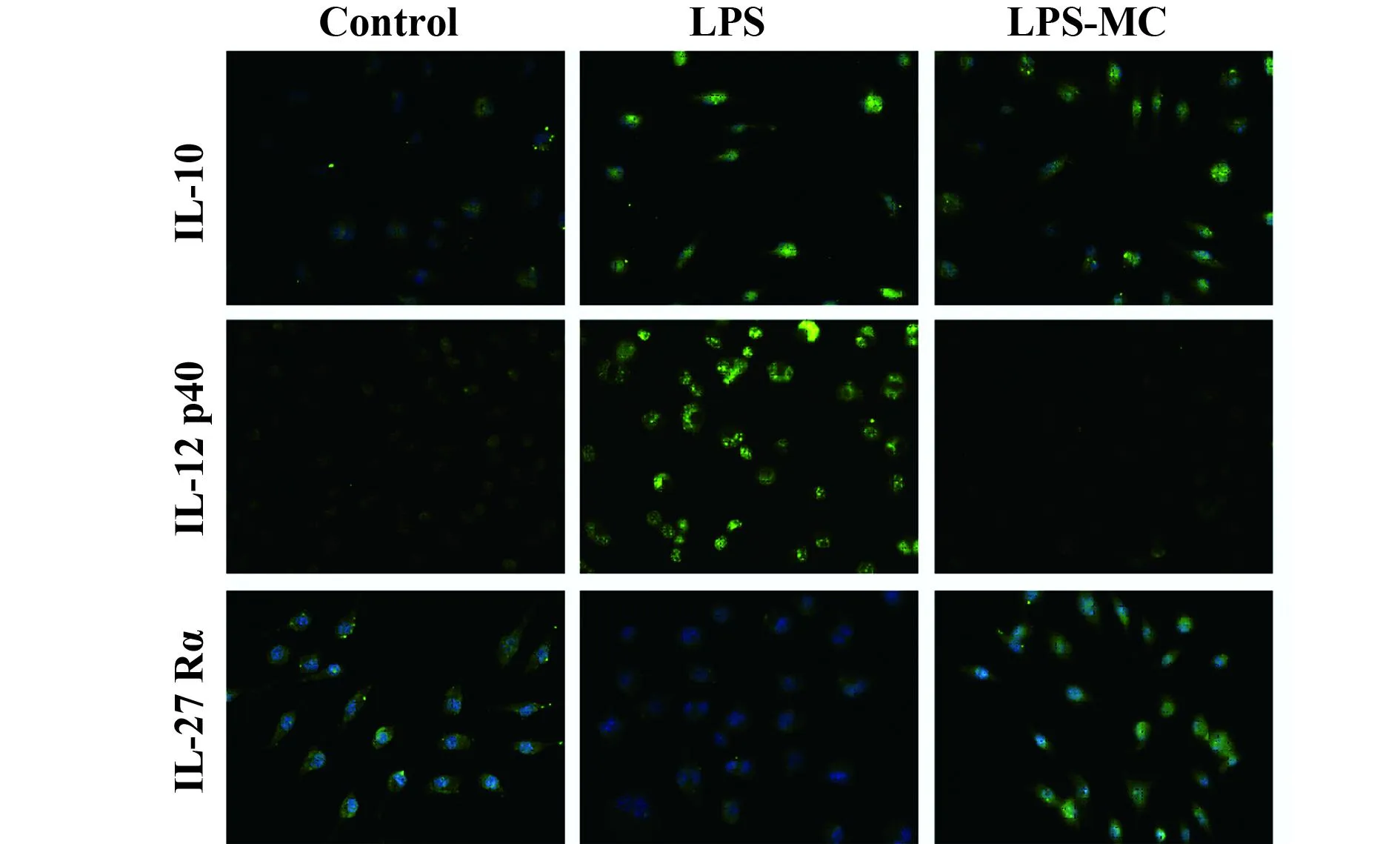
圖3 IL-10、IL-12p40和IL27Rα的免疫熒光標記Fig.3 Immunofluorescence labeling for IL-10,IL-12 p40 and IL-27 Rα
自從Fang等[5]使用ADMSC治療Ⅲ~Ⅳ級難治性急性移植物抗宿主病取得理想的療效后,利用ADMSC調節免疫功能收到了廣泛的關注。隨后,人們嘗試利用ADMSC在免疫調節方面的作用來治療過敏性鼻炎、類風濕性關節炎等[6-8],并就其具體機制進行了探討。這些研究絕大多數都是直接的將ADMSC及其分泌的細胞因子與局部組織、通路聯系起來,并在治療機制方面取得了一些進展。單核-巨噬細胞系統幾乎參與到了全身所有的炎性反應,而且是多種炎癥反應的啟動細胞。因此,研究ADMSC對這些具體的炎癥細胞的影響,或許可以解開ADMSC為什么會有如此強大的免疫調節作用。
巨噬細胞可按功能劃分為3個基本亞群:①經典活化型(M1)巨噬細胞,其代表標志為TNF-α、IL-12 p40等。②創傷愈合型(M2a)巨噬細胞,其代表標志為IGF-1、Arg-1、FIZZ1、IL-27 Rα等。③調節型巨噬細胞(包括M2b、M2c以及多種其他刺激活化的巨噬細胞)[1],其代表標志為IL-10、SPHK-1等。我們使用ADMSCCM干預LPS誘導后的RAW264.7細胞(M1),發現其M1型相關指標TNF-α mRNA以及IL-12 p40蛋白的表達量均顯著下降(P<0.05);而M2a、M2b/c部分相關指標有不同程度上升(IGF-1、IL-10 mRNA及IL-10蛋白變化均存在統計學差異)。說明在ADMSCCM的干預下,已極化為M1型的巨噬細胞可在一定程度上向M2型巨噬細胞轉化,其促炎作用明顯降低,促修復及免疫調節功能有所增強。
雖然M1型巨噬細胞可以分泌多種促炎因子,具強大的胞吞作用,可以更有效殺傷細胞內病原體[2]。但過度的免疫反應同樣會造成局部組織損傷,引起多種疾病。相對M2型巨噬細胞,M1型巨噬細胞主要分泌IL-12、TNF-α等細胞因子,它們不僅在局部組織中起到明顯的促炎作用,也是檢測M1型巨噬細胞的主要標志。IL-12是目前發現調節免疫應答范圍最廣的細胞因子,可調節NK細胞、巨噬細胞的非特異性免疫反應以及Th、CTL介導的特異性免疫反應[9]。TNF-α所誘發的級聯反應,也可導致局部炎癥的遷移及組織損傷[10]。ADMSC在局部組織中降低巨噬細胞IL-12和TNF-α的表達,無疑有助于改善局部的炎性損傷。
對于M2型巨噬細胞,IL-10的低表達是其共同特點。Mosser等[1]將其歸為調節型巨噬細胞(M2b/c)的特征。IL-10可以降低抗原呈遞作用,下調T細胞活性,還可抑制IL-1、IL-6、IL-8、THF-α、粒-巨噬細胞集落刺激因子(GM-CSF)和粒細胞集落刺激因子(G-CSF)的合成[11]。IL-27Rα是創傷愈合型(M2a)巨噬細胞的標志之一。IL-27雖然屬于IL-6/IL-12家族,但其對Th1型免疫的調節是具有雙向性的[12],并可負調控Th2型免疫反應[13],抑制Th17細胞分化[14],總體上發揮抗炎效果。ADMSC降低局部巨噬細胞IL-10、IL-27的表達,對于以炎性損傷為主要病變的疾病是非常有幫助的。
綜上所述,ADMSC在移植到局部組織時,其分泌的可溶性細胞因子中的某些成分,會影響到局部組織中貯存、遷移的巨噬細胞的極化方向,誘導促炎的經典活化型(M1)巨噬細胞向M2型巨噬細胞轉化,尤其是向調節型(M2b/c)巨噬細胞轉化,可減少過度存在的炎癥反應,減輕局部由于炎癥反應帶來的組織損傷。這一機制的建立,讓我們可以根據巨噬細胞參與的情況,初步明確適用于ADMSC移植治療的疾病,以及哪些治療效果好,哪些較差。從而指導今后的研究和臨床應用。目前,關于巨噬細胞激化(活化)的相關通路較為明確,M2型巨噬細胞主要依賴于IL-4/IL-13激活Jak/Stat6以及IL-10激活Jak/Stat3為主。而M1型巨噬細胞主要依賴LPS及其他炎癥因子激活IFN-γ通路。而間充質干細胞具體通過分泌哪些因子影響巨噬細胞激化方向,目前仍無明確的結論,這也是我們今后研究的重點。
參考文獻:
[1]Mosser DM,Edwards JP.Exploring the full spectrum of macrophage activation[J]. Nat Rev Immunol,2008,8(12):958-969.
[2]Mosser DM,Handman E.Treatment of murine macrophages with interferon-gamma inhibits their ability to bind leishmania promastigotes[J]. J Leukocyte Biol,1992,52(4):369-376.
[3]Hart PH,Bonder CS,Balogh J,etal.Differential responses of human monocytes and macrophages to IL-4 and IL-13[J]. J Leukocyte Biol,1999,66(4):575-578.
[4]Zuk PA,Zhu M,Ashjian P,etal.Human adipose tissue is a source of multipotent stem cells[J]. Mole Biol Cell,2002,13(12):4279-4295.
[5]Fang B,Song Y,Liao L,etal.Favorable response to human adipose tissue-derived mesenchymal stem cells in steroid-refractory acute graft-versus-host disease[J]. Transplantation Proceedings,2007,39(10):3358-3362.
[6]Cho KS,Park HK,Park HY,etal.IFATS collection:Immunomodulatory effects of adipose tissue-derived stem cells in an allergic rhinitis mouse model[J]. Stem cells,2009,27(1):259-265.
[7]Zhou B,Yuan J,Zhou Y,etal.Administering human adipose-derived mesenchymal stem cells to prevent and treat experimental arthritis[J]. Clin Immunol,2011,141(3):328-337.
[8]Gonzalez-Rey E,Gonzalez MA,Varela N,etal.Human adipose-derived mesenchymal stem cells reduce inflammatory and T cell responses and induce regulatory T cells in vitro in rheumatoid arthritis[J]. Ann Rheum Dis,2010,69(1):241-248.
[9]Cocco C,Pistoia V,Airoldi I.New perspectives for melanoma immunotherapy:role of IL-12[J]. Current Molecular Med,2009,9(4):459-469.
[10]Boissier MC,Assier E,Falgarone G,etal.Shifting the imbalance from Th1/Th2 to Th17/Treg:the changing rheumatoid arthritis paradigm[J]. Joint Bone Spine,2008,75(4):373-375.
[11]de Waal Malefyt R,Abrams J,Bennett B,etal.Interleukin 10(IL-10) inhibits cytokine synthesis by human monocytes:an autoregulatory role of IL-10 produced by monocytes[J]. J Exp Med,1991,174(5):1209-1220.
[12]Villarino AV,Stumhofer JS,Saris CJ,etal.IL-27 limits IL-2 production during Th1 differentiation[J]. J Immunol,2006,176(1):237-247.
[13]Owaki T,Asakawa M,Kamiya S,etal.IL-27 suppresses CD28-mediated correction of medicated IL-2 production through suppressor of cytokine signaling 3[J]. J Immunol,2006,176(5):2773-2780.
[14]Batten M,Li J,Yi S,etal.Interleukin 27 limits autoimmune encephalomyelitis by suppressing the development of interleukin 17-producing T cells[J]. Nature Immunol,2006,7(9):929-936.
[收稿2015-06-25修回2015-07-15]
(編輯倪鵬)
Induction of macrophages differentiation to M2 type by adipose derived mesenchymal stem cells
WANGLing-Ling,TANGLi-Li,SUNMeng,WANGTian-Yang,YOUHe-Yi,ZHANGChun-Wu,YANGYi-Rong,CHENJi-Cai,ZHOUMeng-Tao,CHENBi-Cheng.
TheFirstAffiliatedHospitalofWenzhouMedicalUniversity,Wenzhou325000,China
[Abstract]Objective:To explore the effect of adipose derived mesenchymal stem cells to regulate the differentiation of macrophage RAW264.7.Methods: First,we used RAW264.7 cells to simulate macrophage and induced them to M1 macrophage with lipopolysaccharide (LPS,1 μg/ml). Then we cultured these RAW264.7 cells in culture mediums which were previously used to culture adipose derived mesenchymal stem cells to imitate the transplantation of ADMSC.Last,the mRNA relative expression of IL-10,IGF-1,Arg-1,TNF-α,FIZZ1,SPHK-1 was detected by real-time PCR.The protein expression of IL-12 p40,IL-27 Rα,IL-10 was detected by Western blot.Results: After been cultured in ADMSCCM and induced by LPS,M1 markers (TNF-α mRNA,IL-12 p40;P<0.05) of the RAW264.7 cells declined while M2 markers (IGF-1 mRNA,IL-10 mRNA,IL-10;P<0.05) rose.Conclusion: ADMSC can secrete soluble cytokines to induce the RAW264.7 cell,which have been induced to the M1 macrophages,to differentiate towards M2 macrophages.
[Key words]Adipose derived mesenchymal stem cells;Macrophages;RAW264.7;Differentiation
中圖分類號R329.3
文獻標志碼A
文章編號1000-484X(2016)03-0332-05
作者簡介:王玲玲(1990年-),女,碩士,主要從事免疫學及脂肪間充質干細胞治療方面的研究,E-mail:893257713@qq.com。通訊作者及指導教師:陳必成(1974年-),男,碩士生導師,主要從事免疫學和胰腺炎方面的研究,E-mail:chenbicheng@hotmail.com。
doi:10.3969/j.issn.1000-484X.2016.03.008
①本文受浙江省公益性技術應用研究計劃(2013C33173,2013C37046)和浙江省自然科學基金(Y2110944,LY12H05005)。
②溫州醫學院附屬第一醫院,外科學重點實驗室,溫州325000。

