轉(zhuǎn)染沉默IGF1R基因的肝癌細胞株增殖、遷移及侵襲能力觀察
別彩群,黃秋燕,顏英,石珩,湯紹輝(廣州醫(yī)科大學附屬深圳沙井醫(yī)院,廣東深圳 5804;暨南大學附屬第一醫(yī)院)
?
·論著·
轉(zhuǎn)染沉默IGF1R基因的肝癌細胞株增殖、遷移及侵襲能力觀察
別彩群1,黃秋燕2,顏英2,石珩2,湯紹輝2(1廣州醫(yī)科大學附屬深圳沙井醫(yī)院,廣東深圳 518104;2暨南大學附屬第一醫(yī)院)
摘要:目的設(shè)計并篩選高效沉默胰島素樣生長因子1受體(IGF1R)基因的小干擾RNA(siRNA),構(gòu)建其慢病毒表達載體,觀察轉(zhuǎn)染沉默IGF1R基因的肝癌細胞株增殖、遷移及侵襲能力。方法根據(jù)siRNA設(shè)計原則,參照IGF1R mRNA序列設(shè)計3對siRNA序列及1對陰性對照序列,轉(zhuǎn)染肝癌細胞株Huh7 24 h后采用實時熒光定量PCR檢測IGF1R mRNA,篩選干擾效率最高的siRNA序列。構(gòu)建該序列的慢病毒表達載體,轉(zhuǎn)染293T細胞進行病毒包裝。將包裝好的慢病毒表達載體感染肝癌細胞株Huh7和Hep3B,篩選沉默IGF1R基因表達的穩(wěn)定細胞株。將上述穩(wěn)定細胞株擴大培養(yǎng),觀察細胞IGF1R mRNA表達變化及細胞增殖、遷移與侵襲能力變化。結(jié)果實時熒光定量PCR顯示,IGF1R_002序列在100 nmol/L濃度時抑制效率最高,達78.6%。與未感染任何病毒的Huh7、Hep3B細胞,感染pLVX-shRNA2空載體的Huh7、Hep38細胞相比,感染攜帶IGF1R干擾序列慢病毒的Huh7、Hep3B細胞IGF1R mRNA表達水平顯著下調(diào),細胞增殖活性明顯降低,細胞遷移和侵襲能力明顯受到抑制(P均<0.01)。結(jié)論篩選出1對高效沉默IGF1R基因的siRNA序列,即IGF1R_002;該siRNA介導的IGF1R基因沉默可明顯抑制肝癌細胞株Huh7和Hep3B增殖、遷移與侵襲。
關(guān)鍵詞:RNA干擾;人胰島素樣生長因子1受體基因;小干擾RNA;肝細胞癌
RNA干擾(RNAi)是指在進化過程中高度保守的、由雙鏈RNA誘發(fā)的、同源mRNA高效特異性降解的現(xiàn)象。小干擾RNA(siRNA)是RNAi過程中的關(guān)鍵中間產(chǎn)物。RNAi技術(shù)提供了一種經(jīng)濟、快捷、高效抑制特異基因表達的手段,目前已成為研究腫瘤等重大疾病基因治療的一種重要方法[1]。研究[2]顯示,由逆轉(zhuǎn)錄病毒構(gòu)建的慢病毒載體,因其不含致病基因,能夠感染體內(nèi)幾乎所有分裂及非分裂細胞,且具有轉(zhuǎn)移基因片段容量大、目的基因表達時間長、低免疫原性等優(yōu)點,已經(jīng)成為理想的基因轉(zhuǎn)移載體。胰島素樣生長因子1受體(IGF1R)是細胞生長分化的重要調(diào)節(jié)因子,可介導絲裂信號,防御各種凋亡損傷,誘導血管內(nèi)皮生長因子表達[3]。近年研究[4,5]表明,IGF1R在多種惡性腫瘤包括肝細胞癌(HCC)中的表達水平明顯上調(diào),抑制IGF1R的過表達可能成為惡性腫瘤基因治療的新靶點。本研究構(gòu)建靶向IGF1R基因的siRNA前體-短發(fā)夾RNA(shRNA)的慢病毒載體,感染肝癌細胞株Huh7和Hep3B,觀察轉(zhuǎn)染沉默IGF1R基因的肝癌細胞株增殖、遷移及侵襲能力,為肝癌的基因靶向治療開辟新途徑奠定基礎(chǔ)。
1材料與方法
1.1試劑LipofectamineTMRNAi MAX轉(zhuǎn)染試劑及LipofectamineTM2000轉(zhuǎn)染試劑購于美國Invitrogen公司,SYBR Green PCR Master Mix購于日本TOYOBO公司,pLVX-shRNA2載體購于美國Clontcch公司,TRIzol試劑及細胞增殖檢測試劑購于美國Promega公司,Huh7和HepG3B肝癌細胞株、HL-7702、293T細胞株購自武漢大學中國典型培養(yǎng)物保藏中心。
1.2靶向IGF1R基因的siRNA設(shè)計與篩選根據(jù) siRNA 設(shè)計原則,參照IGF1R mRNA序列(GenBank 數(shù)據(jù)庫:NM_000875)設(shè)計并合成3對siRNA序列(IGF1R_001、IGF1R_002、IGF1R_003)及1對無任何靶基因的siRNA(NC siRNA)作為陰性對照。培養(yǎng)Huh7肝癌細胞至匯合度為30%~50%,采用LipofectamineTMRNAi MAX轉(zhuǎn)染試劑進行細胞轉(zhuǎn)染siRNA。實驗分為4個組,即陰性對照組(NC siRNA)和3個實驗組(IGF1R_001、IGF1R_002、IGF1R_003),每組設(shè)置25、50和100 nmol/L 3個siRNA濃度梯度。轉(zhuǎn)染24 h后,按TRIzol試劑盒說明抽提Huh7細胞總RNA,逆轉(zhuǎn)錄合成cDNA并進行定量PCR擴增。IGF1R mRNA上游引物為5′-TTTCCCTTTGGAGTGTAGCT-3′,下游引物為5′-CATTGGCTGTGCAGTCAAG-3′,片段長度為180 bp;以18s rRNA為內(nèi)參照。每個樣本同時擴增3個復管,并連續(xù)進行3次實驗。采用相對定量法(2-ΔΔCt) 表示目的基因表達量。熒光定量PCR檢測結(jié)果顯示,3對轉(zhuǎn)染的Huh7細胞中IGF1R mRNA表達量均有不同程度的降低,抑制效率為31.7%~78.6%,其中IGF1R_002在100 nmol/L濃度時抑制效率最高,達78.6%,將此siRNA用于后續(xù)研究。
1.3靶向IGF1R基因的RNAi慢病毒載體構(gòu)建①篩選得到的高效沉默IGF1R基因的干擾序列,IGF1R_002的正義鏈為5′-CUGACUACAGGGAUCUCAUdTdT-3′,反義鏈為5′-AUGAGAUCCCUGUAGUCAGdTdT-3′。IGF1R基因靶序列為CTGACTACAGGGATCTCAT。②設(shè)計表達IGF1R_002的shRNA序列,上游序列為5′-gatccCTGACTACAGGGATCTCATtcaagagatgagatccctgtagtcagtttttttg-3′,下游序列為5′-aattcAAAAAAACTGACTACAGGGATCT-CATCTCTTGAATGAGATCCCTGTAGTCAGg-3′。③制備雙鏈IGF1R_002。將表達IGF1R_002的上游序列與下游序列等體積混合后,沸水浴中煮沸5 min, 72 ℃ 15 min,自然冷卻至室溫,此時即可與載體連接,-20 ℃ 保存。④取pLVX-shRNA2 載體行BamHⅠ與EcoRⅡ雙酶切,酶切產(chǎn)物與雙鏈IGF1R_002連接,構(gòu)建成pLVX-shRNA2-IGF1R_002慢病毒載體。重組載體送華大基因公司進行測序分析,測序結(jié)果顯示插入片段序列正確。
1.4pLVX-shRNA2-IGF1R_002慢病毒包裝及滴度測定轉(zhuǎn)染前24 h,將293T細胞以5×106細胞/皿的密度重新接種于10 cm 細胞培養(yǎng)皿并置于培養(yǎng)箱內(nèi)。24 h后,細胞密度70%~80%時即可用于轉(zhuǎn)染。將各DNA溶液(pLVX-shRNA2-IGF1R_002載體20 μg,pHelper1.0載體15 μg,pHelper2.0載體10 μg)、LipofectamineTM2000試劑與Opti-MEM 混合均勻,在室溫下溫育20 min。將混合液轉(zhuǎn)移至293T細胞培養(yǎng)液中,培養(yǎng)8 h后,以PBS液洗滌殘余的轉(zhuǎn)染混和物,加入含10%胎牛血清的細胞培養(yǎng)基繼續(xù)培養(yǎng)48 h。收集細胞上清液,經(jīng)過離心和過濾收集病毒濃縮液,-80 ℃保存。熒光顯微鏡下觀察發(fā)現(xiàn),幾乎所有293T細胞均發(fā)出較亮的綠色熒光,提示轉(zhuǎn)染效率高,病毒包裝成功。取其中1支,采用倍比稀釋法檢測病毒滴度,取最佳病毒滴度(2.78×108TU/mL)做后續(xù)實驗。
1.5pLVX-shRNA2-IGF1R_002慢病毒感染肝癌細胞株Huh7和HepG3B感染前24 h,取對數(shù)生長期的Huh7和HepG3B細胞分別按2×105個細胞/孔接種于24孔板,置于37 ℃、5% CO2培養(yǎng)箱內(nèi)培養(yǎng)。24 h后,細胞密度40%~50%時,加入各組包裝好的慢病毒及合適濃度的Polybrene。實驗分3組,每組設(shè)3個復孔,即pLVX-shRNA2-IGF1R_002慢病毒組(感染pLVX-shRNA2-IGF1R_002的Huh7和HepG3B細胞,簡稱IGF1R siRNA組)、空載體慢病毒組(感染pLVX-shRNA2空載體的Huh7和HepG3B細胞,簡稱NC組)及空白對照組(未感染任何病毒的Huh7和HepG3B細胞,簡稱BC組)。感染12 h后棄上清,更換為新鮮的完全培養(yǎng)基,72 h后在倒置熒光顯微鏡下觀察細胞,檢測綠色熒光蛋白表達情況,挑選熒光強度大的陽性克隆孔逐級擴大培養(yǎng),即可得到沉默IGF1R表達的穩(wěn)定細胞株,用于后續(xù)實驗。
1.6細胞IGF1R mRNA檢測培養(yǎng)上述3組細胞,48 h后收集細胞,按TRIzol試劑盒說明抽提細胞總RNA,逆轉(zhuǎn)錄合成cDNA并進行熒光定量PCR分析。IGF1R mRNA擴增引物同前,采用相對定量法,以2-ΔΔCt表示目的基因表達量。
1.7細胞增殖能力檢測取上述3組細胞,調(diào)整細胞濃度為1×105個/mL,接種于96孔板,每孔100 μL。收集各個時間點(0、24、48、72 h)的細胞,加入MTS。孵育4 h后,酶標儀測定OD490值,以O(shè)D值表示細胞增殖能力。
1.8細胞遷移和侵襲能力檢測對于細胞遷移實驗,取上述3組細胞,調(diào)整細胞濃度為1×106個/mL,取細胞懸液100 μL加入Transwell小室上室,下室加入600 μL完全培養(yǎng)基。在37 ℃、5%CO2孵育24 h后,取出小室,棄去培養(yǎng)液,用棉簽擦去上室未遷移的細胞,4%多聚甲醛固定20 min,0.1%結(jié)晶紫染色10 min,PBS洗滌3次并晾干,顯微鏡下觀察 6個視野細胞并拍照計數(shù)。對于細胞侵襲實驗,首先用Matrigel膠包被Transwell小室底部膜的上室面,置37 ℃下30 min使Matrigel聚合成凝膠,使用前進行基底膜水化,其余步驟同遷移實驗。
1.9統(tǒng)計學方法采用SPSS13.0統(tǒng)計軟件。計數(shù)資料的比較采用χ2檢驗;計量資料的比較采用ANOVA或獨立樣本t檢驗。P<0.05為差異有統(tǒng)計學意義。
2結(jié)果
與正常肝細胞HL-7702相比,肝癌細胞株Huh7和Hep3B細胞IGF1R mRNA的表達水平上調(diào)。IGF1R siRNA組、BC組、NC組Huh7細胞IGF1R mRNA相對表達量分別為2.946±0.324、10.771±1.375、11.042±1.261,Hep3B細胞IGF1R mRNA相對表達量分別為1.451±0.258、6.082±0.828、5.925±0.753,與BC組、NC組相比,IGF1R siRNA組Huh7和Hep3B細胞的IGF1R mRNA表達水平低(P均<0.01)。各組肝癌細胞株Huh7和Hep3B細胞增殖情況比較見表1、2。IGF1R siRNA組、BC組、NC組Transwell小室Huh7遷移細胞數(shù)分別為(213.17±5.85)、(250.83±8.77)、(255.17±6.24)個,Huh7侵襲細胞數(shù)分別為(238.17±4.79)、(293.33±18.16)、(296.17±18.49)個,Hep3B遷移細胞數(shù)分別為(17.17±1.94)、(100.83±18.14)、(99.17±23.66)個,Hep3B侵襲細胞數(shù)分別為(84.83±10.57)、(187.83±25.74)、(191.00±25.41)個,與BC組、NC組相比,IGF1R siRNA組肝癌細胞株Huh7和Hep3B細胞遷移能力和侵襲能力明顯受到抑制(P均<0.01)。
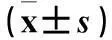
表1 各組Huh7細胞OD值比較
注:與BC組、NC組相比,*P<0.01。

表2 各組Hep3B細胞OD值比較
注:與BC組、NC組相比,*P<0.01。
3討論
胰島素樣生長因子軸(IGFs)由IGF1、IGF2、IGF1R、IGF2R、胰島素受體及IGF結(jié)合蛋白組成,IGFs所介導的信號通路在細胞生長、增殖、分化、凋亡等方面發(fā)揮重要作用,其表達異常與多種惡性腫瘤的發(fā)生發(fā)展密切相關(guān)[6]。IGF1R是細胞表面的酪氨酸蛋白激酶受體,它介導IGF1及大部分IGF2的生物學功能[7]。在HCC中,IGFs的失衡主要表現(xiàn)為IGF2和IGF1R過表達,且IGF2 mRNA與IGF1R mRNA的表達水平呈正相關(guān)。當IGF1R與相關(guān)配體結(jié)合后,可激活位于胞內(nèi)的酪氨酸激酶,啟動信號通路,促進細胞從G1期進入S期;同時激活兩條信號轉(zhuǎn)導通路,即PI3K/Akt和MAPK,進而促進細胞有絲分裂, 誘導細胞增生,抑制凋亡, 促進肝細胞惡性轉(zhuǎn)化[8~11]。IGF1R與腫瘤細胞的增殖、凋亡和轉(zhuǎn)化等過程密切相關(guān),但其對腫瘤細胞的遷移與侵襲作用目前尚不十分清楚。
在本研究中,我們根據(jù)siRNA設(shè)計原則,設(shè)計并合成了3對靶向IGF1R的siRNA序列,分別轉(zhuǎn)染肝癌細胞株Huh7及Hep3B,結(jié)果篩選出IGF1R_002的抑制效率最高,達78.6%。將表達IGF1R_002的shRNA序列克隆入pLVX-shRNA2 載體,構(gòu)建成pLVX-shRNA2-IGF1R_002慢病毒載體。將慢病毒感染肝癌細胞株Huh7和Hep3B,挑選熒光強度大的陽性克隆孔逐級擴大培養(yǎng),得到了沉默IGF1R基因表達的穩(wěn)定細胞株。一系列細胞實驗結(jié)果顯示,感染攜帶IGF1R干擾序列慢病毒的Huh7和Hep3B細胞IGF1R mRNA表達水平顯著下調(diào),細胞增殖活性明顯降低,細胞遷移能力和侵襲能力明顯受到抑制。這些結(jié)果提示,應(yīng)用RNAi技術(shù)沉默IGF1R基因表達可顯著抑制肝癌細胞株Huh7和Hep3B的生長,并降低其惡性生物學特征,為臨床上肝癌的基因靶向治療提供了新的思路。
參考文獻:
[1] Xu C, Lee SA, Chen X. RNA interference as therapeutics for hepatocellular carcinoma[J]. Recent Pat Anticancer Drug Discov, 2011,6(1):106-115.
[2] Habib R, Akhtar J, Taqi M, et al. Lentiviral vector-mediated survivin shRNA delivery in gastric cancer cell lines significantly inhibits cell proliferation and tumor growth[J]. Oncol Rep, 2015,34(2):859-867.
[3] Weng CJ, Hsieh YH, Tsai CM, et al. Relationship of insulin-like growth factors system gene polymorphisms with the susceptibility and pathological development of hepatocellular carcinoma[J]. Ann Surg Oncol, 2010,17(7):1808-1815.
[4] Singh P, Alex JM, Bast F. Insulin receptor (IR) and insulin-like growth factor receptor 1(IGF-1R) signaling systems: novel treatment strategies for cancer[J]. Med Oncol, 2014,31(1):805.
[5] Adachi Y, Yamamoto H, Ohashi H, et al. A candidate targeting molecule of insulin-like growth factor-I receptor for gastrointestinal cancers[J]. World J Gastroenterol, 2010,16(46):5779-5789.
[6] 湯紹輝,吳勝蘭,王曠靖,等.hAFP及hTERT雙啟動子調(diào)控的針對人IGF-Ⅱ基因的siRNA特異性抑制人肝癌細胞生長[J].中國病理生理雜志,2013,29(8):1422-1427.
[7] Wu XY, Wu ZF, Cao QH, et al. Insulin-like growth factor receptor-1 overexpression is associated with poor response of rectal cancers to radiotherapy[J]. World J Gastroenterol, 2014,20(43):16268-16274.
[8] Aleem E, Nehrbass D, Klimek F, et al. Upregulation of the insulin receptor and type Ⅰ insulin-like growth factor receptor are early events in hepatocarcinogenesis[J]. Toxicol Pathol, 2011,39(3):524-543.
[9] Nussbaum T, Samarin J, Ehemann V, et al. Autocrine insulin-like growth factor-Ⅱ stimulation of tumor cell migration is a progression step in human hepatocarcinogenesis[J]. Hepatology, 2008,48(1):146-156.
[10] Alexia C, Bras M, Fallot G, et al. Pleiotropic effects of PI-3′ kinase/Akt signaling in human hepatoma cell proliferation and drug-induced apoptosis[J]. Ann N Y Acad Sci, 2006,1090:1-17.
[11] Yan XD, Yao M, Wang L, et al. Overexpression of insulin-like growth factor-I receptor as a pertinent biomarker for hepatocytes malignant transformation[J]. World J Gastroenterol, 2013,19(36):6084-6092.
Construction of RNAi lentiviral vector targeting IGF1R gene and its effect on proliferation,migration and invasion of hepatocellular carcinoma cells
BIECaiqun1,HUANGQiuyan,YANYing,SHIHeng,TANGShaohui
(1ShenzhenShajingHospitalAffiliatedtoGuangzhouMedicalUniversity,Shenzhen518104,China)
Abstract:ObjectiveTo design and screen an effective small interfering RNA (siRNA) targeting human insulin-like growth factor 1 receptor (IGF1R) gene, to construct the siRNA lentiviral vector, and to observe its effect on the proliferation, migration and invasion of hepatocellular carcinoma cells. MethodsAccording to siRNA design principle, three siRNAs targeting IGF1R gene and one negative control siRNA were designed and synthesized. They were transfected into Huh7 cells. IGF1R mRNA expression levels in Huh7 cells were detected by real-time fluorescent quantitative PCR at 24 h after transfection, and we screened the most effective siRNA. After lentiviral expression vector was constructed, it was transfected into 293T cells and packed into lentiviral. Huh7 and Hep3B cells were infected with the pLVX-shRNA2-IGF1R_002 lentiviral to screen the stable cell lines. The stable cell lines were cultured in large. We detected the changes in the IGF1R mRNA expression, cell proliferation, cell migration and invasion. ResultsThe real-time fluorescent quantitative PCR showed that IGF1R_002 showed the highest inhibition effect (relative inhibition rate 78.6%) at the concentration of 100 nmol/L. The expression levels of IGF1R mRNA in Huh7 and Hep3B cells with the lentiviral were significantly reduced, the proliferation abilities were inhibited, and the abilities of cell migration and invasion were significantly decreased as compared with those of Huh7 and Hep3B cells without any virus infection and Huh7 and Hep3B cells infected with pLVX-shRNA2 empty vector (all P<0.01). ConclusionsThe most effective siRNA targeting human IGF1R gene, namely IGF1R_002, is screened out. The most effective siRNA-mediated IGF1R gene silencing can significantly suppress the proliferation, migration and invasion of Huh7 and Hep3B cells.
Key words:RNA interference; human insulin-like growth factor 1 receptor gene; small interfering RNA; hepatocellular carcinoma
(收稿日期:2015-11-27)
中圖分類號:R735.7
文獻標志碼:A
文章編號:1002-266X(2016)11-0001-04
doi:10.3969/j.issn.1002-266X.2016.11.001
通信作者簡介:湯紹輝(1965-),男,教授,博士生導師,主任醫(yī)師,主要研究方向為消化道腫瘤的診斷與治療。E-mail: tangshaohui205@163.com
第一作者簡介:別彩群(1973-),女,博士,副主任醫(yī)師,主要研究方向為消化系統(tǒng)疾病的診斷與治療。E-mail: looshy@aliyun.com
基金項目:深圳市科技計劃研究項目(JCYJ20140414160300592)。

